基于HPLC-MS与Cocktail探针药物法研究五味子提取物对大鼠CYP450酶的影响
2022-06-08童黄锦汪丽君苏联麟陆兔林
李 莉,童黄锦,汪丽君,苏联麟,陆兔林*,李 昱
1.亳州市食品药品检验中心,亳州 236800;2.南京中医药大学附属中西医结合医院,南京 210028;3.南京中医药大学药学院,南京 210023
药物进入机体后,以肝脏为中心,进行转化和代谢。在肝脏细胞中,除了少部分药物代谢酶位于细胞核、细胞质、细胞膜及线粒体外,绝大部分药物的代谢转化由位于内质网中的微粒体酶系进行调控。其中,细胞色素P450酶(CYP450酶)作为重要的Ⅰ相代谢酶[1],参与机体90%以上的药物代谢。药物对CYP450酶的诱导和抑制作用,对代谢药物在体内作用的过程、时间及药效的发挥具有重要作用。在种类方面,CYP450酶系包括CYP1、CYP2、CYP3 3个家族的9种主要亚型酶,具体包括CYP1A2、CYP2A6、CYP2B6、CYP2C8、CY2C9、CYPZC19、CYP2D6、CYP2E1、CYP3A4[2-7],在肝细胞中分别占CYP450酶总量的8.9%、5.0%、7.2%、4.7%、12.8%、6.8%、20.0%、7.0%、30.2%[6-9]。
Cocktail探针药物法即“鸡尾酒”探针药物法,即给予特定的探针药物后测定探针药物原型及其代谢产物,以此来反映该探针底物所对应的CYP450亚型酶的活性。近年来,探针药物法已被广泛应用于研究药物对CYP450酶活性的影响、药物代谢途径、药物相互作用、优化临床给药方案等方面,尤其在中西药合用领域中的应用尤为广泛。通过定量分析探针药物原型及相关代谢物,从而反映CYP450亚型酶的活性,探究所给药物对CYP450酶的影响,最终确定中西药间可能的相互作用机制。该方法对测定药物代谢酶活性、评价药物间相互作用、研究药物代谢酶活性与疾病之间关系以及遗传或非遗传因素对代谢酶活性的影响具有重要意义[5,10]。
五味子为木兰科植物五味子[Schisandrachinensis(Turcz.) Baill.]的干燥成熟果实,具有益气生津、收敛固涩等功效[11]。五味子的化学成分主要有挥发油、木脂素、有机酸、多糖、氨基酸、无机元素等[12]。现代研究表明,五味子醇提部位的木脂素类成分具有较好的抗炎、抗氧化作用。陈倩等[13]研究了五味子水提物对CYP3A类酶活性的影响,结果显示五味子水提物在整体上对CYP3A具有先抑制后诱导的双重调节作用,并确定了五味子中发挥诱导和抑制作用的相关成分。此外,胡芳[14]研究不同给药次数的生五味子、醋五味子对CYP1A2、CYP3A4、CYP2E1 3个CYP450亚型酶活性的影响,发现单次给药后,生五味子、醋五味子对CYP3A4和CYP2E1酶的活性发挥诱导作用,对CYPA2的活性发挥抑制作用;多次给药后,生五味子、醋五味子对CYP2E1酶的活性发挥抑制作用,对CYP3A4和CYPA1A2酶的活性基本无影响。本研究采用Cocktail探针药物法结合高效液相色谱串联质谱法(high performance liquid chromatography tandem mass spectrometry,HPLC-MS),以香豆素(CYP2A6)、安非他酮(CYP2B6)、紫杉醇(CYP2C8)、甲苯磺丁脲(CY2C9)、奥美拉唑(CYP2C19)、美托洛尔(CYP2D6)为探针底物,对6种重要的亚型酶的活性(CYP2A6、CYP2B6、CYP2C8、CY2C9、CYP2C19、CYP2D6)进行研究,全面、客观地评价五味子提取物对CYP450酶活性的影响,为进一步研究五味子降酶保肝的作用机制奠定理论基础。
1 仪器与材料
1.1 仪器
1200-6120B型HPLC-MS(包括G1322A真空脱气机、G1312B双元泵、G1367DA自动进样器、G1316柱温箱、ESI等,美国Agilent公司);Milli-Q Gradient A10型超纯水器(Millipore,Bedford,MA,USA);KQ-500B型超声清洗器(昆山超声仪器有限公司);MS105DU型电子天平(十万分之一,瑞士Mettler Toledo公司);ALLEGRA X-22型冷冻离心机(德国贝尔曼库尔特公司);恒温磁力搅拌器(荣华仪器制造有限公司);HGC-96A型氮吹仪(中国上海禾工科学仪器有限公司);XW-80A型微型涡旋混合仪(上海沪西分析仪器厂有限公司);HP-01型无油真空泵(天津市恒奥科技发展有限公司)。
1.2 试药
奥美拉唑(编号LOT#Y13O6C4251)、甲苯磺丁脲(编号LOT#40715)、香豆素(编号LOT#TM0520CA14)、紫杉醇(编号LOT#T1006F4090)、地西泮(编号LOT#A16O6L4576),质量分数均在98%以上,均购自上海源叶生物科技有限公司;盐酸安非他酮(编号LOT#100671-200301)、大黄酸(编号LOT#0757-9804),质量分数均在98%以上,均购自中国食品药品检定研究院;美托洛尔(编号LOT#10084-201303,质量分数为99%,中国食品药品检定研究院);甲醇(色谱级,山东禹王实业有限公司);乙腈(色谱级,美国Merck公司);其他试剂均为分析纯;水为超纯水。
1.3 动物
SD健康大鼠,清洁级,雄性,体质量180~200 g,许可证编号SCXK(沪)2014-0006,购自上海杰思捷实验室动物有限公司。实验前于南京中医药大学实验动物中心饲养1周,以适应实验室环境,给予标准光照周期(14 h光照、10 h黑暗),实验室饲养温度维持在20~25 ℃,相对湿度控制在60%~70%,给予普通饲料,自由饮水,适应性喂养1周后进行实验。
2 方法与结果
2.1 溶液的配制及血浆的采集
2.1.1对照品与混合对照品溶液的配制 单个探针储备液的配制:分别精密称取适量的香豆素、甲苯磺丁脲、氯唑沙宗、奥美拉唑、盐酸安非他酮、紫杉醇对照品,置于2 mL量瓶中,分别用甲醇溶解,定容,摇匀,即得单个对照品储备液,置于4 ℃冰箱中保存,备用。混合对照品溶液的配制:精密吸取上述单个对照品的储备液各适量,置于25 mL量瓶中,用甲醇定容至刻度,配制成甲苯磺丁脲质量浓度为120.12 μg·mL-1、奥美拉唑质量浓度为138.4 μg·mL-1、氯唑沙宗质量浓度为102.2 μg·mL-1、香豆素质量浓度为205.76 μg·mL-1、盐酸安非他酮质量浓度为101.44 μg·mL-1、紫杉醇质量浓度为197.4 μg·mL-1的混合对照品溶液,置于4 ℃冰箱中保存,备用。
分别精密吸取上述混合对照品溶液8.0、6.0、4.0、2.5、1.0、0.5、0.2、0.1 mL,置于25 mL量瓶中,加甲醇稀释、定容至刻度,得到一系列质量浓度的混合对照品溶液(甲苯磺丁脲质量浓度:96.096 0、72.072 0、48.048 0、30.030 0、12.012 0、6.006 0、2.402 4、1.201 2 μg·mL-1;奥美拉唑质量浓度:110.720 0、83.040 0、55.360 0、34.600 0、13.840 0、6.920 0、2.768 0、1.384 0μg·mL-1;氯唑沙宗质量浓度:81.760 0、61.320 0、40.880 0、25.550 0、10.220 0、5.110 0、2.044 0、1.022 0 μg·mL-1;香豆素质量浓度:164.608 0、123.456 0、82.304 0、51.440 0、20.576 0、10.288 0、4.115 2、2.057 6 μg·mL-1;盐酸安非他酮质量浓度:81.152 0、60.864 0、40.576 0、25.360 0、10.144 0、5.072 0、2.028 8、1.014 4 μg·mL-1;紫杉醇质量浓度:157.920 0、118.440 0、78.960 0、49.350 0、19.740 0、9.870 0、3.948 0、1.974 0 μg·mL-1),置于4 ℃冰箱中保存,备用。
2.1.2内标溶液的配制 精密称取地西泮对照品5.15 mg,置于5 mL量瓶中,加甲醇溶解,定容至刻度,摇匀,作为地西泮储备液(质量浓度1.03 mg·mL-1),置于4 ℃保存。
精密量取地西泮储备液1.00 mL,置于25 mL量瓶中,加甲醇定容至刻度,摇匀,即得质量浓度为41.2 μg·mL-1的地西泮内标液,置于4 ℃保存,备用。
精密称取大黄酸对照品5.05 mg,置于5 mL量瓶中,加甲醇溶解,定容至刻度,摇匀,作为大黄酸储备液(质量浓度1.01 mg·mL-1),置于4 ℃保存,备用。
精密量取大黄酸储备液1.0 mL,置于25 mL量瓶中,加甲醇定容至刻度,摇匀,即得质量浓度为40.4 μg·mL-1的大黄酸内标液,置于4 ℃保存,备用。
2.1.3Cocktail探针溶液的配制 精密称取香豆素、盐酸安非他酮、甲苯磺丁脲、奥美拉唑、氯唑沙宗、紫杉醇各25 mg,加入5 mL·L-1CMC-Na溶液研磨均匀,制成混悬液,即得(现配现用)。
2.1.4空白血浆样品的采集 取空白大鼠眼内眦静脉血约1 mL,置于含有肝素钠1.5 mL的离心管中,以14 000 r·min-1离心10 min,收集血浆,置于-80 ℃保存,备用。
2.1.5含药血浆样品的采集 空白大鼠给予混合探针药物后3 h左右,取大鼠眼内眦静脉血约1 mL,置于含有肝素钠1.5 mL的离心管中,以14 000 r·min-1离心10 min,收集上层血浆,置于-80 ℃保存,备用。
2.2 色谱及质谱条件
2.2.1色谱条件 采用Merck牌Purospher®STAR LP RP-18 endcapped (Hibar®RT 250 mm×4.6 mm,5 μm)色谱柱。流动相:0.01 mol·L-1的乙酸铵(A)-甲醇(B)。梯度洗脱:0~15 min,20%~40%B;15~30 min,40%~55%B;30~40 min,55%~58%B;40~50 min,58%~70%B;50~58 min,70%~80%B;58~60 min,20%B)。流速:1 mL·min-1。采用190~400 nm全波长扫描后选取最佳波长进行检测,最终确定的检测波长为甲苯磺丁脲、地西泮(IS+)、紫杉醇、大黄酸(IS-)230 nm,盐酸安非他酮250 nm,香豆素275 nm,氯唑沙宗280 nm,奥美拉唑302 nm。柱温:25 ℃。进样量:10 μL。
2.2.2质谱条件 离子化方式:电喷雾离子化(electrospray ionization,ESI);离子极性:选用正(positive)、负(negative)离子同时检测;检测模式:选择性反应离子监测(selective reaction ion monitoring,SIM);干燥气流速:80 mL·min-1;干燥气温度:350 ℃;毛细管电压:3 000 V;雾化器压力:35 psi;碰撞电压(fragmentor voltage)及定量分析离子质荷比(m/z)见表1。
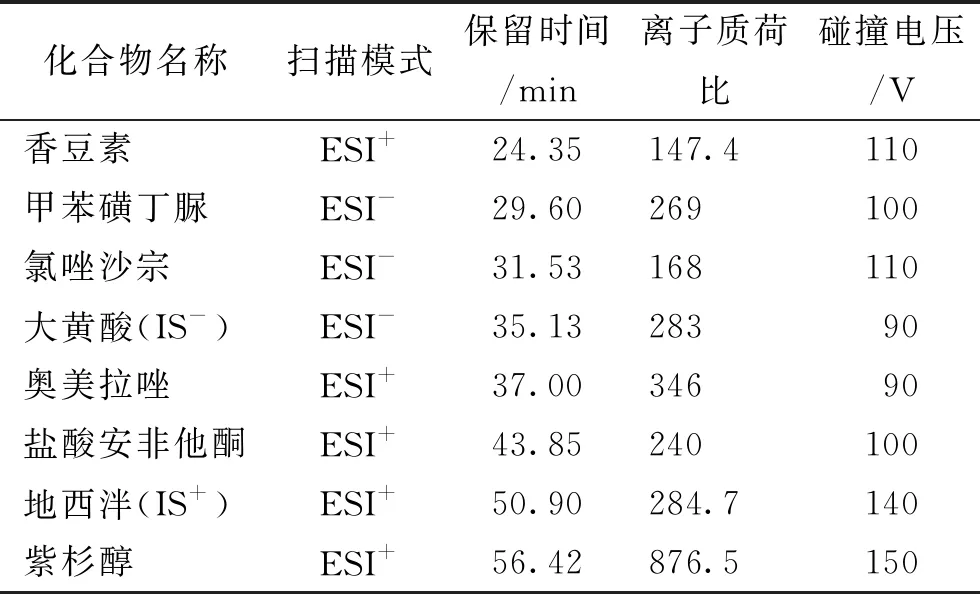
表1 6种CYP450探针药物和内参物的质谱参数
2.3 血浆样品溶液处理
精密吸取空白大鼠血浆上清液100 μL,置于离心管中,加入混合对照品溶液10 μL(甲苯磺丁脲的质量浓度为96.096 μg·mL-1、奥美拉唑的质量浓度为110.72 μg·mL-1、氯唑沙宗的质量浓度为81.76 μg·mL-1、香豆素的质量浓度为164.608 μg·mL-1、盐酸安非他酮的质量浓度为81.152 μg·mL-1、紫杉醇的质量浓度为157.92 μg·mL-1,下同),地西泮内标液10 μL(质量浓度为41.2 μg·mL-1,下同)和大黄酸内标液10 μL(质量浓度为40.4 μg·mL-1,下同),混合均匀后,加入乙腈450 μL,涡旋振荡3 min,以14 000 r·min-1离心20 min,取上清400 μL;剩余部分加0.3 mol·L-1的盐酸10 μL,再加乙腈450 μL,涡旋振荡3 min,以14 000 r·min-1离心20 min,取上清400 μL,用氮气吹干后,加入不加盐酸处理的上清液,继续用氮气吹干,用体积分数50%乙腈100 μL溶解,进样10 μL进行分析。
2.4 质控样品溶液的配制
吸取混合对照品母液适量,用甲醇稀释为高、中、低3种不同质量浓度的对照品溶液。从-20 ℃中取出大鼠空白血浆,室温解冻后,取100 μL置于离心管中若干份,分别加入低、中、高质量浓度混合对照品溶液10 μL,加入内标液10 μL,混合均匀,分别得到低质量浓度质控样品(QCL)、中质量浓度质控样品(QCM)、高质量浓度质控样品(QCH)3个质量浓度的混合质控样品溶液,置于4 ℃冰箱中保存,备用。
2.5 方法学验证
2.5.1专属性 分别吸取6个不同大鼠的空白血浆、对照样品溶液以及给药后的含药血浆各100 mL,按照2.2.1项下的方法进行处理后,进样分析。结果表明,在选定的色谱及质谱条件下,各探针药物的保留时间分别约为24.35 min(香豆素)、29.60 min(甲苯磺丁脲)、31.53 min(氯唑沙宗)、35.13 min[大黄酸(IS-)]、37.00 min(奥美拉唑)、43.85 min(盐酸安非他酮)、50.90 min[地西泮(IS+)]、56.42 min(紫杉醇),相互之间无干扰,峰形良好,且与周围峰的分离度均大于1.5,血浆中的内源性杂质对探针药物的测定无影响,具有良好的特异性和分离度。结果见图1、图2。

注:A.大鼠空白血浆;B.大鼠空白血浆加探针底物和内标;C.大鼠含药血浆;1.香豆素;2.甲苯磺丁脲;3.氯唑沙宗;4.大黄酸(IS-);5.奥美拉唑;6.盐酸安非他酮;7.地西泮(IS+);8.紫杉醇。
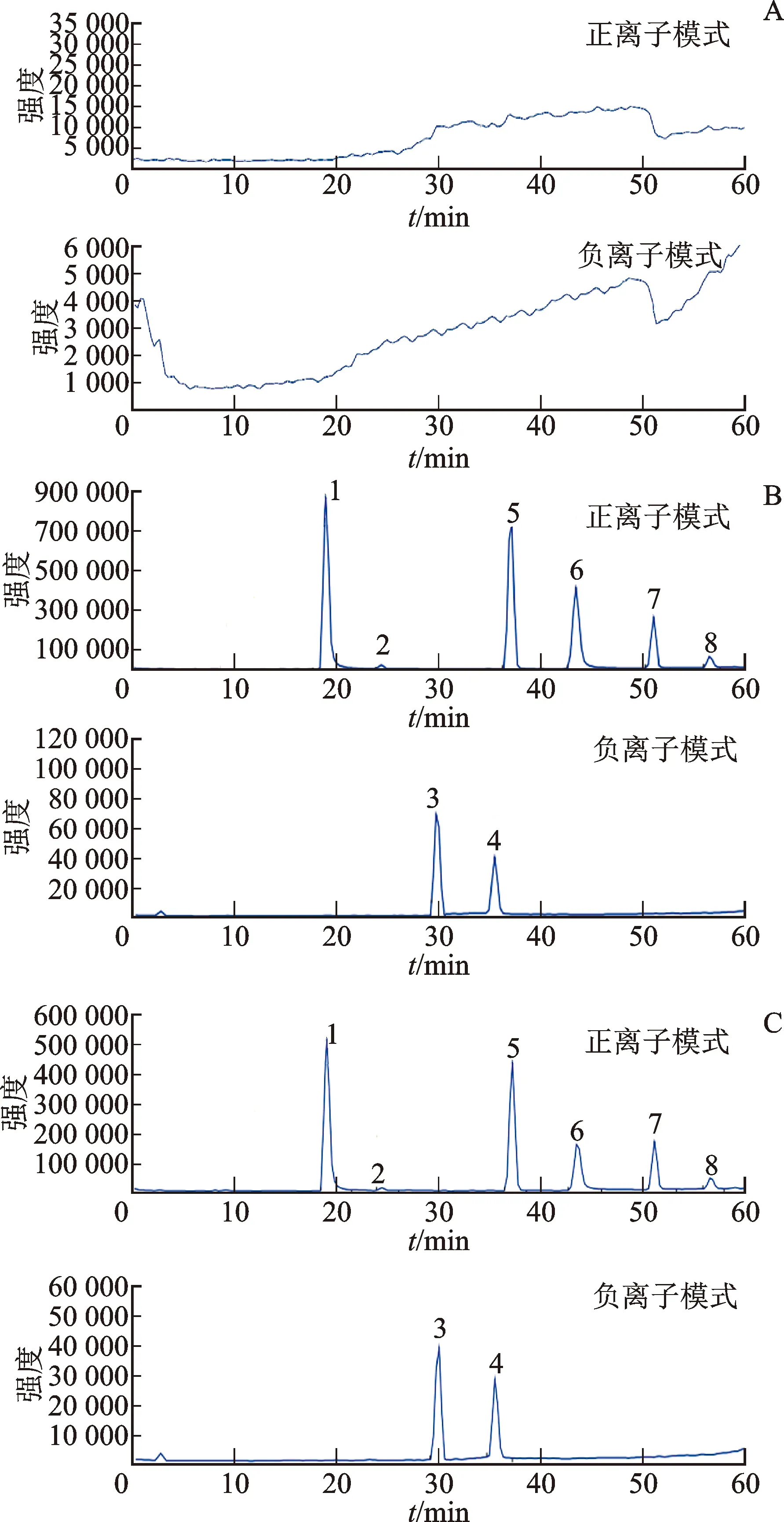
注:A.空白血浆;B.空白血浆中的探针药物及内标;C.给药2.5 h后血浆中的探针药物及内标;1.香豆素;2.甲苯磺丁脲;3.氯唑沙宗;4.大黄酸(IS-);5.奥美拉唑;6.盐酸安非他酮;7.地西泮(IS+);8.紫杉醇。
2.5.2标准曲线与线性范围 从-20 ℃冰箱中取出大鼠空白血浆,室温解冻后,取100 μL置于离心管中若干份,分别加入已稀释的不同质量浓度的混合对照品溶液10 μL,加入内标液地西泮和大黄酸各10 μL,混合均匀,按照2.1.1项下方法进行处理后,分别制成香豆素质量浓度分别为0.205 8、0.411 5、1.028 8、2.057 6、5.144 0、8.230 4、12.345 6、16.460 8 μg·mL-1;奥美拉唑质量浓度分别为0.138 4、0.276 8、0.692 0、1.384 0、3.460 0、5.536 0、8.304 0、11.072 0 μg·mL-1;盐酸安非他酮质量浓度分别为0.101 4、0.202 9、0.507 2、1.014 4、2.536 0、4.057 6、6.086 4、8.115 2 μg·mL-1;紫杉醇质量浓度分别为0.197 4、0.394 8、0.987 0、1.974 0、4.935 0、7.896 0、11.844 0、15.792 0 μg·mL-1;甲苯磺丁脲质量浓度分别为0.120 1、0.240 2、0.600 6、1.201 2、3.003 0、4.804 8、7.207 2、9.609 6 μg·mL-1;氯唑沙宗质量浓度分别为0.102 2、0.204 4、0.511 0、1.022 0、2.555 0、4.088 0、6.132 0、8.176 0 μg·mL-1的溶液。每个质量浓度平行3份。进样10 μL分析。记录色谱图,以峰面积(As)与内标峰面积(Ai)之比(As/Ai)为纵坐标(y)、对照品的质量浓度为横坐标(x),进行线性回归分析。结果见表2。表明各探针药物在标准曲线的质量浓度范围内线性关系良好。

表2 大鼠血浆中各探针药物的线性关系结果
2.5.3精密度 从-20 ℃取出大鼠空白血浆,室温解冻后,取100 μL置于离心管中若干份,按照2.4项下的方法对样品进行处理,得QCH、QCM、QCL 3个质量浓度的混合质控样品,每个质量浓度的样品平行5份。考察方法的批内精密度与批间精密度。每次进样10 μL进行HPLC分析,根据标准曲线计算后续测定样品的质量浓度,结果见表3。

表3 血浆中各探针药物的精密度实验结果
结果表明,甲苯磺丁脲、奥美拉唑、氯唑沙宗、香豆素、盐酸安非他酮及紫杉醇3个质量浓度质控样品的批内精密度和批间精密度均小于15%,符合《生物样品测定指导原则》中的要求。
2.5.4稳定性 从-20 ℃中取出大鼠空白血浆,室温解冻后,取100 μL置于离心管中若干份,按照2.4项下的方法对样品进行处理,得QCH、QCM、QCL 3个质量浓度的混合质控样品,每个质量浓度的样品平行5份。考察质控样品在室温下放置0、24 h,且经过3次冻融循环以及-20 ℃存放30 d后的样品稳定性,每次进样10 μL进行HPLC分析,根据标准曲线计算待测样品的质量浓度。结果见表4、表5。

表4 血浆中各探针药物的常温稳定性实验结果

表5 血浆中各探针药物冻融稳定性实验结果
结果表明,大鼠血浆中甲苯磺丁脲、奥美拉唑、氯唑沙宗、香豆素、盐酸安非他酮及紫杉醇3个质量浓度质控样品的RSD值在室温条件下质量浓度变化均在15%以内;在反复冻融条件下质量浓度变化均在15%以内;在冷冻条件下质量浓度变化均在15%以内。表明上述探针药物在室温放置、反复冻融、冷冻条件下均比较稳定,《符合生物样品测定指导原则》中的要求。
2.5.5准确度 从-20 ℃中取出大鼠空白血浆,室温解冻以后,取100 μL置于离心管中若干份,按照2.4项下的方法对样品进行处理,得QCH、QCM、QCL 3个质量浓度的混合质控样品,每个质量浓度的样品平行5份。进样10 μL分析,记录各探针及内标的峰面积,并计算各探针药物与内标地西泮峰面积的比值(A)。另配制不经血浆化处理的相应质量浓度的高、中、低混合对照品溶液,取10 μL直接进样分析,记录各探针及内标峰面积,并计算各探针药物与内标地西泮峰面积的比值(B),利用(A/B)×100%计算各探针底物的提取回收率(绝对回收率);另外将A代入随行标准曲线,计算药物的质量浓度,记为a,以质控样品表示的理论质量浓度为b,利用(a/b)×100%计算各探针底物的方法回收率。结果见表6。

表6 血浆中各探针药物的准确度实验结果
结果表明,大鼠血浆中甲苯磺丁脲、奥美拉唑、氯唑沙宗、香豆素、盐酸安非他酮及紫杉醇3个质量浓度的质控样品提取回收率为(85.72%±5.13%)~(99.47%±1.43%),且RSD值均在15%以内;质控样品方法回收率为(86.58%±2.98%)~(108.90%±8.23%),且RSD值均在15%以内,均符合《生物样品分析方法测定指导原则》中的要求。
2.6 五味子对大鼠6种亚型酶的影响
2.6.1五味子提取物的制备 将五味子(100 g)在体积分数为85%的乙醇溶液中回流提取2次,每次2 h。合并提取物,在40 ℃条件下减压浓缩。将该部分溶解在质量浓度为1.0 g·mL-1的羧甲基纤维素钠(CMC-Na)溶液中,并给大鼠服用。
2.6.2动物分组及给药 取12只SD大鼠,随机分为2组,空白组和五味子组,每组6只,单次给予五味子提取液,剂量为3.5 g·kg-1;空白组给予同等剂量的质量浓度为1.0 g·mL-1的CMC-Na溶液。5 min后给予30~50 mg·kg-1Cocktail混合探针溶液。分别于给探针药前0 min和给探针药后3、9、15、20、30 min及1、1.5、2、2.5、3、3.5、4、6、8、10、12、24 h,于SD大鼠眼内眦静脉丛取血约0.5~1 mL,置于肝素钠采血管中,以14 000 r·min-1离心20 min,收集上层血浆,置于-80 ℃保存,备用。
2.6.4大鼠血浆中6种探针药物的血药浓度-时间曲线(药-时曲线) 单次灌胃给予五味子醇提浓缩液前、后,测得甲苯磺丁脲、奥美拉唑、氯唑沙宗、香豆素、盐酸安非他酮及紫杉醇的血药质量浓度,绘制该6种探针药物的药-时曲线,见图3。
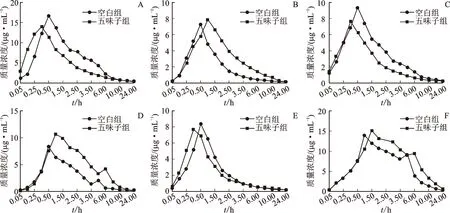
注:A.香豆素;B.氯唑沙宗;C.甲苯磺丁脲;D.奥美拉唑;E.盐酸安非他酮;F.紫杉醇。
2.6.5大鼠血浆中6种探针药物的药动学参数 6种探针药物的药代动力学数据经DAS 3.2处理,并用SPSS 26.0软件分析生物半衰期(t1/2)、机体总消除率(CLz/F)、药-时曲线下面积(AUC)、平均滞留时间(MRT)、达峰时间(tmax)、最大血药质量浓度(Cmax)。结果见表7。
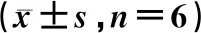
表7 单次给予五味子后6种探针药物的药动学参数
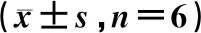
表7(续) 单次给予五味子后6种探针药物的药动学参数
结果表明,香豆素的AUC(0→t)、AUC(0→∞)、Cmax、tmax显著下降,CLz/F显著上升;奥美拉唑的AUC(0→t)、AUC(0→∞)、Cmax、MRT(0→t)显著上升;紫杉醇的AUC(0→t)、AUC(0→∞)、Cmax、MRT(0→t)、t1/2显著上升;盐酸安非他酮的AUC(0→t)、t1/2、tmax显著下降;甲苯磺丁脲的AUC(0→t)、AUC(0→∞)、Cmax、t1/2、tmax显著下降;氯唑沙宗的AUC(0→t)、AUC(0→∞)、Cmax、t1/2、tmax显著上升,CLz/F显著下降。
综上所述,单次灌胃给予五味子提取物,可以抑制大鼠CYP1A2、CYP2D6、CYP2C19、CYP2C8和CYP2E1酶的活性,诱导CYP3A4、CYP2A6、CYP2B6和CYP2C19酶的活性。
3 讨论
探针药物法是指药物经过CYP450酶代谢后,测定代谢物和原型药的比例或速率,来衡量CYP450酶代谢能力的方法。该方法己广泛用于CYP450酶活性的研究,但每一种探针药物只能用于一种同工酶的测定,故通常对CYP酶的作用是分开评估的(一次评估一种亚型)。这样的常规方法既费时又费力,且成本很高。将2种及2种以上经不同酶代谢的药物同时给予的方法称为Cocktail探针药物法,该方法最初用于评估药物与代谢酶在体内的相互作用,现在的应用范围则更加广泛,可用于体内、外测定CYP450酶的活性。Cocktail法的优点在于多个代谢途径的信息可在单个实验过程中获得,省时、经济,将个体间影响降至最低。
由于Cocktail法在研究药物代谢方面的优势,将其广泛用于中药的代谢研究,对于促进中药基础理论的研究和中药的现代化具有重要意义,同时对于中药在临床上的合理应用,提高联合用药的安全性和有效性具有重要的意义。
本实验采用了整体动物Cocktail探针药物法,联用LC/MS分析技术,通过比较香豆素、安非他酮、紫杉醇、甲苯磺丁脲、奥美拉唑、氯唑沙宗药动参数的差异,研究了五味子对大鼠CYP1A2、CYP2A6、CYP2B6、CYP2C8、CY2C9、CYPZC19、CYP2D6、CYP2E1、CYP3A4 9种亚型酶的作用,并通过比较活性差异,从而全面、客观地评价五味子醇提取物对CYP450酶活性的影响,体现药物相互作用在整个药物代谢过程中的整体性,其结果比离体实验更具有说服力。为探讨五味子保肝作用的机制提供了科学的依据,并对临床用药具有一定的指导作用。
