甲磺酸阿帕替尼治疗肾透明细胞癌的实验和临床研究
2022-06-07张倩茹刘建坤王永欣李铁钢高冬梅赵瑞景朱铁年
张倩茹,刘建坤,王永欣,李铁钢,高冬梅,赵瑞景,朱铁年
肾癌是常见泌尿系统恶性肿瘤[1]。数据证实,抑制血管内皮生长因子(VEGF)可诱导肿瘤缩小并延长无进展生存期[2]。甲磺酸阿帕替尼可选择性结合至受体细胞内ATP结合域,从而抑制VEGFR-2介导血管生成。研究表明,甲磺酸阿帕替尼在治疗多种实体瘤中疗效显著[3],但在肾癌方面研究少有报道,故本研究探讨甲磺酸阿帕替尼对人肾癌裸鼠移植瘤生长的抑制作用及其对CD34和Ki-67表达的影响,并评估其对晚期肾癌患者的疗效及安全性。
1 材料与方法
1.1动物实验
1.1.1药物与试剂:实验用甲磺酸阿帕替尼由江苏恒瑞公司惠赠,用含0.5%羧甲基纤维素的生理盐水溶液溶解,配制成不同浓度的药物混悬液,用于灌胃治疗。CD34单克隆抗体从福州迈新生物技术公司购买,Ki-67单克隆抗体从上海杰浩生物公司购买。
1.1.2细胞株及实验动物:人肾透明细胞癌786-O细胞购自北京中源合聚生物科技公司。SPF级BALB/c雌性裸鼠24只,12~15 g,6~7周龄,购自北京维通利华实验动物技术有限公司[实验动物许可证编号:SCXK(京)2016-0006],由解放军联勤保障部队第九八〇医院实验动物中心饲养,动物房温度控制在20~24 ℃,湿度为40%~60%,每2日更换垫料和饲料,动物可自由摄入灭菌处理水和饲料。
1.1.3荷瘤鼠模型的建立:将人肾透明细胞癌786-O细胞吸取至含有10%胎牛血清、青链霉素混合液RPMI 1640培养液,置于37 ℃、5% CO2饱和湿度下的培养箱内培养,结合细胞生长状态,隔日更换培养液。取对数生长期786-O细胞,计数后调整细胞密度3×107个/ml,用1 ml注射器吸取0.2 ml细胞悬液,注射于每只裸鼠右侧背部皮下。
1.1.4肿瘤生长情况:自786-O细胞注射于裸鼠皮下开始每日观察接种部位,待肿瘤出现,测量肿瘤的长径和短径,计算肿瘤体积:V=1/2×长径×短径2。接种约5 d,待肿瘤生长至50~150 mm3,随机分为4组,每组6只。对照组(生理盐水组)及低(50 mg/kg)、中(100 mg/kg)、高(200 mg/kg)剂量甲磺酸阿帕替尼组,均给予灌胃治疗,疗程2周。灌胃期间,每日观察荷瘤鼠的一般状况及皮下移植瘤的生长状态,末次给药24 h后脱臼处死裸鼠,取出肿瘤组织称瘤质量,置于10%甲醛溶液供病理组织学检查。
1.1.5CD34和Ki-67在不同组别裸鼠移植瘤组织的阳性表达:利用免疫组织化学法检测血管内皮细胞标志物CD34和增殖指标Ki-67的表达情况。用10%甲醛溶液固定组织24 h,常规脱水包埋,3 μm连续切片。滴加鼠单克隆抗体CD34及Ki-67,室温下孵育,滴加羊抗鼠IgG过氧化物酶聚合物,室温下孵育,DAB显色、苏木紫复染、脱水、透明、封片,中性树胶和盖玻片封片。低倍镜下寻找移植瘤组织中阳性表达的最密集区,然后换高倍镜下计数,每张组织切片选择5个阳性表达最多的区域,并计算平均值。
1.2资料与方法
1.2.1临床资料:收集河北省多家医院2018年1月—2019年9月肾癌32例的临床资料。纳入标准:美国东部肿瘤协作组织(ECOG)评分≤2分;血常规、肝肾功能无明显异常;无严重心脏疾病。排除标准:合并凝血功能障碍;胃肠疾病;精神病史;妊娠和哺乳期妇女。32例中男27例,女5例;年龄(55.31±8.95)岁;透明细胞癌25例,非透明细胞癌7例;ECOG评分为0~1分者26例,2分者6例;既往手术治疗27例,未手术治疗5例;远处转移器官数目<3处12例,3处及以上转移者20例。
1.2.2治疗方法:患者均接受甲磺酸阿帕替尼治疗:对于肾原发病灶未切除、营养状况或体质较差的患者,适当降低起始剂量。其中23例起始剂量为250 mg/d,9例起始剂量为500 mg/d,餐后30 min口服,4周为1个周期,2个周期后评估疗效。
1.2.3疗效判定:据RECIST 1.1实体瘤疗效评价标准[4]分为完全缓解、部分缓解、疾病稳定、疾病进展。
1.2.4不良反应及随访:采用CTCAE 5.0版标准评价不良反应。随访截止日期为2019年11月。

2 结果
2.1不同剂量甲磺酸阿帕替尼对裸鼠移植瘤组织的抑制作用 治疗2周后,甲磺酸阿帕替尼中、高剂量组裸鼠移植瘤组织体积、质量均较对照组明显减小(P<0.05)。甲磺酸阿帕替尼低、中、高剂量组抑瘤率分别为32.98%、48.35%、54.95%。见表1。
2.2甲磺酸阿帕替尼治疗对肿瘤血管生成和增殖的影响 治疗2周后,甲磺酸阿帕替尼中、高剂量组移植瘤组织Ki-67、CD34蛋白表达低于对照组(P<0.05)。见表2。
2.3甲磺酸阿帕替尼对晚期肾癌患者的疗效和安全性 本组完全缓解0例,部分缓解9例,疾病稳定17例,疾病进展6例,疾病控制率81.2%,客观缓解率28.1%。常见的不良反应中,高血压6例,蛋白尿5例,手足综合征1例,血小板下降2例,转氨酶升高3例。3~4级不良反应中高血压5例、蛋白尿1例。
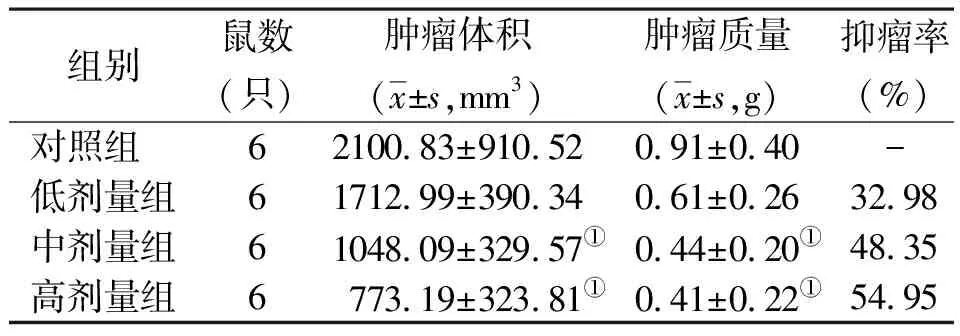
表1 4组荷瘤裸鼠移植瘤组织体积、质量及抑瘤率比较
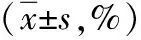
表2 4组荷瘤裸鼠移植瘤组织血管生成和细胞增殖相关蛋白表达情况
3 讨论
VEGFR-2与其配体VEGF-A是新血管生成的基础,血管生成也是恶性肿瘤侵袭转移的重要原因。甲磺酸阿帕替尼可以与VEGFR-2特异性结合并抑制VEGFR-2及VEGF介导的内皮细胞迁移和增殖,抑制肿瘤新生血管生成,从而减少肿瘤血供。本研究结果显示,甲磺酸阿帕替尼中、高剂量组抑瘤效果显著。有研究报道,甲磺酸阿帕替尼剂量依赖性地抑制了异种移植瘤模型的肿瘤生长[5]。有研究表明,相较于VEGFR-2低表达的肝癌移植瘤组织,甲磺酸阿帕替尼对VEGFR-2高表达的肝癌移植瘤组织的抑制作用更强[6]。此外,治疗期间甲磺酸阿帕替尼各剂量组裸鼠体质量未出现明显波动,也未出现治疗相关死亡,提示甲磺酸阿帕替尼治疗肿瘤有效且耐受性良好。
研究表明,Ki-67和CD34的高表达与肿瘤的恶性生物学行为息息相关[7]。本研究结果显示,甲磺酸阿帕替尼可降低肿瘤组织内CD34和Ki-67的阳性表达,且有剂量依赖性。本研究结果显示,32例肾癌治疗后疾病控制率为81.2%,客观缓解率为28.1%。有研究报道,对于既往接受过舒尼替尼治疗的患者,阿昔替尼客观缓解率高于索拉非尼[8]。本研究结果与文献报道相比,甲磺酸阿帕替尼较阿昔替尼优势明显。在METEOR试验中,卡博替尼客观缓解率高于依维莫司[9]。本结果与其相比,甲磺酸阿帕替尼优于卡博替尼,考虑与入选患者人种及既往用药相关。
本研究不良反应发生率为53.1%,其中3~4级不良反应主要为高血压和蛋白尿。在METEOR研究中,卡博替尼3级以上不良反应发生率远高于甲磺酸阿帕替尼,此外在卡博替尼治疗期间出现一例死亡事件。本研究不良反应大部分为1~2级且可以控制,3级以上不良反应可通过停药或减量缓解症状,说明甲磺酸阿帕替尼具有较高的安全性。
综上,甲磺酸阿帕替尼能有效抑制肾癌裸鼠移植瘤的生长,考虑与抑制肿瘤血管生成及增殖有关。同时临床研究结果呈现出有效的抗肿瘤活性和可控的不良反应,为转移性肾透明细胞癌的治疗提供依据。
