一种强效造血干细胞动员剂
——普乐沙福
2022-06-07杨华朱知梅
杨华 朱知梅
NHL 及MM 是常见的两种恶性血液病,治疗方案包括化疗、自体造血干细胞移植以及移植后维持治疗等[1]。近年来这两种疾病的发病率逐年增高,而自体造血干细胞移植能够延长患者的生存期。但这些患者在自体造血干细胞移植前,往往需要经历多周期的化疗,有的患者还需要放疗,从而造成造血干细胞受损,无法完成造血干细胞动员,导致采集失败。普通G-CSF动员不能成功后,化疗联合G-CSF 有可能动员成功,但是化疗后容易发生粒缺发热,导致感染,或者错过动员采集时机,而造成采集失败。据报道全球每年动员失败的患者达5000~10000 例,这些患者都失去了自体造血干细胞移植的机会[2]。文献报道,在MM 患者中动员出造血干细胞 < 4.0×106个/kg 自体造血干细胞移植后总生存(OS)及无进展生存(PFS)明显缩短[3]。因此临床上迫切需要一种强而有效且安全性高的造血干细胞动员剂,以确保动员出足够数量的CD34+造血干细胞,保证自体造血干细胞移植顺利进行。普乐沙福是一种小分子趋化因子受体CXCR4 阻断剂,中文化学名称为1,1'-[1,4-亚苯基双(亚甲基)]-双-1,4,8,11-四氮环十四烷[4],分子式:C28H54N8。化学结构式:见图1。2008 年在欧盟获准上市,2009 年由美国食品药品监督管理局(FDA)批准上市,2018 年12 月在中国上市,用于NHL 和MM 动员失败患者的造血干细胞动员。
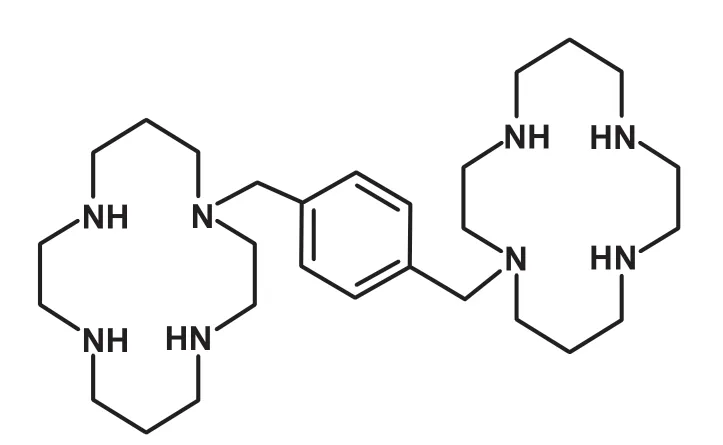
图1 普乐沙福的结构式
1 作用机制
普乐沙福是一种小分子趋化因子受体CXCR4阻断剂,并阻断其同源配体基质细胞衍生因子-1α(SDF-1α)的结合[1-5]。SDF-1α 和CXCR4 被认为在人造血干细胞(HSCs)的移植和归巢到骨髓腔中起作用。一旦进入骨髓,造血干细胞通过CXCR4 分子可以锚定这些细胞到骨髓基质,直接通过SDF-1α 或诱导其他粘附分子,将造血干细胞定植在骨髓龛中。普乐沙福阻断CXCR4 与SDF-1α 结合后,驱动CD34+细胞向外周血中释放,造成循环中含有造血祖细胞的白细胞增多和升高。多项早期研究显示可快速有效地增加NHL 和MM 患者血液循环中的造血干细胞数。普乐沙福动员的CD34+细胞具有很强的植入能力和再生能力[5]。
2 药效学
2000 年,普乐沙福作为用于艾滋病(AIDS)治疗的候选抗人类免疫缺陷病毒(HIV)药物进行Ⅰ期临床试验。研究发现,与给药前相比较,受试者白细胞比给药前提升1.5~3.1 倍,峰值出现在给药后6 h,24 h 后恢复基线值,提示普乐沙福可能有干细胞动员作用[6]。
一项Ⅰ期、单中心、随机开放临床试验,入组31 例健康志愿者,其中10 例随机给予G-CSF 10 μg/(kg·d),连用5 d;普乐沙福0.24 mg/kg,使用1 d。或给予G-CSF 10 μg/(kg·d),连用4 d,第5 天加用普乐沙福0.16 mg/kg,记录其外周血CD34+细胞数。普乐沙福联合G-CSF 使受试者外周血中CD34+造血干细胞数增加3.8 倍,明显高于单独应用普乐沙福及G-CSF 组[7]。
加拿大一项多中心、开放、单组的Ⅱ期临床研究,共入组NHL 和MM 成年患者22 例,连续4 d 晨间给予G-CSF 10 μg/(kg·d),普乐沙福晚间给予0.24 mg/kg,旨在获得普乐沙福的药物代谢动力学(PK)、药物效应动力学(PD)以及其在MM或NHL患者中的疗效及安全性。MM 或NHL 患者首次接受0.24 mg/kg 后10~11 h,外周血CD34+细胞平均增加2.9 倍,其中NHL 患者中增加2.7 倍,MM 患者中增加3.1 倍[8]。
以色列一项单中心、开放的ⅡB 期临床研究,共入组标准干细胞动员困难的患者20 例,每日早晨给予G-CSF 10 μg/kg,连续4 d,随后加用普乐沙福0.24 mg/kg,皮下注射,主要终点事件为动员成功率,旨在评估普乐沙福在存在动员困难的NHL 患者中的作用。16 例患者 (80%)单次注射普乐沙福达到最低采集CD34+细胞数2×106个/kg,14 例患者采 集(70%)≥5×106个/kg,18 例患者(90%)两次注射后达到采集2×106个/kg,仅2 例患者3 次注射后仍无法达到最低细胞数[9]。
一项Ⅲ期普乐沙福联合G-CSF 动员NHL 患者,不良反应可耐受,普乐沙福联合G-CSF 使90%的NHL 患者通过更少的天数达到目标CD34+细胞的采集,高于G-CSF 单药动员的55.4%,差异有统计学意义(P<0.001)[10]。
3 药代动力学
在NHL 和MM 患者中预先给予G-CSF (10 μg/kg,1 次/d,连续4 d) 后评估普乐沙福0.24 mg/kg 单次给药的药代动力学。在0.04~0.24 mg/kg 剂量范围内普乐沙福表现为线性药代动力学。在接受普乐沙福单药给药的健康受试者和接受普乐沙福与G-CSF 联用的NHL与 MM 患者的临床研究中普乐沙福的药代动力学相似。根据有限的数据,高于推荐剂量0.24 mg/kg 皮下注射时,胃肠道疾病、血管迷走神经反应、直立性低血压或晕厥的发生率可能增高[8]。
整合接受普乐沙福单次皮下注射给药(0.04~0.24 mg/kg)的受试者(NHL 患者、MM 患者以及不同程度肾功能不全的受试者和健康受试者)的普乐沙福数据,进行群体药代动力学分析。包括一级吸收和消除的二室处置模型,可充分描述普乐沙福的浓度-时间曲线。清除率和肌酐清除率(CLcr)之间以及中央室分布容积和体重之间可见显著相关性。在肾功能正常患者中分布半衰期(t1/2α)估算为0.3 h,终末群体半衰期(t1/2β)为5.3 h。群体药代动力学分析可见,基于mg/kg 的剂量导致普乐沙福暴露(AUC0~24h)随体重增加而增加。为了比较0.24 mg/kg 基础给药和固定剂量(20 mg)给药后普乐沙福的药代动力学和药效学,对接受0.24 mg/kg或20 mg 普乐沙福给药的NHL 患者(n=61)进行随访试验。在体重70 kg 或以下的患者中开展试验。固定剂量20 mg 的暴露(AUC0~24hh)是0.24 mg/kg 给药暴露的1.43 倍。在达到目标≥5×106个/kg CD34+方面,固定剂量20 mg 给药的反应率数值上高于以0.24 mg/kg 给药的患者(根据当地实验室数据5.2% [60.0% VS 54.8%],根据中心实验室数据11.7% [63.3% VS 51.6%])。但是,两个给药组达到 ≥ 5×106个/kg CD34+的中位时间均为3 d,两组间安全性特征相似。根据这些结果,FDA审核人员进行进一步分析,选择83 kg 体重作为适用分界点,将患者固定剂量给药转为基于体重给药。83 kg以下应用20 mg,83 kg 以上应用0.24 mg/kg[11,12]。在肾功能不全患者中:0.24 mg/kg 普乐沙福单次皮下注射给药后,在不同程度肾功能不全的受试者中清除率降低,并与CLcr 呈正相关。轻度(CLcr 51~80 ml/min)、中度 (CLcr 31~50 ml/min)和重度(CLcr<30 ml/min)肾功能不全的受试者中平均AUC0~24h值分别比肾功能正常的健康受试者的暴露数值高7%、32%和39%。肾功能不全对Cmax 没有影响。群体药代动力学分析表明,与CLcr >50 ml/min 的患者相比,中度和重度肾功能不全患者中药物暴露(AUC0~24h)增加。这些结果支持中度到重度肾功能不全(CLcr<50 ml/min)患者中剂量降低1/3,以达到肾功能正常患者的匹配药物暴露。群体药代动力学分析发现,基于mg/kg 剂量给药导致普乐沙福暴露(AUC0~24h)随体重增加而增加。因此,如果CLcr<50 ml/min,剂量不得超过27 mg/d[12]。
4 药物相互作用
普乐沙福皮下注射后30~60 min 达到血浆峰浓度。普乐沙福与人血浆蛋白中度结合,结合率可达58%。普乐沙福在人体内的表观分布容积为0.3 L/kg,表明普乐沙福主要在血管外分布。使用体外试验分析普乐沙福代谢。使用人肝微粒体或人原代肝细胞未见普乐沙福的体外代谢,且普乐沙福对主要药物代谢CYP450(1A2、2A6、2B6、2C8、2C9、2C19、2D6、2E1 和3A4/5)无体外抑制活性。在使用人肝细胞的体外研究中,普乐沙福对CYP1A2、CYP2B6 和CYP3A4酶无诱导作用。这些研究结果表明普乐沙福与P450相关的药物发生药物相互作用的可能性低。普乐沙福主要通过尿液消除。对肾功能正常的健康志愿者给予0.24 mg/kg 普乐沙福后,在给药后的前24 h 内,约70%的剂量在尿液中以原型排泄。在健康受试者和患者中,普乐沙福血浆消除半衰期(t1/2)为3~5 h。在临床相似浓度下,在MDCKⅡ和MDCKILMDR1 细胞模型的体外研究中,普乐沙福不是细胞色素P450 同工酶的底物、抑制剂或诱导剂。普乐沙福不可能发生涉及细胞色素P450 的体内药物-药物相互作用。在临床相似浓度下,在体外研究中普乐沙福不是P-糖蛋白的底物或抑制剂[13-16]。
5 临床评价
在NHL 及MM 患者中完成了一项全球Ⅲ期临床研究(3101及3102)和一项中国Ⅲ期临床研究(EFC12482)。3101 研究是在一线或二线治疗后出现CR 或PR 的NHL 患者中进行的随机、双盲、安慰剂对照Ⅲ期研究,评估普乐沙福与G-CSF 联用治疗NHL 的有效性和安全性。在采集前,每天晚上随机给予患者本品0.24 mg/kg或安慰剂。在首次给予本品或安慰剂前连续4 d 和釆集前每天上午给予患者G-CSF 10 μg/kg。主要疗效分析中包括298 例NHL 患者。本品和安慰剂组平均年龄分别为55岁(范围为29~75岁)和58岁(范围为22~75岁),93%受试者为白种人。在3101 研究中,经普乐沙福和G-CSF 动员的NHL 患者中在4 d 或更短时间内从外周血釆集到CD34+细胞>5×106个/kg 的患者比例为59.3%;86.7%患者釆集到CD34+细胞 >2×106个/kg。经安慰剂和G-CSF 动员的NHL 患者中百分比仅为19.6%。在4 d 或更短时间内采集到CD34+细胞>5×106个/kg 且移植后实现中性粒细胞和血小板成功植入的患者比例,普乐沙福高于安慰剂组,差异有统计学意义(P<0.001)。其他CD34+细胞动员结果两组相似[17]。3102 研究是在MM 患者中进行的多中心、随机、双盲、安慰剂对照Ⅲ期研究,评估普乐沙福与G-CSF 联用治疗MM 的有效性和安全性。在采集前,每天晚上随机给予患者本品0.24 mg/kg 或安慰剂。在首次给予本品或安慰剂前连续4 d 和釆集前每天上午给予患者G-CSF 10 μg/kg,主要疗效分析中包括302 例MM 患者。本品和安慰剂组平均年龄(58 岁)和年龄范围(28~75 岁)相似,81%受试者为白种人。普乐沙福组中达到CD34+>6×106个/kg 的天数中位值为1 d,安慰剂组为4 d。达到CD34+细胞 >6×106个/kg 的患者比例86.8%,而安慰剂组仅为55.9%。
6 安全性
在中国NHL 患者中开展的Ⅲ期临床研究(EFC12482)中,有51 名患者实际暴露于普乐沙福和G-CSF治疗,另49名患者接受了安慰剂和G-CSF治疗。其中列出了在从第4 天G-CSF 动员到最后一次HSCs采集后24 h 内,普乐沙福组发生率高于对照组,并认为与本品相关的不良反应包括:失眠(2.0%)、头晕(2.0%)、头痛(2.0%)、恶心(7.8%)、呕吐(2.0%)、腹胀(2.0%)和腹泻(3.9%)。除临床试验中报告的不良反应外,在本品上市后报告了如下不良反应:①血液及淋巴系统疾病:脾肿大和脾破裂;②免疫系统疾病:过敏反应,包括过敏性休克;③精神病类异常:做梦和噩梦。
7 小结
自体造血干细胞移植治疗NHL 及MM 应用越来越广泛,造血干细胞成功采集是移植的关键。普乐沙福为患者成功动员造血干细胞带来希望,使患者成功走向自体造血干细胞移植并延长患者生存。普乐沙福不良反应轻微,而且可以耐受,动员效果明显,具有较好的应用前景。
