高灵敏液相色谱—质谱联用方法用于HIV-1感染细胞中胞苷修饰全分析*
2022-06-07郑瑞丽周欧路褚洁梅安三奇蒋俊俊
郑瑞丽,周欧路,褚洁梅△,安三奇,蒋俊俊,叶 力,梁 浩△
(1.广西医科大学生命科学研究院 广西医科大学再生医学与医用生物资源开发应用省部共建协同创新中心,南宁 530021;2.广西医科大学公共卫生医学院 广西艾滋病防治研究重点实验室,南宁 530021;3.玉林市第一人民医院,玉林 537000)
DNA甲基化为真核生物中普遍的修饰方式,包括5-甲基胞苷(5-mdC)以及通过TET家族蛋白逐步催化氧化形成5-羟甲基胞苷(5-hmdC)、5-醛基胞苷(5-fdC)和5-羧基胞苷(5-cadC)[2-4]。5-fdC和5-cadC会被DNA 胸腺嘧啶糖苷酶识别并割断糖苷键去除碱基形成AP 位点,再通过碱基切除修复途径将正常未修饰的胞嘧啶填补到AP 位点,实现主动去甲基化的过程。DNA 甲基化和去甲基化的动态平衡与癌症、急性淋巴细胞白血病和阿尔兹海默症等多种疾病的发生、发展密切相关[5-6]。然而目前关于DNA甲基化与HIV的研究鲜有报道。
液相色谱—质谱联用(LC-MS)被广泛用于化合物的定性和定量[7],是检测修饰核苷的主流方法[8]。然而由于5-fdC和5-cadC修饰含量极低,现有方法并不能直接在HIV-1 感染细胞内同时检测到4 种胞苷修饰,需通过一些前处理方法来提高LCMS 检测灵敏度[9]。本研究旨在建立一种同时检测胞苷修饰的化学标记结合LC-MS 的高灵敏分析方法,在LC-MS分析前采用2-溴-1-4-二乙氨基苯基乙酮(BDEPE)标记4 种胞苷修饰(5-mdC、5-hmdC、5-fdC和5-cadC),并用此方法分析HIV-1感染前、后的细胞DNA中4种胞苷修饰,为进一步研究胞苷修饰在艾滋病中的作用打下基础。
1 材料与方法
1.1 细胞、病毒和试剂
人类T 淋巴细胞系MT2 细胞由美国马萨诸塞大学医学院卢山教授惠赠。HIV-1 ⅢB由中国人民解放军军事医学科学院提供。BDEPE 购自阿法埃莎(中国)化学有限公司;S1 核酸酶和牛小肠碱性磷酸酶购自Takara 生物技术公司;核酸外切酶I 购自美国Sigma 公司;1640 培养基和胎牛血清购自美国Gibco 公司;质谱级甲醇、质谱级乙腈(ACN)、三乙胺(TEA)、脱氧胸苷(dT)、5-mdC、5-hmdC均购自上海麦克林生化科技有限公司;甲酸(FA)购自赛默飞世尔科技有限公司(中国);氯仿购自天津市富宇精细化工有限公司;脱氧胞苷(dC)、脱氧鸟苷(dG)、脱氧腺苷(dA)均购自梯希爱化成工业发展有限公司(上海);5-fdC、5-cadC购自Berry&Associates。
1.2 分析方法的建立
提取待测样本的基因组DNA 酶解为单个核苷混合物,标记试剂BDEPE 与5-mdC、5-hmdC、5-fdC和5-cadC发生特异性反应,最后使用LC-MS系统对标记产物进行分析,见图1。

图1 化学标记结合LC-MS检测DNA中4种胞苷修饰的分析方法流程图
1.2.1 溶液配制 核苷标准品分别用蒸馏水制备为1 mg/mL 的母液,化学标记试剂BDEPE 用ACN配备为1 mg/mL 的母液,TEA 原液用ACN 稀释100倍(浓度为80 nmol/μL),均置于4 ℃冰箱中备用。
1.2.2 化学标记条件优化 设置一系列不同的BDEPE浓度、催化剂TEA用量、反应温度和反应时间。优化化学标记的反应条件,所有反应的总体系为200 μL,5-mdC标准核苷作为代表,标记后产物使用LC-MS检测分析。
1.2.3 标准曲线样本制备和处理 不同浓度的核苷标准品分别进行BDEPE标记,反应体系包括核苷标准品、2 mmol/L BDEPE、4 mmol/L TEA 和82 μL ACN,在60 ℃条件下孵育6 h,反应终止后用氮气吹干,加入2 μL ACN和38 μL蒸馏水复溶后用LC-MS进行分析。绘制标准曲线,取3次测定的平均值。
1.2.4 DNA 样本制备和处理 使用TRIzol 试剂提取细胞DNA,将DNA 酶解成核苷,向DNA 样本中加入1 μL 的10×S1 核酸酶缓冲液,95 ℃水浴5 min后,迅速放到冰上2 min,再加入0.5 μL S1 核酸酶,37 ℃水浴2 h;然后加入4 μL 10×碱性磷酸酶缓冲溶液,1 μL 蛇毒磷酸二酯酶I,0.3 μL 碱性磷酸酶及24.7 μL 蒸馏水,37 ℃水浴2 h。然后氯仿抽提得到核苷。用氮气吹干后采用已优化的条件进行标记反应并上机检测。
在课堂上构建和谐的师生关系一直以来都是课堂改革的重要方向之一。而和谐的师生关系必须是建立在平等、沟通和交流的基础之上的。而传统课堂上,师生之间的地位是不平等的,教师的地位被提到了学生难以企及的高度之上,师道尊严的课堂教学让学生更多的是惧怕。地位差距的悬殊令学生难以主动地和教师展开有效的交流和沟通,从而影响到课堂上和谐的师生关系的形成。而生活化的课堂教学中,学生的主体地位得到了应有的尊重,这对于和谐的课堂氛围的形成大有裨益。在良好的课堂氛围中,对于师生之间和谐的关系的形成具有促进作用。
1.2.5 LC-MS 分析 采用美国Waters 公司液质联用系统,色谱柱为Waters C18 column(150 mm×2.1 mm,5 μm,Waters,USA),柱温箱温度40 ℃,流速0.2 mL/min,流动相A 为甲酸水,流动相B 为ACN,流动相梯度为:0~3 min,95%A;3~10 min:95%~15% A;10~11 min,15% A;10~11 min,15%~95%A;12~17 min,95%A。定性分析采用高分辨液质联用仪(Waters G2-XS qTOF),正离子全扫模式下监测质量范围为100~800 m/z。定量分析采用低分辨液质联用仪(Waters G2-XS QqQ),正离子多反应监测模式,监测离子对分别为:5-mdC-BDEPE(413.2183→297.1710)、5-hmdC-BDEPE(429.2132→313.1659)、5-fdC-BDEPE(427.1976→311.1659)、5-cadC-BDEPE(632.3079 →516.2605)、A(268.2 →136.1)、U(245.1→113.1)、C(244.1→112.1)、G(284.1→152.1)。MassLynx V4.1 软件执行数据采集和分析。
1.3 方法应用
利用所建立的化学标记结合LC-MS 方法对MT2 细胞DNA 中的胞苷修饰水平进行定性、定量检测。MT2 细胞与HIV-1 ⅢB 病毒(105TCID50)共培养3 d 后收集样本,按照DNA 样本制备和处理方法进行处理,BDEPE标记后用LC-MS系统分析。
1.4 统计学方法
采用Origin 2021 软件和Chembiodraw 18.0 软件作图,SPSS 13.0 和Graphpad Prism 8.0 进行统计分析。用Studentt检验进行组间比较,以P<0.05为差异具有统计学意义。
2 结果
2.1 标记反应条件的优化
BDEPE浓度1~2 mmol/L、TEA浓度2~6 mmol/L、反应温度60 ℃、反应时间6 h时,标记产物(5-mdC-BDEPE)的峰面积最大,见图2。因此,最佳反应条件为2 mmol/L BDEPE 和4 mmol/L TEA 在60 ℃条件下反应6 h。

图2 标记反应条件优化
2.2 液相条件优化
本研究分析流动相A 中加入两种不同浓度的酸对目标物质谱响应和色谱分离的影响,分别为0.05%、0.1%甲酸水溶液和0.05%、0.1%乙酸水溶液,流动相B选用ACN。在水相中加入0.1%的甲酸检测响应最高,效果最好,见图3。因此,LC-MS 分析采用0.1%的甲酸水溶液作为流动相A。

图3 胞苷修饰标记产物流动相A优化色谱图
2.3 方法评价
2.3.1 标记转化率和标记产物稳定性 通过对比衍生化试剂BDEPE与5-mdC、5-hmdC和5-fdC反应前、后反应底物的含量来计算衍生化反应的转化率,5-mdC、5-hmdC、5-fdC、5-cadC 修饰的转化率分别为99.8%、100%、93.7%、91.2%,均高于90%。标记产物在反应后48 h内稳定,见图4。
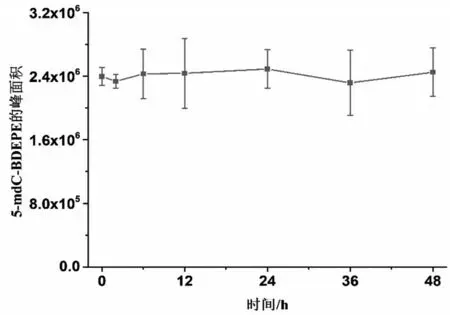
图4 5-mdC标记产物稳定性分析
2.3.2 细胞样品中目标物定性分析 细胞样品中的目标分析物通过与理论值的精确分子量和标准品的保留时间对比来进行定性分析。经过BDEPE标记后的细胞内5-mdC、5-hmdC、5-fdC和5-cadC的精确分子量与理论值的误差在可接受范围内,见表1。细胞样品中4种标记后目标分析物与标准品标记产物的保留时间一致,见图5。由此可以确定在细胞样品中检测到了4种胞苷修饰。

图5 细胞样品与标准品的保留时间对比

表1 目标分析物理论分子量与标准品和细胞样品的实测分子量
2.3.3 方法灵敏度 使用LC-MS 方法直接检测时(即标记前)仅能检测到HIV-1 感染细胞DNA 中含量较高的5-mdC 和5-hmdC,检测不到痕量5-fdC 和5-cadC。在经过BDEPE 标记后,出峰时间明显延长,有助于色谱分离,且质谱响应提高,成功在HIV-1感染细胞DNA中同时检测到5-mdC、5-hmdC、5-fdC和5-cadC,见图6。

图6 细胞样品目标分析物标记前、后对比
5-mdC、5-hmdC、5-fodC 和5-cadC 标记前最低检测限(LODs)分别为5.20 fmol、2.81 fmol、9.43 fmol 和13.82 fmol,标记后LODs 降低,分别为0.09 fmol、0.08 fmol、0.18 fmol 和0.15 fmol,化学标记结合LC-MS与直接检测相比,检测5-mdC、5-hmdC、5-fodC和5-cadC的灵敏度分别提高了58倍、35倍、52倍和92倍。
2.3.4 目标物定量标准曲线 对7个不同浓度的标准品进行检测(1 次/d,连续3 d),计算得到标准曲线。在标准曲线范围内,5-mdC、5-hmdC、5-fdC 和5-cadC 均具有良好的线性,相关系数(R2)均大于0.99,见表2,平行重复的相对标准偏差(RSD)低于20%。
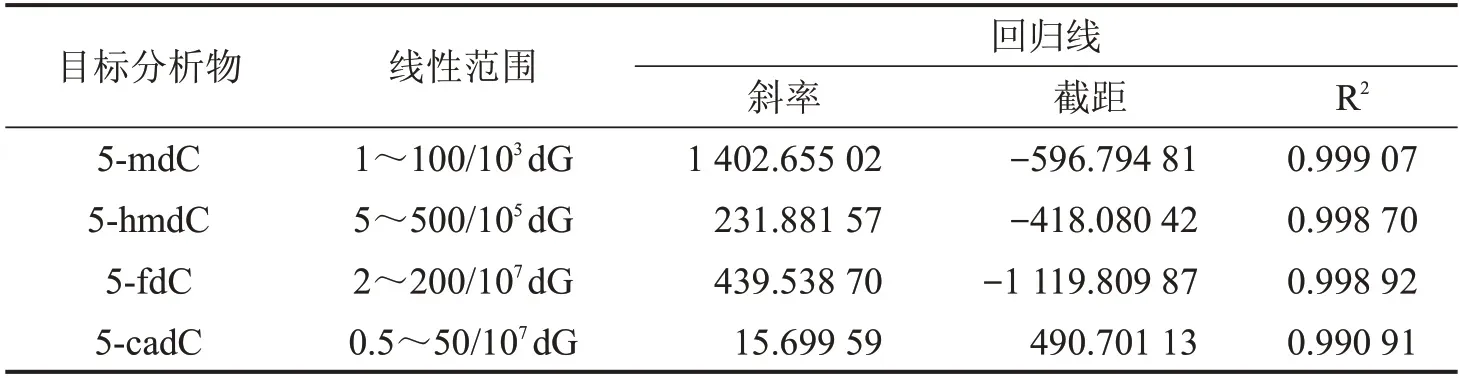
表2 目标分析物的标准曲线
2.4 方法应用
使用所建立的化学标记结合LC-MS 检测方法对HIV-1 感染人类T 淋巴细胞系MT2 细胞DNA 中5-mdC、5-hmdC、5-fdC 和5-cadC 修饰进行分析。5-mdC、5-hmdC、5-fdC、5-cadC在未感染HIV-1病毒细胞(对照组)中的含量分别为(3.42±0.26)/102dG、(10.03±2.94)/105dG、(3.21±0.18)/107dG、(0.56±0.005)/107dG,在HIV-1 感染组中的含量分别为(7.76±1.31)/102dG、(15.24±3.37)/105dG、(8.09±0.36)/107dG、(2.2±0.007)/107dG,HIV-1 感染组15-mdC、5-fdC和5-cadC含量高于对照组(P<0.05)。
3 讨论
本研究通过使用化学标记与LC-MS方法结合,进一步提高对目标分析物的检测灵敏度。选择BDEPE作为化学标记试剂,其含有溴乙酮基与胞苷修饰反应,同时包含苯环和二甲叔胺基团,有助于提高标记产物的色谱分离和质谱离子化,将目标分析物的检测灵敏度提高了35~92 倍。标记后产物使用LC-MS方法检测,实现了在HIV-1病毒感染细胞中5-mdC、5-hmdC、5-fdC 和5-cadC 这4 种胞苷修饰的全分析。这4 种修饰共同参与维持DNA 胞嘧啶甲基化修饰的动态平衡,在多种生理过程中具有调控作用[10-12],检测这些修饰的水平是研究其生物学影响的第一步,尤其是对痕量修饰(5-fdC 和5-cadC)的准确定量。在本研究中,标记试剂BDEPE显著改善了目标分析物的液相色谱分离,并提高了这几种痕量修饰的检测灵敏度,特异性也由于BDEPE的加入而得到提高,使得在HIV-1感染细胞中DNA 上的4 种胞苷修饰能准确定性、定量分析。该方法灵敏度高、特异性强,并且可以推广用于其他样本中胞苷修饰的全分析。
本课题组通过使用该方法,首次成功对HIV-1感染的人类T 淋巴细胞系MT2 细胞的基因组DNA中4 种胞苷5-mdC、5-hmdC、5-fdC 和5-cadC 含量进行同时检测,结果显示,与未感染HIV-1病毒细胞相比,感染HIV-1 病毒的细胞5-mdC、5-fdC 和5-cadC含量升高。5-mdC、5-fdC和5-cadC在HIV-1感染机体后异常增高说明这3种胞苷修饰可能在HIV感染中发挥一定的作用,值得更进一步深入研究。同时,胞苷修饰增多可能是HIV-1 感染机体后的一般特征,或可作为HIV-1感染的潜在生物标志物。
本研究开发了一种灵敏度高、特异性强的化学标记结合LC-MS 同时测定DNA 中4 种胞苷修饰的检测方法。应用该方法检测HIV-1 感染细胞前、后这4 种胞苷修饰的含量变化,发现5-mdC、5-fdC 和5-cadC 在HIV-1 感染后显著升高,这为将来进一步探索胞苷甲基化与HIV-1感染之间的关系打下研究基础,对分析胞苷修饰在HIV感染中的作用具有重要意义。
