LncRNA SNHG1对软骨细胞损伤的保护作用及调节机制
2022-06-06彭源祥黄加裕陈钦灿万文兵
刘 浪,蔡 风,彭源祥,余 波,黎 腾,黄加裕,陈钦灿,万文兵,廖 琦
(南昌市第一医院骨科,南昌 330008)
骨关节炎(OA)是全世界中老年人最常见的关节疾病,其特征是局部炎症、关节软骨损伤和软骨退化[1]。软骨细胞是关节软骨组织中唯一的细胞,分布在软骨基质中,在维持关节软骨的结构和功能完整性方面发挥着重要作用[2],是OA发病的主要促成因素之一[3],调节软骨细胞增殖、凋亡、分化等生理功能是防治OA的关键[4]。当前OA的治疗策略主要是控制症状,缺乏有效的治疗手段[5]。因此,有必要开发新的有效治疗方法来预防OA的发生。长链非编码RNA(lncRNAs)是一类长度超过200个核苷酸的非编码RNA分子,不仅与肿瘤的生长、耐药和转移有关,而且还参与细胞增殖、分化、凋亡和炎症反应[6-9]。目前,随着对OA发病机制研究的深入,lncRNAs对OA发生发展的调控作用不断被发现[10-11]。小核仁RNA宿主基因1(SNHG1)是一种新型lncRNA,位于染色体11q12.3。越来越多的证据[12-13]表明,SNHG1的功能障碍与骨肉瘤、结直肠癌、肝癌等人类疾病的发生发展有关。此外,近期研究[14]还发现lncRNA SNHG1可能参与了OA的发生发展。然而,SNHG1在OA发展过程中的生物学作用需进一步研究,基于此,本研究旨在探讨SNHG1在OA发展过程中对软骨细胞的保护作用及其潜在机制,为OA治疗提供理论基础与新的视角。
1 材料与方法
1.1 软骨样本
人软骨标本来源于南昌市第一医院2019年12月31日至2020年12月31日收治的12例膝骨关节炎行关节置换患者(年龄57~71岁,平均64.5岁),按照软骨损伤Outerbridge分级对切取的软骨标本进行分级,其中Ⅰ级定义为相对正常软骨组织,Ⅲ级为骨关节炎软骨组织。
1.2 软骨细胞培养
软骨细胞系ATDC5来自吉妮欧生物科技公司,细胞在含10% FBS(Gibco)的DMEM(Gibco)中重悬,并置于无菌湿润的培养箱中培养(37 ℃和5%CO2)。
1.3 构建OA软骨细胞模型
使用10 ng·mL-1IL-1β(上海生工生物工程有限公司)诱导ATDC5软骨细胞24 h,建立OA软骨细胞模型。
1.4 qRT-PCR检测
使用Trizol试剂(美国Invitrogen公司)从OA软骨组织或软骨细胞中提取总RNA。将提取的总RNA逆转录为cDNA。接下来,使用SYBR Green PCR Kit(日本Takara公司)对引物片段进行实时PCR扩增。GAPDH作为mRNA和lncRNA的内参,U6作为miRNA的内参。各基因的相对表达量采用2-△△Ct法计算。
SNHG1正向(F):5′-CCGCTCGAGCTCATT-TTTCCTTGTTCG-3′,反向(R):5′-CGCGGATC-CGCAAAGAATTATTTCATC-3′;miR-186-5p(F):5′-AAGAATTCTCCTTTTGGGCT-3′,(R):5′-GT-GCGTGTCGTGGAGTCG-3′;Runx2(F):5′-AACGATCTGAGATTTGTGGGC-3′,(R):5′-CCTGC-GTGGGATTTCTTGGTT-3′;PCNA(F):5′-AACCAGGAGAAAGTTTCAG-3′,(R):5′-GCACAGGAAATTACAACAG-3′。
1.5 细胞转染
使用Lipofectamine 2000试剂(美国Life Technologies公司)进行转染(详细步骤参考Lipofectamine 2000 reagent说明书)将寡核苷酸或重组质粒转染到OA软骨细胞模型中。SNHG1质粒、miR-186-5p模拟物、si-SNHG1及其相应的阴性对照(苏州Genepharma公司)。
1.6 MTT法检测
采用MTT法检测OA软骨细胞的增殖活性,具体步骤严格按照试剂盒说明书进行。将转染的软骨细胞接种在96孔培养板中,培养结束时,按培养基1/5体积加入MTT工作液继续孵4 h,离心机离心后弃上清。加入DMSO 100 μL·孔-1,待结晶完全溶解,用酶标仪测定450 nm处的吸光度值。
1.7 细胞凋亡率检测
使用膜联蛋白V-FITC凋亡检测试剂盒(美国Invitrogen公司)检测细胞凋亡率。软骨细胞被胰蛋白酶消化并重新悬浮在培养基中,在避光暗盒中使用V-FITC和PI染色后通过流式细胞仪测量细胞凋亡的百分比。
1.8 双荧光素酶报告基因检测
使用Lipofectamine 2000试剂将miR-186-5p模拟物或miR-NC转入含有突变型SNHG1(SNHG1- MUT)或野生型SNHG1(SNHG1-WT)质粒载体的OA软骨细胞模型中。转染48 h后,使用试剂盒(美国Promega公司)测定软骨细胞中的荧光素酶活性。
1.9 蛋白质免疫印迹法
使用RIPA(万特生物工程有限公司)裂解液和提取细胞中的总蛋白质,并使用BCA(万特生物)蛋白质浓缩试剂盒进行定量。定量总蛋白通过10% SDS-PAGE凝胶分离并转移到PVDF膜上,然后,用5%的脱脂牛奶封闭膜2 h,接着分别用抗PCDA、抗Runx2一抗(美国Proteintech Group公司)将膜在4 ℃下孵育过夜,然后用二抗(美国Proteintech Group公司)在室温下孵育1 h。使用增强化学发光(ECL)试剂(上海碧云天生物技术有限公司)对蛋白质条带进行着色,并以GAPDH作为蛋白质的内参。
1.10 统计学方法
2 结果
2.1 SNHG1在OA软骨组织与细胞中的表达
与正常软骨组织相比,SNHG1在OA软骨组织中的表达水平明显降低(P<0.01);同时,与正常软骨细胞相比,SNHG1在OA软骨细胞中的表达水平显著下调(P<0.01)。此外,将si-SNHG1或SNHG1转染OA软骨细胞后,SNHG1过表达质粒转染明显上调SNHG1表达(P<0.01),而si-SNHG1转染明显下调SNHG1表达(P<0.01)。见图1。
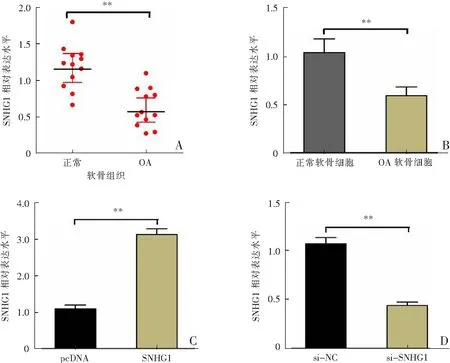
A:SNHG1在OA软骨组织与正常软骨组织中的表达;B:SNHG1在OA软骨细胞与正常软骨细胞中的表达;C:SNHG1过表达质粒转染OA软骨细胞后SNHG1的表达;D:si-SNHG1转染OA软骨细胞后SNHG1的表达;**P<0.01。
2.2 SNHG1对OA软骨细胞增殖、凋亡、分化的影响
si-SNHG1转染后OA软骨细胞凋亡率显著增加(P<0.01),增殖活力显著降低(P<0.05),分化相关分子Runx2(runt相关转录因子2)mRNA蛋白表达水平显著升高(P<0.01),增殖相关分子PCNA(增殖细胞核抗原)表达水平显著降低(P<0.01);而SNHG1过表达质粒转染后OA软骨细胞凋亡率显著降低(P<0.05),增殖活力显著升高(P<0.01),Runx2 mRNA蛋白表达水平显著降低(P<0.01),PCNA表达水平显著增加(P<0.01),见图2。结果表明,过表达的SNHG1可以增强OA软骨细胞活力,抑制OA软骨细胞凋亡及分化,对OA软骨细胞发挥保护作用。
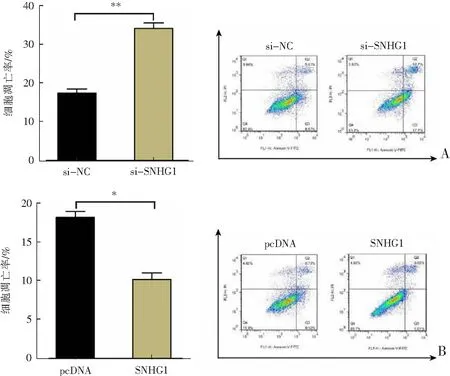
A、B:流式细胞术检测过表达SNHG1质粒、si-SNHG1转染后OA软骨细胞凋亡率;C、D:MTT法检测过表达SNHG1质粒、si-SNHG1转染后OA软骨细胞增殖活力;E—H:蛋白质免疫印迹法检测过表达SNHG1质粒、si-SNHG1转染后OA软骨细胞中PCNA和Runx2 mRNA的表达;*P<0.05,**P<0.01。
2.3 miR-186-5p作为lncRNA-SNHG1的靶基因鉴定
本研究利用Starbase预测SNHG1在miR-186-5p中可能存在靶向结合位点(图3A)。将SNHG1-MUT(突变型)或SNHG1-WT(野生型)载体与miR-186-5p mimics(模拟物)或miR-NC共转染到OA软骨细胞中,以确定SNHG1和miR-186-5p间的相互作用,结果显示,在与miR-186-5p模拟物共转染后,SNHG1-WT组细胞的荧光素酶活性显着低于SNHG1-MUT组(P<0.01,图3B)。此外,qRT-PCR检测结果显示,过表达SNHG1转染显著降低miR-186-5p的表达(P<0.05),而si-SNHG1转染显著增加miR-186-5p的表达(P<0.01,图3C);且miR-186-5p与OA软骨组织中SNHG1基因表达呈显著负相关(图3D)。以上结果证实miR-186-5p是SNHG1在OA软骨细胞中的直接靶基因。
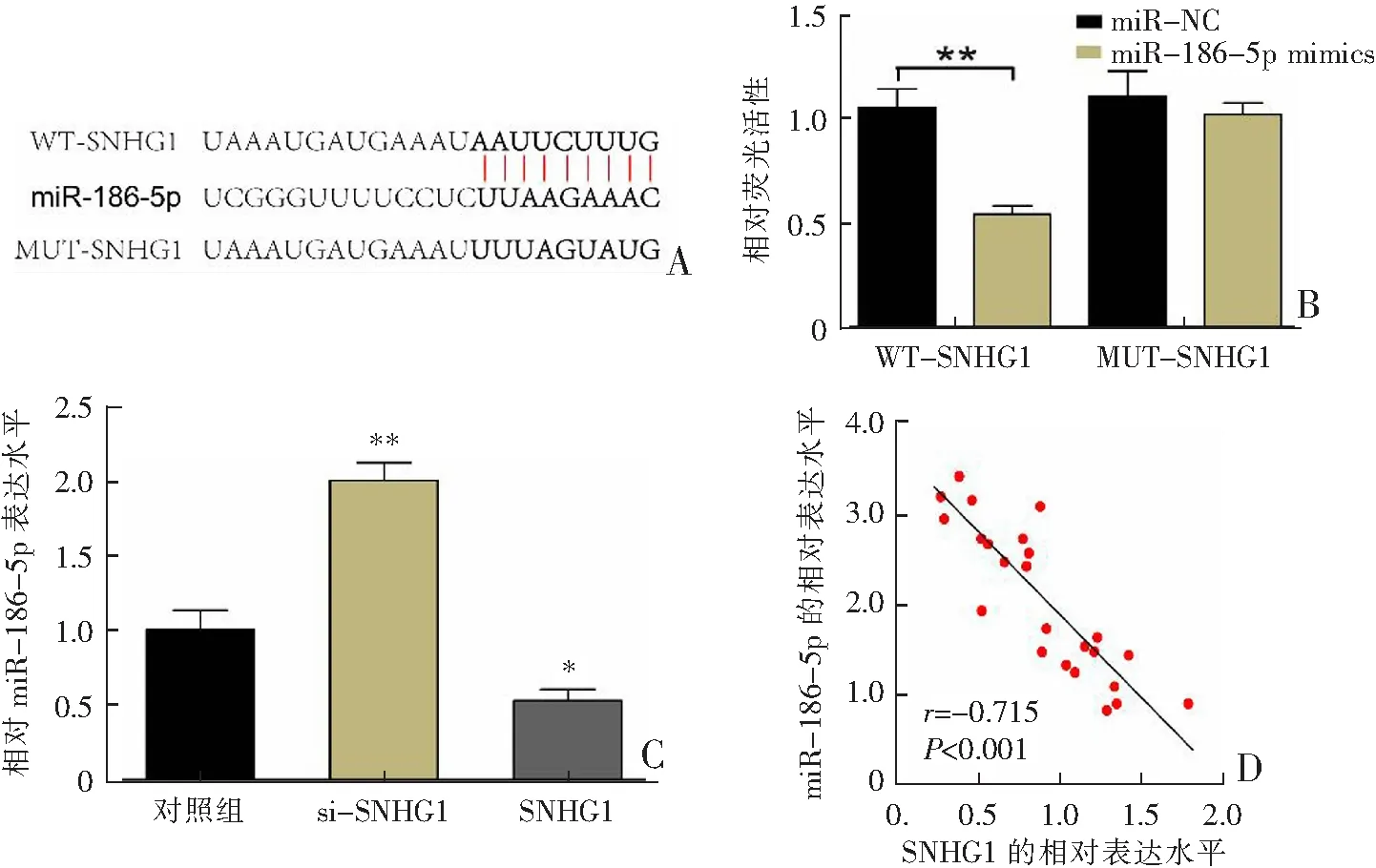
A:SNHG1与miR-186-5p的结合位点;B:双荧光素酶基因检测报告;C:qRT-PCR检测结果;D:OA软骨组织中miR-186-5p与SNHG1基因表达的相关性;*P<0.05,**P<0.01。
2.4 SNHG1通过靶向抑制miR-186-5p调控OA软骨细胞的增殖、凋亡和分化
与SNHG1单独转染相比,miR-186-5p模拟物和SNHG1共转染的OA软骨细胞凋亡率显著增加(P<0.01,图4A—B);细胞增殖活力显著降低(P<0.01,图4C);PCNA表达水平显著降低,Runx2表达水平显著增加(P<0.01,图4D—E)。结果表明,SNHG1可以与OA软骨细胞中的miR-186-5p竞争性结合,从而改善软骨细胞的增殖、分化并抑制细胞凋亡。
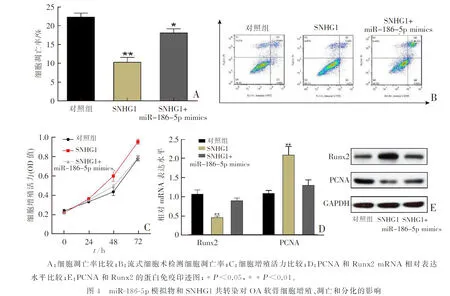
3 讨论
OA是最常见的关节疾病之一,正在成为世界范围内的公共卫生问题[15]。OA的发病机制尚未完全阐明,软骨细胞增殖和凋亡失衡是导致OA的主要因素之一,而lncRNA与软骨细胞关系密切[8,16]。本研究结果显示,SNHG1在OA软骨细胞中表达上调,这与LEI等[14]的研究一致。最近的一项研究[17]发现SNHG1通过与多吡啶束结合蛋白1(PTBP1)相互作用调节类风湿关节炎滑膜细胞侵袭和增殖。本研究发现SNHG1可以改善IL-1β诱导的软骨细胞细胞凋亡、增殖并降低细胞分化因子runx2的表达。这些结果表明SNHG1抑制了OA的发生和发展。
有研究[18]表明SNHG1有成为癌症诊断、预后和治疗的肿瘤生物标志物的可能,SNHG1通过激活不同的信号通路参与了人类癌症的发生[19-21]。LI等[22]研究表明LncRNA SNHG1通过与DNMT1(DNA甲基转移酶1)结合抑制p53表达促进肝癌发展;JI等[23]研究表明lncRNA SNHG1通过miR-195/NEK2轴促进宫颈癌的进展。此外,miR-577作为骨肉瘤细胞中SNHG1的ceRNA通过激活骨肉瘤细胞中的Wnt/β-catenin通路发挥致癌作用[24]。然而,SNHG1和OA之间的关系仍有待阐明。根据生物学软件Starbase预测miR-186-5p可能是SNHG1的直接靶标。因此,笔者推测SNHG1可能通过miR-186-5p在OA中发挥保护作用。本研究通过实时荧光定量PCR检测miR-186-5p在敲低或过表达SNHG1的软骨细胞中的相对表达,发现miR-186-5p的表达量与SNHG1呈负相关。此外,双荧光素酶报告基因结果证实miR-186-5p是OA软骨细胞模型中SNHG1的直接靶基因。本研究进一步实验验证了miR-186-5p对SNHG1介导的OA软骨细胞增殖、分化和凋亡的影响。结果表明,miR-186-5p mimic能够部分逆转了pc-SNHG1对关节炎软骨细胞增殖、分化和凋亡的影响。这进一步说明SNHG1通过靶向调控miR-186-5p调节骨关节炎的进展。有研究[25]表明敲低lncRNA MFI2-AS1通过增加miR-130a-3p/TCF4轴保护脂多糖(LPS)处理的软骨细胞的细胞活力,但抑制细胞凋亡、炎症反应和细胞外基质降解。还有研究[26]表明lncRNA-TUG1通过lncRNA-TUG1/miR-195/MMP-13轴调控骨关节炎细胞外基质的降解。这可能意味着lncRNAs的失调在各种尚未相关的慢性炎症疾病的发病机制中具有深远的影响。因此,接下来miR-186-5p的下游靶标及调控的信号通路将是本课题组的研究重点。
综上所述,SNHG1通过靶向调控miR-186-5p减轻软骨细胞炎症损伤,调节细胞增殖、凋亡和分化,为OA的治疗提供理论参考。
