基于影像学的PMS/PMDD 脑病理研究进展
2022-06-06李淑静孟辰高莹莹魏恩华曲嵩霖郭英慧
李淑静,孟辰,高莹莹,魏恩华,曲嵩霖,郭英慧,
山东中医药大学1.中医学院,2.附属医院放射科,3.中医药经典理论教育部重点实验室,济南 250355
经前期综合征(premenstrual syndrome,PMS)是育龄期女性的常见病、多发病,属于典型的精神情感障碍性疾病。PMS患者主要表现为经前烦躁易怒、抑郁、焦虑、乳房触痛或肿胀、头痛等,同时伴有情绪、行为和躯体症状。经前烦躁障碍(premenstrual dysphoric disorder,PMDD)是PMS 的严重类型,发病率达3%~8%,对患者日常生活工作及其家庭、社会造成负面影响[1]。现代医学认为PMS/PMDD 发病机制复杂,其发生与神经-内分泌-免疫网络、5-羟色胺(5-hydroxytryptamine,5-HT)能系统、γ-氨基丁酸(γ-aminobutyric acid,GABA)能系统失调密切相关,涉及多条信号通路调控,调节中枢定位于海马、下丘脑、杏仁核等脑区[2]。十几年来,关于PMS/PMDD 发病机制与GABA 能系统关系的研究众多,以往研究主要集中于雌孕激素含量变化引起PMDD 中枢神经系统异常,研究者结论不尽相同;近年来研究发现PMDD 患者对神经类固醇周期性波动敏感性增加,而不是由于卵巢类固醇绝对水平的差异[2,3],但中枢神经系统病理生理机制不明。本研究对PMS/PMDD 中枢神经系统病理机制研究进展做一综述。
1 中枢神经系统异常是PMS/PMDD 主要病理机制
研究表明,月经期持续性激素或神经类固醇周期性波动会引起PMDD 肝气逆证患者经前期规律性精神、躯体、行为异常,尤其是精神症状,因此,黄体期卵巢性激素的波动,PMS/PMDD 患者可能会将其感受为负面应激刺激,自身无法适应这些改变,从而发生经前情绪、躯体和行为的一系列过度反应。PMS/PMDD 病理生理改变与性腺激素水平以及中枢神经递质传递等因素有关[3],而甾体类性激素容易穿过血脑屏障,其受体分布于调节情绪和行为的多个脑区。大量现代研究显示中枢神经系统参与PMS/PMDD 发生发展过程,PMS/PMDD患者表现出不同区域的皮层厚度、皮质下体积、相关脑区反应性及与其他脑区的连接性等的不同程度改变,症状的严重程度每日记录量表(daily record of severity of problems,DRSP)评分呈现其各自的相关关系[4~7](表1)。同时杏仁核、海马以及额叶3 个脑区内相关分子指标水平也发生明显病理改变,5-HT 和去甲肾上腺素(norepinephrine,NE)含量显著增加,GABA 和四氢孕酮(allopregnanolone,ALLO)含量降低,GABAARα4 mRNA 和蛋白表达水平显著升高等[8]。但也有研究表示ALLO 水平降低对个体有益,可能是因为ALLO 在杏仁核反应中存在双峰效应,有待进一步研究。雌孕激素月经期周期性波动可能诱发PMDD 发生,但PMS/PMDD 不同脑区分别发生了哪些改变,以及不同脑区的微观调控机制和联系,目前尚不清楚。与PMS/PMDD 发生发展相关的脑区结构与功能病理改变分述如下。
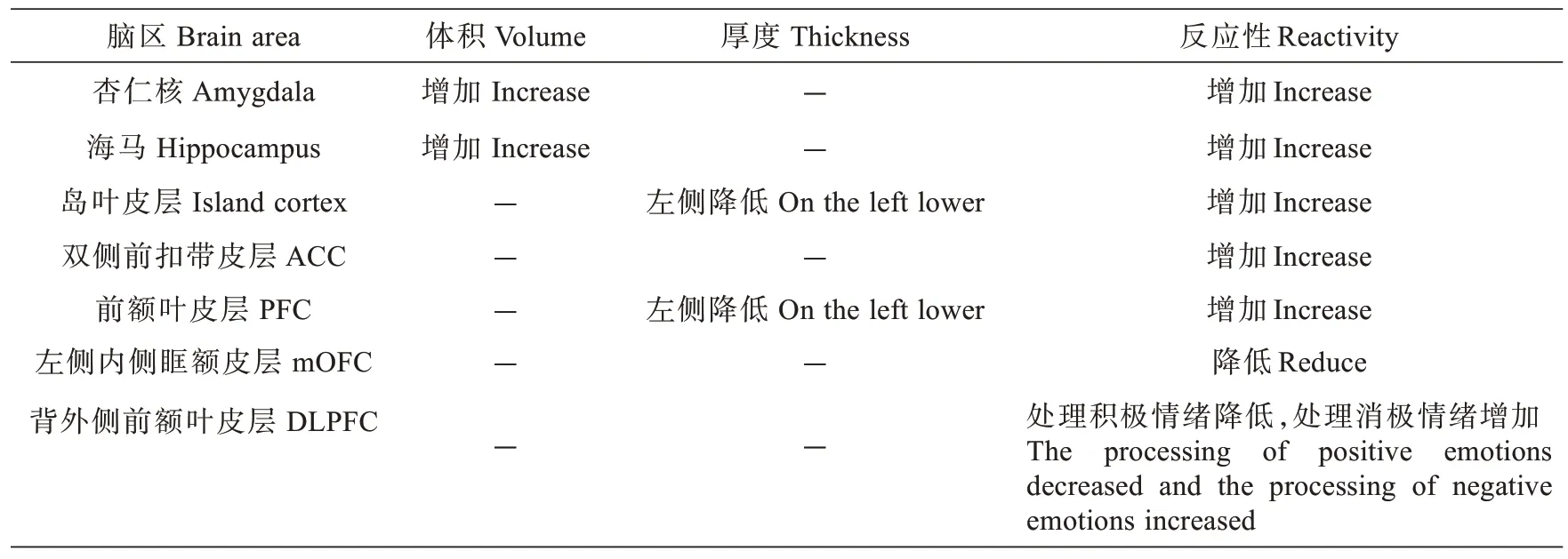
表1 PMDD 患者脑区结构和功能病理改变Tab.1 The pathological changes of the structure and function of the brain regions in patients with PMDD
1.1 PMS/PMDD 患者杏仁核结构及功能病理改变
1.1.1 性腺激素水平对杏仁核结构与功能的影响 杏仁核与脑内其他神经核团及大脑皮质存在广泛联系,因此,杏仁核不单是独立的解剖核团,而是具有广泛联系通路的重要神经功能核团,常见的神经变性病普遍存在杏仁核病理改变。月经周期中的激素波动已被证明会显著影响杏仁核的活动,PMDD 患者通常对低孕酮水平敏感,且相对较低的卵泡期孕酮血清浓度与杏仁核反应性之间呈正相关[5],这可能是该疾病情绪症状的关键因素。当性腺激素水平在相对稳定的高水平时期后下降,杏仁核结构或功能容易受到损伤[4],其体积、反应性和与其他脑区的连接性均发生改变。
1.1.2 负面情绪对杏仁核结构与功能的影响 研究表明,负面情绪会影响杏仁核的结构,患有PMDD 的患者杏仁核体积增加,其机制可能是由于负面刺激导致脑血流量和葡萄糖代谢异常及杏仁核神经可塑性变化的诱导[5]。杏仁核体积的增加和左侧前额皮层(prefrontal cortex,PFC)厚度的减少与负性情感的增强有关。极端个体的杏仁核体积与前额皮层厚度呈负相关,高焦虑或相关行为的个体其杏仁核-前额皮层耦合减少[6]。Shughrue 等[7]证实在黄体期和卵泡期,增强负面情绪反应,PMDD 患者经前相对于经后对负面刺激的杏仁核反应增强,抑郁评分与黄体期右侧杏仁核反应性呈正相关,与卵泡期右侧杏仁核反应性呈负相关。PMDD 患者其杏仁核对愤怒和恐惧面孔的大胆反应(即功能性反应)与卵泡中期的焦虑水平呈负相关。在黄体晚期,杏仁核对负面情绪刺激的反应与抑郁、焦虑等级和黄体酮(progesterone,P4)水平呈正相关[9],P4和雌二醇(estradiol,E2)浓度与杏仁核和前额叶皮层对消极和积极情绪刺激的大脑反应之间呈正相关[9]。
1.1.3 黄体晚期杏仁核与其它区域连接性的改变 Deng 等人[10]研究发现,PMDD 患者在黄体晚期表现出杏仁核与多个区域之间的连接性改变,如:左侧杏仁核与双侧内侧前额叶皮层、双侧前扣带皮层、右侧颞极、右侧中央前回和左侧岛叶之间的功能连接(functional connectivity,FC)增加,以及左侧杏仁核与右侧眶额皮层和右侧海马之间的FC 减少[10];其右侧杏仁核与双侧肾上腺皮质、双侧岛叶、右侧颞极、右侧中央前回和左侧多形核细胞之间的纤维连接蛋白增多,与右侧眶额皮层和右侧海马之间的纤维连接减少[10];进一步分析发现,DRSP 评分与右杏仁核和左杏仁核、左杏仁核和右中央前回之间的功能性突触联系呈正相关,与右杏仁核和右中央前回、左肾上腺皮质和左杏仁核之间的纤维连接强度呈显著正相关(P<0.001),与左侧大脑前回之间的联系呈显著正相关(P=0.005),与左侧多相流之间的联系呈显著正相关(P=0.003)。
1.2 PMS/PMDD 患者海马结构及功能病理改变
1.2.1 性腺激素水平对海马结构与功能的影响 海马是边缘系统的重要组成部分,在情绪调节和记忆管理中起重要作用,并在情绪刺激的检测中发挥功能,与记忆的编码、巩固和提取密切相关,Mineur 等人[11]发现,海马体激活增加与焦虑和抑郁相关的情绪调节有关。海马区高表达性激素受体,被认为是女性激素对神经可塑性影响的途径之一。研究表明,海马的结构和功能变化在月经周期期间是敏感的[12],PMDD 患者的海马体积与反应性的改变已被多次报道,而其与其他脑区的连接性改变也成为研究的热点。
1.2.2 负面情绪对海马结构与功能的影响 结构磁共振研究表明,卵泡期双侧海马体体积增加,右侧海马、梭形回和海马旁回的体积增大更为明显[13]。与PMDD 患者的卵泡晚期相比,黄体期海马体的灰质体积减少;与健康对照组相比,海马体皮质的灰质密度显著增加,海马旁回皮质的灰质密度显著降低[14,15]。有研究称,在结构水平上,海马体经前至经后灰质的增加与非文字记忆性能的改善呈正相关[9]。
1.2.3 PMDD 患者海马与多个区域之间的连接性改变 健康女性的功能磁共振成像研究发现,与早期卵泡期相比,休息时双侧海马和双侧上顶叶之间的功能耦合增加,黄体期海马对情绪面孔的反应活性降低[15]。在黄体期晚期,右海马和左前运动皮层之间的连接性降低,左海马和右额叶皮层之间的连接性增加[16]。
1.3 PMS/PMDD 患者大脑皮层结构及功能病理改变
1.3.1 静息状态下PMS/PMDD 患者大脑皮层结构和功能 大脑皮层每一个部分有重要的功能差异,与情绪反应的关系密切,从而参与PMS/PMDD 的发生发展。与PMS/PMDD 关系密切的杏仁核尤有强大的关联。首先,杏仁核和前额叶皮层之间有广泛的相互联系,特别是内侧和眶区,PFC 能够抑制或调节来自杏仁核的输入[17];其次,前扣带皮层与杏仁核具有强大的解剖和功能连接,在解剖学上与脑岛、丘脑、海马、腹侧纹状体和前额叶等多种大脑区域相互连接,构成情绪调节的特定网络,并整合到情绪大脑模型[9]。内侧前额叶皮层、后扣带皮层和楔前叶作为“皮层中线结构”[18]是大脑默认模式神经网络(default mode network,DMN)的重要组成部分,参与情绪调节。功能磁共振成像(functional magnetic resonance imaging,fMRI)研究结果显示PMDD 患者产生病理变化的主要区域的边缘系统包括大脑皮层的区域,并发生厚度以及复杂的反应代谢率的改变。
1.3.2 负面情绪对大脑皮层结构与功能的影响 PMDD 患者大脑皮层厚度的差异主要发生在左侧,其左半球皮层厚度明显低于正常人,包括内侧前额叶皮层、眶额皮层、初级体感皮层、楔前叶和岛叶,并且左侧前额皮层厚度与负性情感呈负相关关系[6]。在不同区域的连接性上,PMDD 患者表现出中央前回和颞回的功能连接性增加,后扣带皮层和中额叶皮层的功能连接性降低[19]。
1.3.3 PMDD 患者大脑皮层多个区域的反应性改变 PMDD患者黄体期前扣带皮层中的两个簇显示出更强的激活[20],黄体期前额叶皮层的反应性显著增强,因为PMDD 在黄体期的皮层情绪回路反应性发生了改变,同时岛叶皮层、额下回和额中回、右顶叶上回和左角回的激活增加[21]。另一项研究显示,PMDD 患者黄体期对阴性图像的处理过程中,外侧眶额皮层、前额皮层和背外侧额叶皮层过度活跃,而左侧内侧眶额皮层反应性减弱,且在抑制需求下未能增加该区域的激活[9]。黄体晚期右侧背外侧额叶皮层对负面图片的大胆反应(即功能性反应)与DRSP 评分之间存在负相关[22]。
1.4 PMS/PMDD 患者其他脑区结构及功能病理改变
1.4.1 其他脑区结构或功能与PMS/PMDD 患者情绪关系密切 楔前叶/后扣带皮层参与自我相关加工和情绪调节,其功能结构的改变与心理障碍有关,如患有产后抑郁症、帕金森病伴抑郁症的妇女和抑郁症(major depressive disorder,MDD)[13]。丘脑和苍白球是皮层-基底神经节-丘脑-皮层系统中特别重要的节点,通常认为基底神经节接收来自所有大脑皮层的输入,并通过它们的丘脑投射影响额叶皮层[23],对这个循环的破坏可能导致情绪的异常。脑岛在刺激的处理和参与监测内部环境的大脑区域之间提供联系,异常的岛叶激活可能导致情绪波动[24]。小脑长期以来被认为只参与运动功能,但研究表明,小脑的功能或结构异常会导致神经精神障碍。同时,小脑与中脑、杏仁核、海马、下丘脑、前扣带皮层、额叶皮层、海马等边缘和边缘结构紧密相连[21]。
1.4.2 负面情绪对PMS/PMDD 患者其他相关脑区结构与功能的影响 PMDD 患者的楔前叶/后扣带皮层和丘脑的灰质体积显著增加,且楔前叶/前交叉韧带平均体积与DRSP 评分呈正相关;脑岛的灰质体积明显减少[13],情绪性小脑的灰质体积增大[25]。
1.4.3 PMDD 患者其他相关脑区的反应性改变 研究表明PMDD 患者黄体晚期反应抑制期间的左岛叶反应性升高[26],同时小脑和肾上腺皮质的低频波动的分数幅度降低,这反映了小脑皮层-边缘回路可能受损或中断,最终导致皮层系统对边缘系统失去控制,进而导致PMDD 患者中皮层情绪和认知回路反应性的变化,这可能是情绪、认知和行为变化的基础,并在一定程度上导致经前综合征[21]。从卵泡中期到黄体后期小脑代谢的增加与这些阶段之间DRSP 评分的变化呈正相关[27]。
有报道称PMDD 患者可能存在与皮层-基底神经节-丘脑-皮层相关的神经通路改变[28],但需要进一步研究阐明。
2 总结与展望
综上所述,PMS/PMDD 病理生理改变与性腺激素水平、负面情绪影响以及中枢神经递质传递等因素有关,杏仁核可能与PMS/PMDD 患者经前焦虑、发怒等情绪表现,以及注意力不集中症状相关;下丘脑可能与PMS/PMDD 患者头痛、睡眠障碍、易怒甚至攻击行为相关;海马体可能与PMS/PMDD 患者情绪不稳定且自控能力差以及烦躁易怒等情绪表现相关;大脑皮层作为人类最高级中枢,与皮层下杏仁核、下丘脑、海马等是密切相关的,因此PMS/PMDD 患者经前烦躁易怒、焦虑抑郁、头痛、睡眠障碍等症状均可能与其相关。不仅是PMS/PMDD,探索多种疾病的中枢神经结构功能的病理改变已是现代研究的热点。患有PMS/PMDD 的女性在整个月经周期中表现出与健康女性不同的大脑功能、神经回路以及脑区GABA 能系统等变化,这表明PMS/PMDD 的特征可能是对影响情绪的激素波动的反应改变,这也是其发病机制所在。精准定位PMS/PMDD 相关发病脑区并探索其病理改变、发病机制还要依赖更大样本的研究和更深层的探索,为PMS/PMDD 的治疗和新药研发提供新的方向。
