乳杆菌发酵提高坛紫菜的抗氧化和抑制糖脂代谢关键酶活性
2022-06-02董玉婷蔡宏浩李志朋郑明静姜泽东邓尚贵李清彪
董玉婷,蔡宏浩,李志朋,3,4,5,郑明静,3,4,5,姜泽东,3,4,5,*,倪 辉,3,4,5,邓尚贵,李清彪,3,4,5
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.集美大学理学院,福建 厦门 361021;3.福建省食品微生物与酶工程重点实验室,福建 厦门 361021;4.大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034;5.厦门市食品生物工程技术研究中心,福建 厦门 361021;6.浙江兴业集团,浙江 舟山 316014)
坛紫菜()是福建省特色优势海洋藻类。福建省坛紫菜的产量约占全国总产量的50%。坛紫菜富含蛋白质、膳食纤维、氨基酸和矿物质等营养元素,长期食用具有抗氧化、降血脂、降血压、免疫调节等功效。目前,坛紫菜的精深加工产品较为缺乏,市场上主要以烘干制品(紫菜盘)、烘焙食品(烤海苔、夹心海苔)、速食汤品(紫菜汤)等形式流通,产品附加值低;同时,上述制品在加工过程中往往需要高温烘烤干制,会造成坛紫菜中一些热敏性营养成分的破坏。因此,研发坛紫菜精深加工技术,充分发挥和利用坛紫菜的营养活性价值是目前需要迫切解决的重要产业问题。
乳杆菌是食品加工中最常见的益生菌。乳杆菌菌株如嗜酸乳杆菌、植物乳杆菌、副干酪乳杆菌等因其具有优良的发酵特性已被广泛应用于食品加工。研究表明乳杆菌发酵能够促进植物基生物活性物质的释放,从而提高其生物活性,增强营养特性。刘金龙等利用植物乳杆菌发酵贝母-雪梨汁发现发酵有利于贝母细胞壁降解,促进总酚和总黄酮的释放,增加了贝母-雪梨汁的抗氧化能力。另一方面,乳杆菌发酵可将食物中的初级底物转化为具有功能性的物质,增强其生物活性。苟拥军等研究发现植物乳杆菌()发酵产生的某些特殊酶类如淀粉酶、蛋白酶等可将苹果浆中结合态多酚水解成游离态,提高游离多酚含量,进而提高苹果浆的抗氧化性能。Li Songlin等利用干酪乳杆菌()发酵大豆,发现发酵可将大豆释放的大豆异黄酮转化成更易吸收的苷元形式,从而提升营养价值和生物活性。因此,乳杆菌发酵是改善食品的营养品质和生物活性的重要加工技术手段,具有广阔的开发应用前景。德氏乳杆菌和植物乳杆菌是食品科学研究领域常见的发酵菌株,目前已有许多研究报道了德氏乳杆菌和植物乳杆菌的益生活性及其在发酵食品中的应用。基于此,本研究采用德氏乳杆菌和植物乳杆菌作为发酵剂对坛紫菜进行发酵,分析不同菌种发酵对发酵产物中主要活性成分的变化和生物活性(包括抗氧化活性、抑制胰脂肪酶和-葡萄糖苷酶活性)的影响,旨在为研发坛紫菜精深加工技术和高值健康食品提供前提基础,促进坛紫菜养殖和加工产业的可持续发展。
1 材料与方法
1.1 材料与试剂
坛紫菜采集于福建省霞浦县坛紫菜养殖海域,晒干后储于阴凉处备用。德氏乳杆菌保加利亚亚种(subsp.CICC 6045)、植物乳杆菌植物亚种(subsp.CICC 6076)购自中国工业微生物菌种保藏管理中心。
MRS(de Man,Rogosa and Sharpe)肉汤培养基北京陆桥科技有限公司;胰脂肪酶(来源于猪胰腺,EC:3.1.1.3)、奥利司他 默克生命科学(上海)有限公司;-葡萄糖苷酶(来源于嗜热脂肪芽孢杆菌)、对硝基苯酚、4-硝基苯基---吡喃葡萄糖苷(4-nitrophenyl---glucopyranoside,pNPG)、芦丁美国Sigma-Aldrich公司;阿卡波糖 拜耳医药保健(北京)有限公司;氘代水 上海麦克林生化科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
Avanti J26XP高速冷冻离心机 德国贝克曼公司;Cytation-5酶标仪 美国伯腾仪器有限公司;LA120S电子分析天平 赛多利斯科学仪器厂;ZWYR-2102生化培养箱 上海智城分析仪器制造有限公司;HH-4数显恒温水浴锅 常州国华电器有限公司;Free Zone 6 plus真空冷冻干燥机 美国Labconco公司;Avance III HD 600 MHz核磁共振(nuclear magnetic resonance,NMR)波谱仪 美国Bruker公司。
1.3 方法
1.3.1 乳杆菌发酵坛紫菜上清液的制备
将坛紫菜洗净后,在60 ℃条件下干燥至质量恒定。准确称取1 g干燥的坛紫菜,加入100 mL蒸馏水配制成悬浊溶液。向悬浊溶液中加入2%葡萄糖,搅拌均匀后65 ℃巴氏灭菌30 min。冷却至室温后,向悬浊溶液中分别添加5%(/)的德氏乳杆菌菌液或植物乳杆菌菌液(活菌数为10CFU/mL)作为发酵剂,37 ℃静置发酵0、12、24、36、48 h和72 h,获得两种乳杆菌(德氏乳杆菌、植物乳杆菌)发酵坛紫菜产物。发酵结束后,坛紫菜发酵产物6 000×离心20 min,除去沉淀,经过2.0 μm膜过滤,得到德氏乳杆菌发酵坛紫菜上清液(fermented supernatant of,LDFP)和植物乳杆菌发酵坛紫菜上清液(fermented supernatant of,LPFP)。未接种乳杆菌的坛紫菜悬浊溶液在相同条件下处理,得到未发酵的坛紫菜上清液(unfermented supernatant of,UNF),作为对照组。
1.3.2 总酚和总黄酮含量测定
采用福林-酚法测定各组样品(UNF、LDFP和LPFP)中的总酚含量。取500 μL上述发酵上清液样品于试管中,加入500 μL福林-酚显色剂及1.5 mL 7.5% NaCO溶液后,用蒸馏水定至5 mL,混匀避光反应2 h,用酶标仪在波长765 nm处测定吸光度。以不同质量浓度没食子酸标准溶液(0.01~0.10 mg/mL)绘制标准曲线=0.010 4+0.058 9,=0.999 8,其中为吸光度,为没食子酸标准溶液质量浓度(μg/mL)。每个样品平行测定3 次,总酚含量表示为每毫升发酵上清液中含有没食子酸当量。
采用亚硝酸钠-硝酸铝法测定各组样品(UNF、LDFP和LPFP)中的总黄酮含量。取2 mL样品于试管中,加入200 mL的5%亚硝酸钠溶液摇匀后静置6 min,再加入200 mL 10%硝酸铝溶液,摇匀后静置6 min,再加入1 mL 1 mol/L氢氧化钠溶液,用无水乙醇定容至5 mL,振荡摇匀后用酶标仪在510 nm波长处测定吸光度。以不同质量浓度的芦丁标准溶液(0.01~0.05 mg/mL)绘制标准曲线=0.005 6+0.048 3,=0.999 2,其中为吸光度,为芦丁标准溶液质量浓度(μg/mL)。所有样品都平行测定3 次,总黄酮含量表示为每毫升乳杆菌发酵上清液中芦丁当量。
根据总酚和总黄酮的测定结果,发现发酵48 h后发酵液中的活性成分变化趋于稳定,所以后续研究取发酵48 h的发酵上清液进行代谢组学分析和生物活性分析。
1.3.3 NMR分析
取发酵48 h的上清液样品UNF、LDFP和LPFP(各50 mL)在-80 ℃、0 Pa真空度条件下冷冻干燥72 h。冻干的样品分别用600 mL的氘代水溶解后,取500 mL转移5 mm NMR管中,以0.2 mmol/L的重水内标DSS(sodium 2,2-dimethyl-2-silylpentane-5-sulfonate)作为内参,在共振频率为600.1 MHz NMR波谱仪中进行测定,每个样品重复测定3 次,保证数据可靠性。
1.3.4 抗氧化活性测定
1,1-二苯基-2-三硝基苯肼(1,1-dipheny l-2-picrylhydrazyl,DPPH)自由基清除能力的测定参照Yu Liangli等方法。各取1 mL样品(UNF、LDFP和LPFP),分别加入1 mL 的DPPH 无水乙醇溶液(0.1 mmol/L),混合均匀后避光反应30 min,用酶标仪在517 nm波长处测定吸光度。对照组为蒸馏水代替样品测得吸光度,计算各样品的DPPH自由基清除率,VC作阳性对照,如式(1)所示:
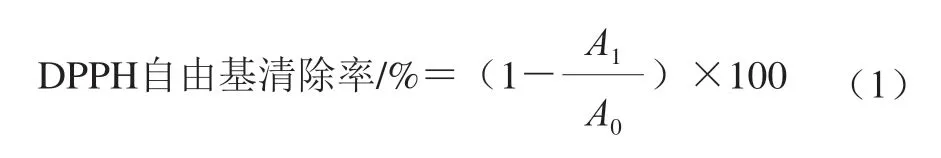
2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力的测定参照Baqueiro-Peña等方法。将7 mmol/L的ABTS溶液与2.45 mmol/L过硫酸钾(KSO)溶液等比例混合静置过夜,用磷酸盐缓冲液对其进行稀释至在734 nm波长下吸光度为0.7±0.02,即获得ABTS阳离子自由基工作液。分别取0.1 mL样品(UNF、LDFP和LPFP)与1 mL ABTS阳离子自由基工作液混合处理后,在734 nm波长处测定吸光度。对照组为蒸馏水代替样品测得吸光度,按照式(2)计算各样品的ABTS阳离子自由基清除率:

羟自由基清除能力的测定参照蒋边等方法。分别在离心管中依次加入0.5 mL样品(UNF、LDFP和LPFP)溶液、0.5 mL 9 mmol/L水杨酸-乙醇溶液、0.5 mL 9 mmol/L FeSO溶液和0.5 mL 8.8 mol/L HO溶液,用去离子水定容至5 mL混合均匀后于37 ℃水浴中反应10 min,在波长为510 nm条件下测定反应溶液的吸光度。对照组为蒸馏水代替样品测得吸光度,按式(3)计算各样品的羟自由基清除率:
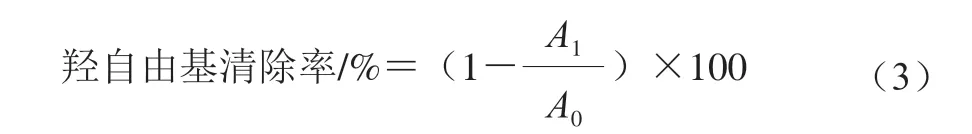
1.3.5 酶活力分析
1.3.5.1-葡萄糖苷酶活力抑制能力分析
参照Daub等方法测定各组样品(UNF、LDFP和LPFP)对-葡萄糖苷酶活力的影响。分别将100 mL样品(UNF、LDFP和LPFP)与250 mL-葡萄糖苷酶溶液(2 IU/mL)混合均匀,置于37 ℃恒温水浴锅中温育10 min后,加入250 mL 5.0 mmol/L pNPG溶液起始反应,37 ℃反应15 min后立即加入250 mL 1 mol/L NaCO溶液终止反应,于405 nm波长下检测溶液吸光度。以阿卡波糖作为阳性对照,利用在相同发酵条件下未添加坛紫菜的徳氏乳杆菌发酵上清液(fermented supernatant,LDF)和植物乳杆菌发酵上清液(fermented supernatant,LPF)作为样品空白对照组,排除因乳杆菌发酵产酸使酶失活的影响。每个实验做3 个平行,按式(4)计算抑制率:

式中:、和分别表示反应体系-葡萄糖苷酶+样品+pNPG、样品+pNPG和-葡萄糖苷酶+pNPG的吸光度。
1.3.5.2 胰脂肪酶活力抑制能力分析
参照詹慧等方法测定各组样品(UNF、LDFP和LPFP)对胰脂肪酶活力的影响。分别将100 mL样品和100 mL胰脂肪酶溶液(1 000 IU/mL)混合均匀,置于37 ℃恒温水浴锅中温育15 min后立即加入200 mL对硝基苯磷酸盐(-nitrophenyl phosphate,pNPP)溶液(2.0 mmol/L),再次放入37 ℃恒温水浴锅中温育15 min。反应结束后,立即放置于100 ℃水浴5 min以终止反应。终止后的反应液5 000×离心5 min取上清液,于405 nm波长下检测溶液吸光度。以奥利司他作为阳性对照,每个实验做3 个平行,抑制率计算同式(4),其中,、和分别表示反应体系中胰脂肪酶+样品+pNPP、样品+pNPP和胰脂肪酶+pNPP的吸光度。
1.3.5.3 酶促反应动力学分析
酶促反应动力学分析参照文献[23-25]方法。取200 mL不同浓度(0、0.5、1.0、1.5、2.0、2.5 IU/mL)的-葡萄糖苷酶溶液或200 mL不同浓度(0、200、400、600、800 IU/mL)的胰脂肪酶溶液,在各组溶液中分别加入200 mL的各乳杆菌发酵上清液(抑制剂组)混匀,置于37 ℃反应10 min(在相同条件下加入200 mL反应缓冲液替代乳杆菌发酵上清液作为无抑制剂组)。对-葡萄糖苷酶的酶促反应动力学分析,加入250 mL 5.0 mmol/L pNPG溶液作为反应底物,37 ℃静置反应10 min后,100 ℃水浴5 min终止反应,于450 nm波长下测定各反应体系吸光度;对胰脂肪酶的酶促反应动力学分析,加入400 mL的2 mmol/L pNPP溶液作为反应底物,37 ℃静置反应10 min后,100 ℃水浴5 min终止反应,于405 nm波长下测定各反应体系吸光度;以横坐标为酶液浓度,纵坐标为反应速率,绘制酶促反应动力学曲线。在100 mL固定浓度的-葡萄糖苷酶溶液(2 IU/mL)或胰脂肪酶溶液(500 IU/mL)中分别加入100 mL发酵上清液(抑制剂组)或加入反应缓冲液(无抑制剂组)混匀。对-葡萄糖苷酶的酶促反应类型分析,上述-葡萄糖苷酶溶液与发酵上清液混合体系中分别加入200 mL不同浓度的pNPG溶液(1.0、2.0、3.0、4.0、5.0 mmol/L)在37 ℃静置反应10 min,终止反应后,于450 nm波长下测定各反应体系的吸光度;对胰脂肪酶的酶促反应类型分析,上述胰脂肪酶溶液与发酵上清液混合体系中分别加入200 mL不同浓度的pNPP溶液(0.125、0.25、0.5、1.0、2.0 mmol/L)在37 ℃静置反应10 min,终止反应后,于405 nm波长处测定各反应体系的吸光度。以横坐标为反应底物(pNPG)浓度的倒数1/[],纵坐标设定为反应速率的倒数(1/),绘制Lineweaver-Burk双倒数曲线,判断酵坛上清液对-葡萄糖苷酶和胰脂肪酶的抑制类型。
1.4 数据分析
每个实验重复3 次独立平行实验,每个实验做3 个平行(=3),实验数据利用Microsoft Excel、MestReNova软件处理后用Graphpad prism 8.0作图,采用SPSS 17.0软件进行显著性分析。
2 结果与分析
2.1 乳杆菌发酵坛紫菜过程中发酵上清液总酚含量的变化
如图1所示,在0~72 h连续发酵过程中,两种乳杆菌发酵坛紫菜上清液(LDFP与LPFP)和UNF中的总酚含量均随着发酵时间的延长而显著增加(<0.05),并且在发酵开始后LDFP组与LPFP组中的总酚含量显著高于UNF组(<0.05)。另外,在发酵的12~36 h,LPFP组中的总酚含量显著高于LDFP组。以上结果表明,德氏乳杆菌和植物乳杆菌发酵均能够显著提高坛紫菜发酵上清液的总酚含量。
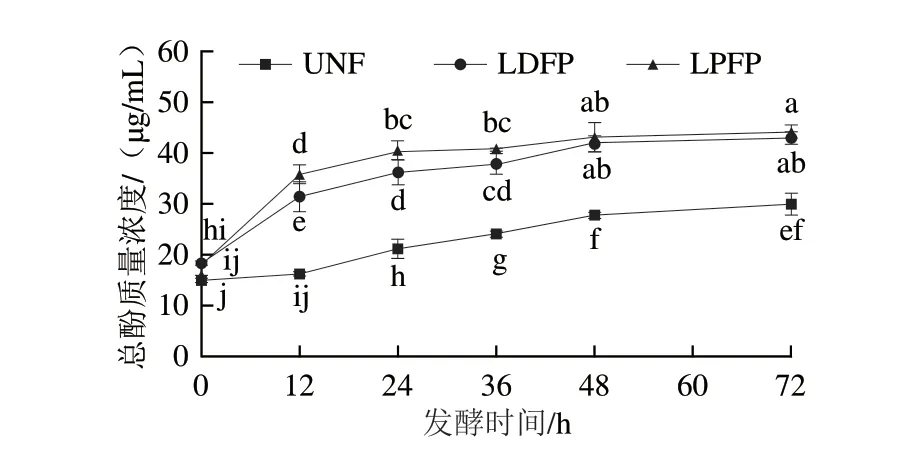
图1 乳杆菌发酵坛紫菜过程中上清液总酚含量的变化Fig.1 Changes in total polyphenols content in P.haitanensis during fermentation
2.2 乳杆菌发酵坛紫菜过程中发酵上清液中总黄酮含量的变化
如图2所示,在0~72 h连续发酵过程中,LDFP组与LPFP组的总黄酮含量随着发酵时间的延长呈先增加后下降的趋势,对照组UNF中总黄酮含量在整个发酵过程中无显著变化。同时,在发酵的0~24 h,LPFP组中总黄酮含量显著高于LDFP组(<0.05),而在后续发酵的36~72 h则呈相反的趋势,即LDFP组中总黄酮含量显著高于LPFP组(<0.05)。另外,研究发现不同乳杆菌菌种对发酵释放总黄酮的能力具有差异;LDFP组中总黄酮增幅最大,当发酵达到48 h其总黄酮质量浓度达到(22.8±1.4)μg/mL,相比UNF组增加了(1.4±0.07)倍,而LPFP组中总黄酮质量浓度在发酵24 h达到最大值为(21.9±1.3)μg/mL,相比于对照组增加了(1.3±0.1)倍。以上结果表明,德氏乳杆菌和植物乳杆菌发酵均能够显著提高坛紫菜发酵上清液的总黄酮含量,并且植物乳杆菌发酵相比德氏乳杆菌能更快促使总黄酮的释放。

图2 乳杆菌发酵坛紫菜过程中上清液总黄酮含量的变化Fig.2 Changes in total flavonoids content in P.haitanensis during fermentation
2.3 乳杆菌发酵坛紫菜上清液中代谢产物的变化
NMR波谱分析具有高重现性、无偏向性和无损伤性等优点,广泛应用于对代谢产物进行快速、准确、高效的定性定量检测。坛紫菜上清液中代谢组产物分析结果如图3所示。根据H NMR数据和相关文献,在UNF组上清液中鉴定出12 种化合物,如表1所示。乳杆菌发酵坛紫菜上清液中含量最多的是半乳糖和葡萄糖,因为半乳糖和葡萄糖是红藻细胞壁中主要成分。经乳杆菌发酵后,上清液中半乳糖和葡萄糖含量明显减少是由于乳杆菌会将葡萄糖和半乳糖转化成有机酸,同时需要消耗糖类为乳杆菌生长提供能量。另外,LDFP组的葡萄糖含量相比于UNF组分别减少53.7%,而LPFP组的葡萄糖含量只减28.9%,这可能是由于植物乳杆菌所产的-葡萄糖苷酶将紫菜纤维二糖分解成葡萄糖使LPFP组的葡萄糖含量相对增多。乳酸是乳杆菌利用葡萄糖为底物发酵的产物,LDFP组和LPFP组上清液中乳酸的含量相比于UNF组分别增加了1.1 倍和2.4 倍,表明植物乳杆菌对坛紫菜中糖类物质的分解代谢能力更强。基于H NMR分析,在UNF组上清液中鉴定出异亮氨酸、丙氨酸、谷氨酸、精氨酸、脯氨酸和牛磺酸等物质(表1)。丙氨酸是UNF组的主要氨基酸组分,其含量为3.14 mmol/L。经乳杆菌发酵后的LDFP组和LPFP组上清液中精氨酸和脯氨酸的含量明显提高,这与王清爽等用乳杆菌发酵脱脂薏米精氨酸和脯氨酸含量增多的结果一致。同时,乳杆菌发酵对上清液中脯氨酸的含量影响最为明显。相比UNF组,LDFP组中的脯氨酸含量增加了1.7 倍,LPFP组增加了3.4 倍。在NMR波谱分析中,没有鉴定出多酚和黄酮类物质,这可能是因为大部分酚酸类物质在3.0~4.0区域,其化学信号被含量较多的半乳糖或葡萄糖覆盖。
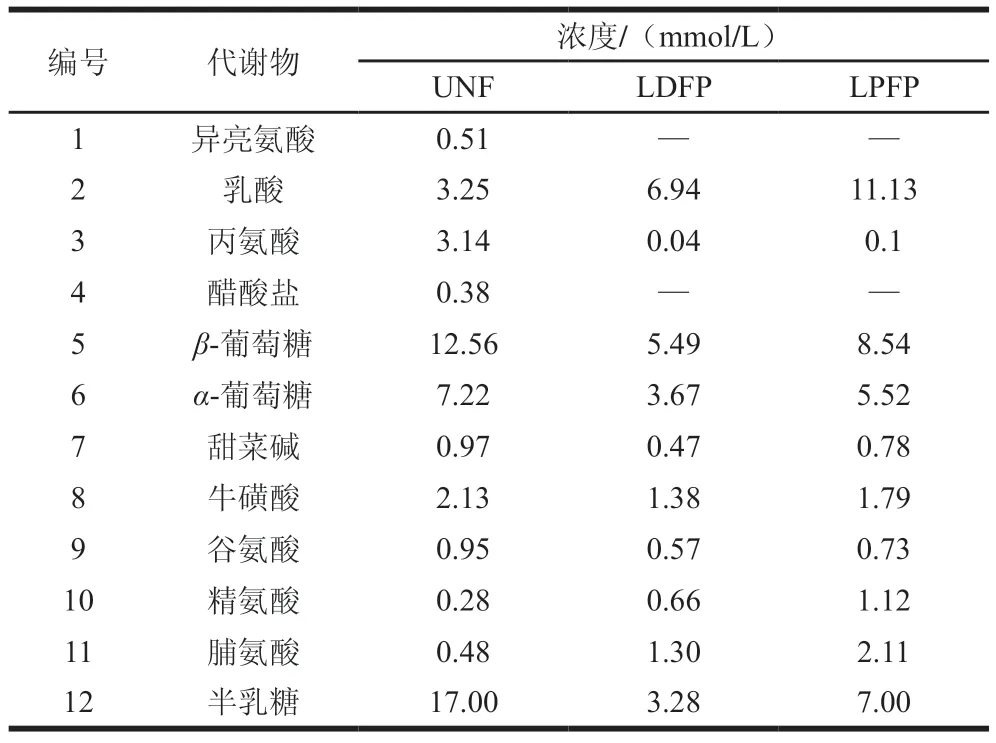
表1 乳杆菌发酵坛紫菜上清液中代谢产物的鉴定Table 1 Summary of metabolites identified in the supernatants of P.haitanensis
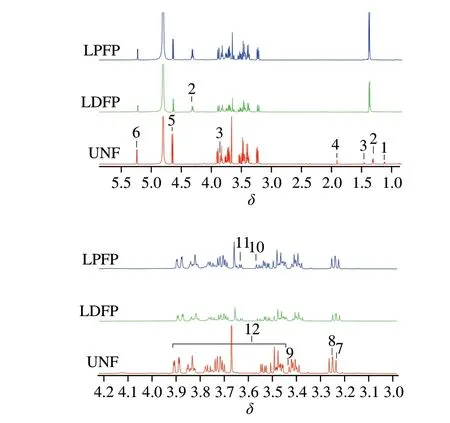
图3 坛紫菜上清液的1H NMRFig.3 1H NMR spectra of fermented supernatants of P.haitanensis with different Lactobacillus species
2.4 乳杆菌对坛紫菜发酵上清液抗氧化活性的影响
过量的超氧化物自由基会加速机体的氧化衰老,因此清除自由基能力是评价抗氧化活性的重要指标。由图4A可知,UNF组上清液对DPPH自由基清除率为(48.5±2.8)%,LDFP组和LPFP组上清液的DPPH自由基清除能力显著提升(<0.05),并且LDFP组显著高于LPFP组(<0.05),表明德氏乳杆菌发酵相比于植物乳杆菌可更有效地提高坛紫菜发酵上清液的DPPH自由基清除能力。乳杆菌发酵坛紫菜上清液对ABTS阳离子自由基和羟自由基的清除能力如图4B所示。UNF组上清液对ABTS阳离子自由基的清除率为(66.3±3.9)%,低于对照组(200 μg/mL VC溶液)。通过乳杆菌发酵后,LDFP和LPFP组上清液对ABTS阳离子自由基的清除能力显著高于UNF组,与阳性对照组无显著差异,分别达到(71.8±2.1)%和(74.4±1.0)%。乳杆菌发酵坛紫菜上清液对羟自由基清除能力的变化趋势与其对ABTS阳离子自由基的清除能力相似。乳杆菌发酵后显著提高LDFP组和LPFP组上清液对羟自由基的清除率(<0.05),提高了2 2%~2 4%,但不同菌种之间无显著差异(图4C)。以上结果表明,乳杆菌发酵可显著提高坛紫菜发酵上清液的抗氧化活性。
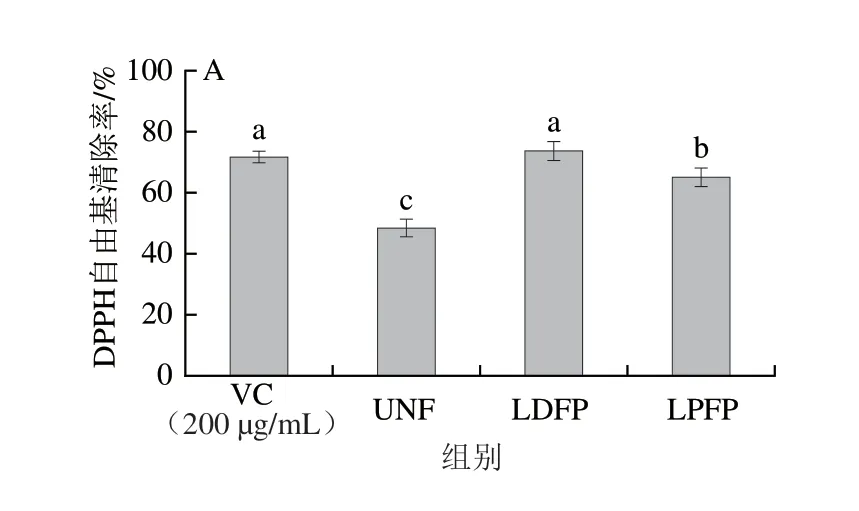
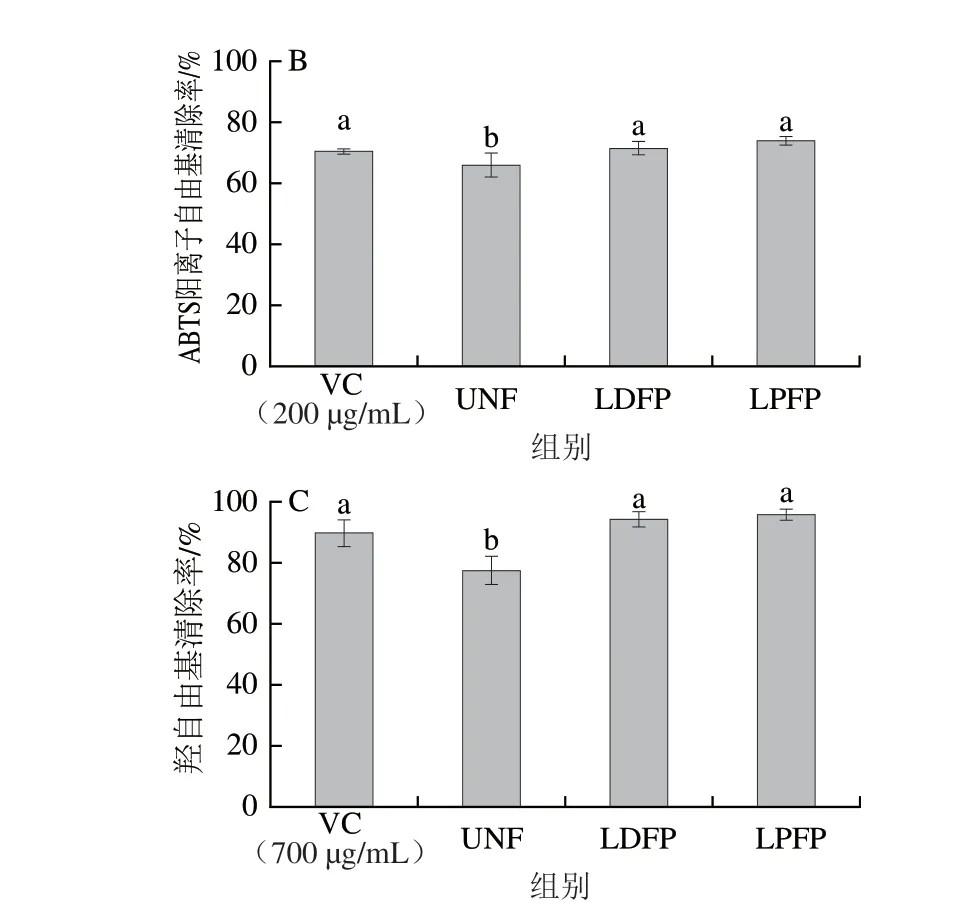
图4 乳杆菌对坛紫菜发酵上清液抗氧化活性的影响Fig.4 Effect of Lactobacillus on antioxidant activity of fermented supernatant of P.haitanensis
2.5 乳杆菌对坛紫菜发酵上清液抑制α-葡萄糖苷酶和胰脂肪酶活力的影响
研究表明-葡萄糖苷酶(EC 3.2.1.20)能催化低聚糖类底物的-1,4-糖苷键水解生成葡萄糖,通过抑制肠道中-葡萄糖苷酶的酶活可阻断碳水化合物分解成葡萄糖,降低餐后血糖水平,从而达到有效预防和辅助治疗II型糖尿病。而胰脂肪酶能够将甘油三酯水解分成小分子脂肪酸和甘油单酯有利于吸收,过多吸收脂类物质容易导致肥胖,会引起高血脂、糖尿病和心血管疾病等慢性疾病,所以抑制肠道中胰脂肪酶活性能够有效抑制机体对脂肪吸收达到降脂效果。坛紫菜发酵上清液对-葡萄糖苷酶和胰脂肪酶活力的影响如图5所示。UNF组上清液对-葡萄糖苷酶和胰脂肪酶活力抑制率分别为(16.7±2.5)%和(48.7±1.4)%。经乳杆菌发酵后,上清液对-葡萄糖苷酶和胰脂肪酶活力的抑制率显著提高,其中对胰脂肪酶活力的抑制率提高幅度最大(<0.05)。结果显示,LDFP组和LPFP组的上清液对-葡萄糖苷酶活力的抑制率分别达到(51.6±0.8)%和(53.9±1.2)%;而LDFP组和LPFP组的上清液对胰脂肪酶活力的抑制率分别达到(95.3±1.3)%和(88.0±2.6)%,相比UNF组上清液的抑制活性提高了80.7%~95.7%。同时,在相同发酵条件下未添加坛紫菜的乳杆菌发酵上清液LDF组(pH 3.2)和LPF组(pH 3.1)上清液对-葡萄糖苷酶和胰脂肪酶活力的抑制作用均分别显著低于LDFP组和LPFP组上清液。以上结果表明,通过乳杆菌发酵能够显著强化坛紫菜发酵产物的抑制-葡萄糖苷酶和胰脂肪酶活性,其中经德氏乳杆菌发酵的坛紫菜上清液对胰脂肪酶活力抑制效果最好。

图5 乳杆菌发酵坛紫菜上清液对α-葡萄糖苷酶(A)和胰脂肪酶(B)的抑制活性Fig.5 Inhibitory activity of α-glucosidase (A) and pancreatic lipase (B)by fermentation supernatant of P.haitanensis
图6A结果表明,3 组直线均通过原点,且添加不同发酵(LDFP和LPFP组)上清液后直线的斜率减小,表明两种乳杆菌发酵坛紫菜上清液对-葡萄糖苷酶的抑制类型均为可逆抑制。通过Lineweaver-Burk双倒数曲线作图(图6B)得到,在固定酶浓度的情况下,随着底物浓度的不断减少,酶促反应的最大速率()逐渐变小,酶促反应的米氏常数()减小;同时,添加上清液和不添加上清液的曲线相交于第2象限,这是典型的非竞争与竞争混合型抑制。如图6C所示,乳杆菌发酵坛紫菜上清液对胰脂肪酶的抑制类型与其对-葡萄糖苷酶的抑制类型相同,为可逆抑制。进一步基于Lineweaver-Burk双倒数曲线作图(图6D)得到,添加不同发酵(LDFP和LPFP组)上清液后,酶促反应最大速率()变小,酶促反应的米氏常数()增大,同时添加不同发酵(LDFP和LPFP组)上清液和不添加发酵上清液的曲线相交于第3象限,为典型的非竞争与反竞争混合型抑制。
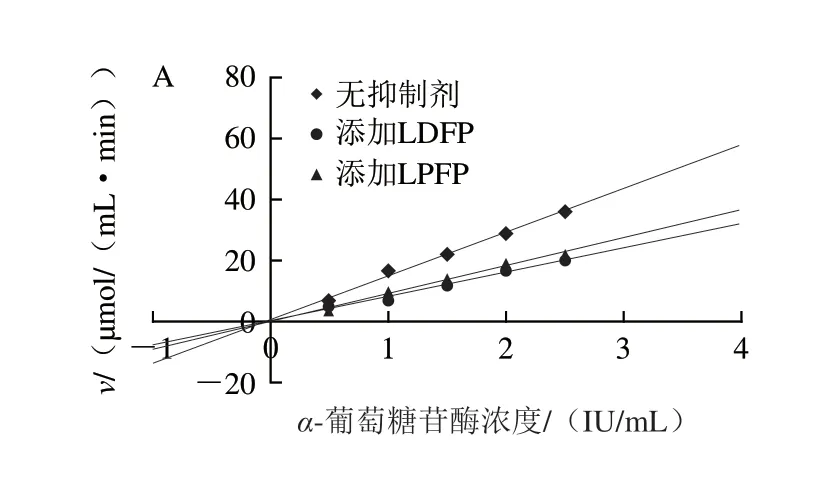
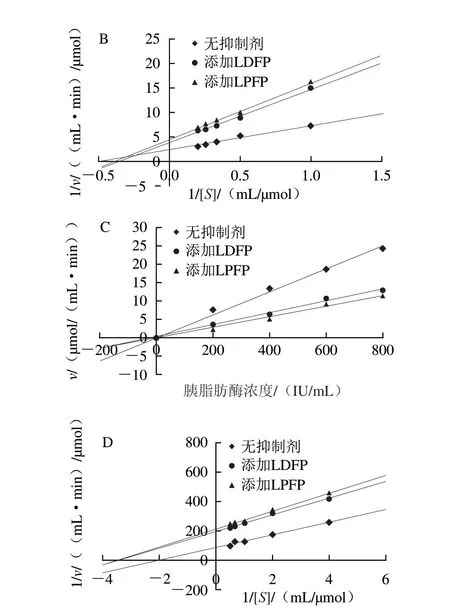
图6 酶浓度与酶促反应速率的关系曲线(A、C)及酶促反应速率与底物浓度的Lineweaver-Burk曲线(B、D)Fig.6 Relationship curve between enzyme concentration and enzymatic reaction rate (A,C) and Lineweaver-Burk curve between enzymatic reaction rate and substrate concentration (B,D)
3 讨论
多酚类化合物是紫菜中重要的膳食营养元素之一,具有抗氧化、抗肿瘤、抑菌等生理活性。本研究结果显示,经不同乳杆菌发酵后的坛紫菜上清液中总酚、总黄酮含量显著增多,与Gao He等报道的利用植物乳杆菌发酵苦瓜汁中总酚的变化趋势一致。大量研究表明,乳杆菌可以将糖基化酚去糖基化继而从植物细胞壁中释放可溶性共轭或不溶性结合酚类化合物,且乳杆菌产生的微生物酶如还原酶、单宁酶和酚脱羧酶等能将酚苷类化合物水解成更简单的相应的苷元的形式。另外,乳杆菌能够将植物基中的生物活性物质转化为其代谢物,从而产生新的酚类化合物。在发酵48 h后多酚增加速率减缓,是因为乳杆菌进入生长衰减期导致其发酵能力减弱。本研究发现两种乳杆菌发酵坛紫菜上清液中的总黄酮含量随着发酵时间的延长呈先增后降的趋势,但发酵上清液中总黄酮含量显著高于未添加乳杆菌发酵的上清液。李垚等利用乳杆菌发酵红甜菜过程中其总黄酮含量也呈先增后减的趋势。在Kwaw和于金慧等的研究中也发现总黄酮含量出现相似的变化趋势。研究表明,发酵过程中植物基中复杂的多酚被糖苷酶分解成更简单的黄酮化合物导致总黄酮增加。同时,乳杆菌发酵可促使植物基的细胞壁破裂从而促进各种黄酮活性物的释放。综上,这些原因可能导致乳杆菌发酵后的坛紫菜上清液中总酚、总黄酮含量显著增加。
乳杆菌发酵能够促使植物基生物活性物质的释放,增强植物基的生物活性和营养特性。同时,乳杆菌自身及其代谢产物如胞外多糖、多酚和黄酮等具优良的抗氧化活性。酚类化合物作为常见的抗氧化剂,其与黄酮类物质可通过运输氢原子或通过单电子螯合金属离子破坏自由基的链式反应。Niccolai等报道了利用植物乳杆菌发酵螺旋藻显著提高其总酚含量和抗氧化活性。另外,已有研究表明经乳杆菌还原酶、酚脱羧酶等水解后的苷元形式的多酚具有更高的自由基清除能力。有研究表明脯氨酸也具有抗氧化活性。乳杆菌发酵能显著提高坛紫菜发酵上清液的抗氧化活性,这与乳杆菌发酵坛紫菜上清液中总酚、总黄酮和脯氨酸的含量增多有关。但是,LDFP组和LPFP组上清液中的脯氨酸含量与其抗氧化效果并未呈正相关,表明脯氨酸不是乳杆菌发酵坛紫菜上清液中主要的抗氧化活性成分。总酚和总黄酮的含量与自由基清除能力呈正相关。因此,在乳杆菌发酵坛紫菜上清液中总酚和总黄酮是主要的抗氧化活性成分。在研究中还发现,经乳杆菌发酵后两种发酵上清液中精氨酸和脯氨酸的含量显著升高,且LPFP组上清液中精氨酸和脯氨酸的含量高于LDFP组。文献报道在发酵过程中乳杆菌代谢产生了大量有机酸能够激活植物基发酵原料的内源性蛋白酶的活性。在酸性环境、内源酶和乳杆菌产生的外源酶的共同作用下,植物基原料的蛋白质被降解,造成游离氨基酸的含量增加。因此,推测脯氨酸和精氨酸含量的增多是由于乳杆菌发酵代谢产生的酸性环境激活了紫菜内源性蛋白酶与乳杆菌外源蛋白酶共同作用所导致。李俊健等研究表明经乳酸芽孢杆菌DU-106发酵柚皮泡菜的发酵液中氨基酸含量显著高于自然发酵和植物乳杆菌发酵,推测是因为乳酸芽孢杆菌在发酵过程中产蛋白酶较其他菌株丰富。与上述研究结果相似,LDFP和LPFP组中脯氨酸含量的差异可能是植物乳杆菌在发酵过程中所产蛋白酶比德氏乳杆菌更为丰富所致。两种乳杆菌发酵所产生游离氨基酸差异的相关机制将在后续研究中进一步探讨并阐明。
抑制-葡萄糖苷酶和胰脂肪酶活性是减少饮食中碳水化合物和脂肪类吸收的一种有效方法,用乳杆菌发酵工艺开发健康食品,预防和减缓糖尿病、肥胖等慢性疾病已经在动物和人体模型中进行了广泛研究。本研究表明乳杆菌发酵能显著提高坛紫菜对-葡萄糖苷酶和胰脂肪酶活力的抑制,特别是德氏乳杆菌发酵坛紫菜后其上清液对胰脂肪酶活性抑制率高达(95.3±1.3)%。同时,乳杆菌发酵后坛紫菜上清液中总酚和总黄酮含量与对其-葡萄糖苷酶和胰脂肪酶的抑制率呈正相关,已有研究表明酚类化合物的酚羟基和总黄酮类化合物A环和B环上的羟基可以与酶活性位点的氨基酸残基之间形成氢键使酶失活,因此推测发酵后总酚与总黄酮的增加是对相关酶活力抑制效果提升的重要原因。另外,本研究发现乳杆菌发酵坛紫菜产物对-葡萄糖苷酶和胰脂肪酶的抑制类型存在差异,推测是由于不同乳杆菌发酵产生的部分多酚和黄酮在结构上存在差异导致。因此,后续研究将以此为切入点通过对上清液中多酚和黄酮进行定性和定量分析,阐明其量效关系。
4 结论
本研究探索了乳杆菌发酵对坛紫菜发酵上清液营养成分的变化及其抗氧化和抑制糖脂代谢关键酶活性的影响。基于H NMR代谢组学分析、自由基清除能力实验和-葡萄糖苷酶及胰脂肪酶活力分析模型等,研究和评价发酵上清液中的主要代谢产物及其抗氧化活性和抑制-葡萄糖苷酶及胰脂肪酶的活性。由结果可知,乳杆菌可有效提高坛紫菜发酵上清液中总酚和总黄酮的含量,增强其抗氧化活性和其对-葡萄糖苷酶及胰脂肪酶的抑制活性,具有潜在的减缓和辅助治疗糖尿病和肥胖等慢性疾病的潜在功效。本研究可丰富坛紫菜精深加工的食品营养学理论基础,为研发坛紫菜高值健康食品提供科学依据。
