不同原料对酱香大曲微生物群落结构及多样性的影响
2022-06-02母应春王涵钰
赵 驰,苏 伟,*,母应春,郑 璞,王涵钰
(1.贵州大学酿酒与食品工程学院,贵州 贵阳 550025;2.贵州大学 贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025)
中国白酒被列为世界六大著名蒸馏酒之一。其中,茅台酒是中国著名的传统白酒,它以高度复杂、甘甜和清爽的风味而闻名,其特点主要来源于酱香大曲。酱香大曲以纯小麦为主要原料,经破碎、配料、成型、发酵、拆曲、贮存等步骤固态发酵而成。酱香大曲作为茅台酒的糖化、发酵与生香剂,由多种微生物、功能酶和风味化合物组成。研究发现原料是影响发酵进程和产物品质的重要因素,不同原料营养成分的差异与发酵产物的品质和功能密切相关。然而,到目前为止,酱香大曲仍是基于纯小麦在开放环境下自然发酵生产的,导致原料探索存在数据集缺陷。
纯小麦与青稞和紫小麦成分类似,但青稞(-葡聚糖、酚类化合物和蛋白质)和紫小麦(花色苷和微量元素)部分功能营养成分明显高于纯小麦。因此,通过原料的营养成分差异探究大曲微生物菌群结构和丰度对白酒风格和品质的多元参数具有重要意义。曾桥等利用不同原料在同一加工条件下发现茯砖茶活性成分和微生物多样性呈显著差异。江伟等发现以高粱、小麦、大米、糯米和玉米酿造的白酒风味各具特色,但以高粱为酿造白酒原料更具优势。随着检测技术的发展,对发酵产品微生物的研究越来越多。基于高通量测序技术揭示了贵州和四川主要酿酒企业采集的14 份酱香大曲样品微生物、传统与自动化制酱香大曲的微生物群落结构、茅台镇不同主酿区大曲细菌菌群结构和贵州传统小曲微生物群落分布及代谢潜力。但对酱香大曲的研究主要集中在纯小麦发酵制备酒曲的微生物,不同原料营养成分差异对发酵调控微生物菌群结构及多样性却鲜见报道。
因此,本研究采用高通量测序技术,对同一加工条件下不同原料加工而成的酱香大曲样品进行微生物群落结构和多样性分析。并利用主成分分析(principal component analysis,PCA)、聚类分析(hierarchical cluster analysis,HCA)、正交偏最小二乘判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)和线性判别差异贡献分析(linear discriminant analysis effect size,LEfSe)对组间分离情况和菌群关键生物标记进行探究,旨在为酱香大曲的品质研究提供新参数。
1 材料与方法
1.1 材料与试剂
酱香大曲:分别以青稞、紫小麦和纯小麦为原料,按照传统酱香大曲加工工艺(润料、粉碎、拌曲、成型、发酵、拆曲、贮存)制成青稞曲(QKQ)、紫麦曲(ZMQ)和小麦曲(XMQ)(图1)。样本基于Zhang Chunlin等方法采集于2020年6月。收集后,这些样本被迅速运送至实验室,然后放入无菌袋储存在-80 ℃待进一步分析。
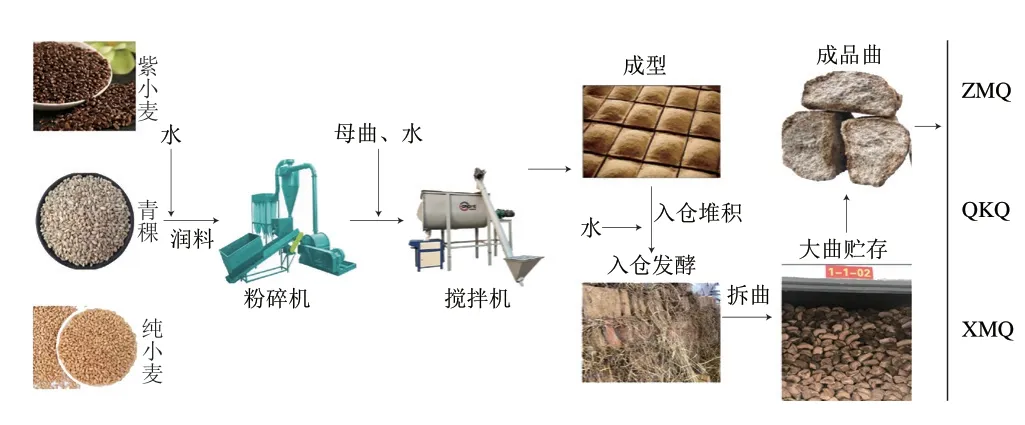
图1 酱香大曲制备流程Fig.1 Preparation process of Jiang-flavor Daqu
DNA提取试剂盒 美国MP Biomedicals公司;琼脂糖 西班Biowest公司;FastPolymerase 中国sGen公司;正反引物 深圳市英俊生物技术有限公司;DNA纯化磁珠 南京诺唯赞生物科技有限公司;MinElute PCR纯化试剂盒 德国Qiagen公司。
1.2 仪器与设备
GeneAmp 9700 PCR仪 美国ABI公司;Nanodrop 2000超微量分光光度计、ST16R台式高速冷冻离心机美国Thermo Fisher Scientific公司;Illumina HiSeq 2500测序仪 美国Illumina公司;FA1004N电子分析天平上海精密科学仪器有限公司。
1.3 方法
1.3.1 DNA提取和PCR扩增
使用E.Z.N.A.土壤DNA 试剂盒(OMEGA)直接从样本中提取总基因组DNA。然后使用正反引物(338F:5’-ACTCCTACGGGAGGCAGCA-3’和806R:5’-GGACTACHVGGGTWTCTAAT-3’)结合适配器和条形码序列对1 6 Sr RNA 基因的V3-V4高变区进行PCR扩增;真菌使用引物ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和ITS2R(5’-GCTGCGTTCTTCATCGATGC-3’)在ITS1区进行PCR扩增。PCR使用下列程序进行:95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存。
1.3.2 高通量测序和数据处理
扩增后的PCR产物纯化参考文献[19]。纯化后的产物通过NanoDrop 2000分光光度计进行定量,随即按照每个样本的测序要求,进行相应比例的混合,并使用Low Sample Protocol进行建库,最后在Illumina HiSeq 2500平台上进行高通量测序。首先,使用FLASH v1.2.7软件,通过Overlap对每个样品的reads进行拼接;然后使用Trimmomatic v0.33软件,对拼接得到的raw tags进行过滤,得到高质量的tags数据;最后通过UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据。此外,使用Usearch软件对tags在97%的相似度水平下进行聚类获得可操作分类单元(operational taxonomic unit,OTU),并基于Silva(细菌)和 UNITE(真菌)分类学数据库对OTU进行分类学注释。
1.4 数据统计分析
所有统计分析均使用SPSS 25.0软件进行。基于获得的OTU表格,利用QIIME计算样品的多样性,包括丰富度指数(ACE指数和Chao1指数)和多样性指数(Shannon指数和Simpson指数)。随后使用R软件可视化样品间Venn图、稀释曲线图和优势属的堆叠柱状图。使用SIMCA 14.1软件对微生物属数据集进行PCA和OPLSDA,在OPLS-DA模型上,确定细菌和真菌的PCA得分图。此外,通过R软件进行了样品间的HCA。最后,利用Python 2.0软件进行LEfSe。每个样品进行5 次实验。
2 结果与分析
2.1 α多样性分析
XMQ、ZMQ和QKQ样本质量控制后,在16S rRNA序列中分别得到(59 763±8 414)、(68 309±4 326)条和(57 368±12 272)条有效序列,ITS序列中分别得到(77 787±419)、(77 963±553)条和(77 364±12 220)条有效序列。基于细菌和真菌OTU 数的覆盖率(表1)和稀释曲线(图2A)趋于平缓,表明本研究的测序深度足以代表样品的微生物结构,说明测序数据足够后续分析。此外,描述了不同样品中微生物群落的丰富度和多样性(表1)。通过计算样品的丰富度指数发现,QKQ的真菌和细菌ACE指数(79.6±15.3和139.9±7.9)和Chao1指数(76.9±18.2和142.7±9.7)最高,说明样品中微生物群落的丰富度最高;相反地,ZMQ样品中微生物群落的丰富度最低,其真菌和细菌的丰富度指数分别为ACE指数(39.0±19.3和103.1±16.5)和Chao1指数(37.0±18.3和100.9±16.0)。同时,通过多样性指数发现XMQ中真菌和细菌的Simpson指数(0.3±0.1和0.2±0.1)和Shannon指数(1.6±0.3和2.2±0.3)分别为最高和最低,这表明样品中微生物群落的多样性最低。而真菌多样性以QKQ最高,Simpson指数和Shannon指数分别为0.2±0.1和1.8±0.3。
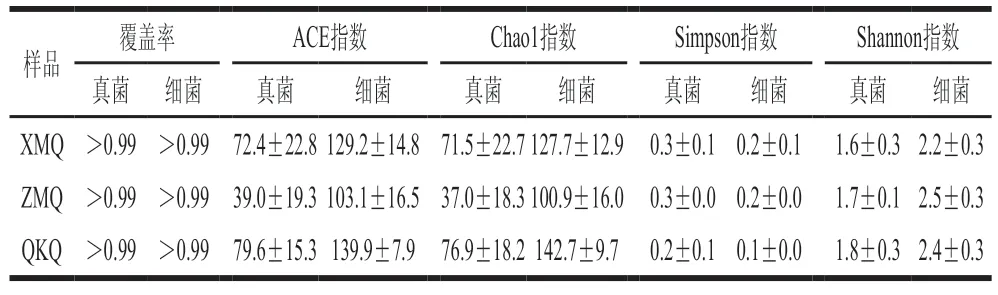
表1 大曲样品中微生物菌群的α多样性Table 1 α Diversity of microflora in Daqu samples

图2 真菌和细菌的稀释曲线(A)和Venn图(B)Fig.2 Rarefaction curves (A) and Venn diagrams (B) of fungi and bacteria
根据Venn图(图2B),3 份大曲样品中细菌OTU总数和唯一数均为最高,但真菌OTU的唯一数在3 份大曲样品中无明显差异。此外,QKQ和XMQ样品中细菌和真菌的OTU独自共有数最多,分别为20和15。
2.2 微生物群落结构分析
根据OTU分析结果,对样品数据在门和属水平上进行分类学分析。如图3所示,在门水平上,所有样品共检测到8 个门(相对丰度>0.1%),包括3 个真菌门(子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和毛霉门(Mucoromycota))和5 个细菌门(厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和蓝藻菌门(Cyanobacteria))。3 个大曲样品中均以子囊菌门、厚壁菌门和放线菌门为绝对优势门(相对丰度>1%)。与之前研究结论一致,Gan Shuheng等在茅台酒酿造使用的大曲中确定了子囊菌门为优势真菌群。同时,有研究表明茅台镇不同主酿区域酱香型白酒酿造大曲中优势细菌门为厚壁菌门和放线菌门。此外,拟杆菌门主要存在于ZMQ中。根据相关研究报道,拟杆菌门不仅是酱香大曲中优势门,同样也是芝麻香型大曲和浓香型大曲等白酒糖化发酵剂中的主要细菌门。


图3 大曲样品在门水平上细菌(A)和真菌(B)的相对丰度Fig.3 Relative abundance of bacteria (A) and fungi (B) at the phylum level in Daqu samples
在属水平上,图4A、B分别显示了9 个大曲样品细菌属和真菌属的总体概况(相对丰度>1%),分别占总丰度的93.57%和96.25%。观察到优势细菌属为克罗彭斯特菌属()、uncultured_bacterium_f_Bacillaceae、高温放线菌属()、魏斯氏菌属()、枝芽孢菌属()、乳杆菌属()、芽孢杆菌属()、链霉菌属()、葡萄球菌属()、火山渣芽孢杆菌属()、棒状杆菌属(_1)、uncultured_bacterium_f_Pseudonocardiaceae、短杆菌属()和鞘氨醇杆菌属(),属厚壁菌门、放线菌门和拟杆菌门。更具体地说,克罗彭斯特菌属和枝芽孢菌属在XMQ(33.40%和26.20%)、ZMQ(12.36%和5.28%)中表现出优势相对丰度,与Zou Qiancheng等对传统与机械化制酱香大曲发酵过程中细菌多样性和任爱荣等对茅台镇酱香型白酒酿造大曲及环境中可培养细菌多样性及功能分析研究一致。克罗彭斯特菌属有利于白酒发酵过程中醋酸、乳酸、苹果酸和乙酸乙酯的增加。据报道,枝芽孢菌属在白云边白酒发酵剂及发酵过程、玉米黄酒和中国传统鱼露等发酵产品中发现,具有较高的蛋白酶活性,且与十二酸乙酯、3-甲基-1-丁醇等风味化合物呈正相关关系。同样,在QKQ和XMQ中,乳杆菌属、魏斯氏菌属的相对丰度分别为13.71%、25.37%和10.84%、11.92%。检测到的这两种属均属于乳酸菌,与自动与传统法制酱香大曲微生物群落研究一致。简而言之,乳酸菌作为功能微生物,在中国食品工业中发挥着至关重要的作用。已有报道,乳酸菌不仅通过发酵产生细菌素,而且通过消耗发酵糖积累有机酸,这表示乳酸菌可以提供一个较低的pH值条件,抑制病原菌在酿造过程中的繁殖,从而促进最终产品的感官和营养价值的提高。高温放线菌属39.86%仅存在于QKQ,有研究根据可培养和不可培养两种方法报道了高温放线菌属大多存在于高温发酵条件下。因此,在高温大曲中检测到高温放线菌属也不足为奇。此外,uncultured_bacterium_f_Bacillaceae 41.65%、芽孢杆菌属11.11%和火山渣芽孢杆菌属6.09%仅作为ZMQ的主要优势属。芽孢杆菌属是一种广泛存在于各种发酵食品中的需氧菌,已被鉴定为大曲中的功能性微生物,能代谢产生蛋白酶、淀粉酶和其他水解酶,也能产生吡嗪、挥发酸、芳香和酚类化合物,这些物质对茅香型白酒的风味形成和品质具有重要贡献。有研究报道,火山渣芽孢杆菌属存在于高温大曲中,细胞具有需氧、不活动、革兰氏染色阳性、氧化酶阴性和过氧化氢酶阳性等特点。然而,uncultured_bacterium_f_Bacillaceae在本研究中被首次报道。
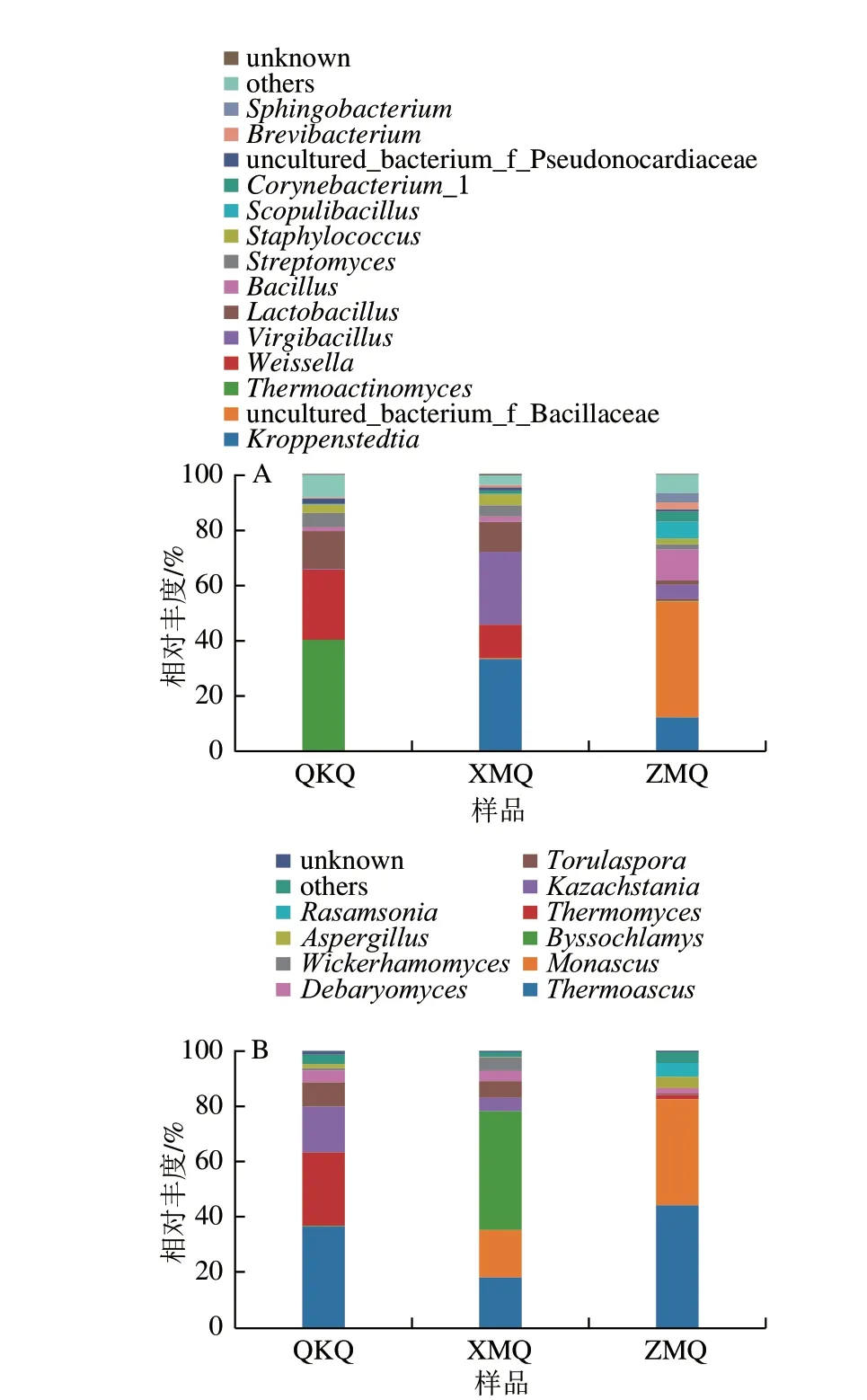
图4 大曲样品在属水平上细菌(A)和真菌(B)的相对丰度Fig.4 Relative abundance of bacteria (A) and fungi (B) at the genera level in Daqu samples
鉴定出的优势真菌属(相对丰度>1%)为热子囊菌属()、红曲霉属()、丝衣霉属()、嗜热真菌属()、哈萨克斯坦酵母属()、孢圆酵母属()、德巴利氏酵母属()、、曲霉属()和,属于子囊菌门。其中,在3 个大曲中以热子囊菌属和德巴利氏酵母属为主,而嗜热真菌属和丝衣霉属分别为QKQ和XMQ的绝对优势属。热子囊菌属和嗜热真菌属是高温大曲中常见的两种真菌,在高温下生长繁殖,产生多种耐热水解酶帮助白酒堆积糖化发酵,从而对酱香风味的形成起重要作用。丝衣霉属具有耐热、耐低氧、耐酸和产果胶酶等特性,且与己酸乙酯、辛酸乙酯等酱香型白酒主体香气成分密切相关。红曲霉属主要存在于XMQ和ZMQ,而哈萨克斯坦酵母属和孢圆酵母属则以XMQ和QKQ为主。红曲霉属能分泌大量酯酶,对碳酸十四乙酯和苯乙醇的形成有促进作用。哈萨克斯坦酵母属和孢圆酵母属作为非酿酒酵母菌,通过其独特的次生代谢物产生对酒的感官特性作出积极贡献。其中,哈萨克斯坦酵母属代谢物主要具有果香和花香的特征,与酿酒酵母相比,能产生大量乙酸异戊酯等酯类化合物。有研究报道,孢圆酵母属对糖的利用速度优于哈萨克斯坦酵母属。此外,曲霉属和主要存在于ZMQ。曲霉属能产生水解酶作用于淀粉糖化、蛋白质水解和类黄酮的生成,从而促进芳香类化合物的形成。有报道称,是中温大曲和普洱茶风味形成的潜在功能微生物。综上所述,大曲样品中检测到的微生物在结构和多样性上存在较大差异,主要由原料营养成分差异所致。
2.3 PCA、OPLS-DA和HCA
通过对样品数据的多元统计分析,较为客观地反映样品的微小变化及分类。基于不同原料制备的酱香大曲微生物属的相对含量数据,利用SIMCA 14.1软件进行PCA、OPLS-DA和HCA(图5)。PCA得分图表明组间分离明显、信度较高,在细菌分析中变量得分图显示PC1和PC2的方差贡献率分别为43.39%和40.24%(图5A),真菌中的变量得分图显示PC1为52.43%,PC2为33.69%(图5A)。此外,为了更好地了样品组间差异的微生物属,进行了OPLS-DA,以滤除与微生物属中分类变量无关的正交变量,并分别分析非正交变量和正交变量,以获得更可靠的模型信息。根据OPLS-DA得分图的结果,样本均在95% Hotelling的平方椭圆内,说明分析样本中不存在异常值(图5B)。模型中细菌和真菌的R和值非常接近1,表明它们可以有效地解释样本之间的差异。同时,通过HCA结果发现,在细菌属的聚类分析中ZMQ和XMQ聚为一簇,而QKQ独为一簇(图5C)。然而,在真菌属的聚类分析中QKQ和ZMQ为一簇,XMQ单独为一簇(图5C)。上述结果表明,不同原料制备的酱香大曲由于原料成分差异导致最终产品在微生物间存在较大差异。

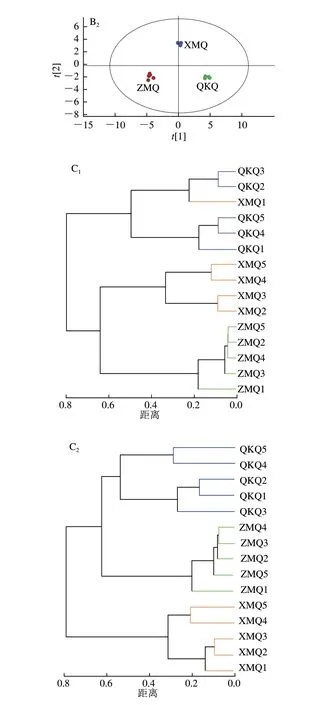
图5 大曲样品中微生物属的PCA(A)、OPLS-DA(B)和HCA(C)Fig.5 PCA (A),OPLS-DA (B),and HCA (C) of microbial genera in Daqu samples
2.4 样品组间微生物群落显著性差异及标记物分析
为进一步探究不同原料加工制备酱香大曲中的微生物群落标记物,基于LEfSe方法对3 组大曲样品间菌群丰度差异特征进行分析。微生物各分类水平上的分类等级树如图6A和图6B所示,由内圈到外圈分别表现为微生物群落从界到属分类单元的等级关系,节点大小表示分类单元的丰度高低,黄色节点代表组间无显著差异的分类单元,其他颜色的节点表示该分类单元在对应样品中丰度较高且组间具有显著差异,线性判别分析值(LDA score)设定为4.0。
基于LEfSe,3 组大曲样品优势属中共发现10 种显著差异细菌属(图6A)和9 种显著差异真菌属(图6B)(LDA score>4,<0.05)。其中,ZMQ样品占9 种,分别为5 种细菌属(棒状杆菌属_1、鞘氨醇杆菌属、芽孢杆菌属、火山渣芽孢杆菌属和uncultured_bacterium_f_Bacillaceae)和4 种真菌属(曲霉属、红曲霉属、热子囊菌属和)。XMQ样品含4 种显著差异属,细菌属(枝芽孢菌属和克罗彭斯特菌属)和真菌属(丝衣霉属和)分别占两种。同时,QKQ显著差异细菌属(高温放线菌属、乳酸菌属和魏斯氏菌属)和真菌属(嗜热真菌属、哈萨克斯坦酵母属和孢圆酵母属)分别为3 种。此外,柱状图的优势属中4 种细菌属(葡萄球菌属、链霉菌属、短杆菌属和uncultured_bacterium_f_Pseudonocardiaceae)和1 种真菌属(德巴利氏酵母属)未能体现,可认为它们的组间差异性不明显。

图6 大曲样品中细菌(A)和真菌(B)的LEfSe分析Fig.6 LEfSe analysis of bacteria (A) and fungi (B) in Daqu samples
3 结论
分别以青稞、紫小麦和纯小麦为原料,以相同条件下加工而成的酱香大曲为样品,采用高通量测序技术对微生物群落结构和多样性进行分析,并基于多元统计分析揭示了组间分离情况及标记微生物。结果表明:在细菌属中,XMQ以克罗彭斯特菌属、枝芽孢菌属、乳杆菌属和魏斯氏菌属为主;ZMQ以克罗彭斯特菌属、枝芽孢菌属、uncultured_bacterium_f_Bacillaceae、芽孢杆菌属和火山渣芽孢杆菌属为主;QKQ以乳杆菌属、魏斯氏菌属和高温放线菌属为主。在真菌属中,样品均以热子囊菌属和德巴利氏酵母属为优势属;此外,XMQ以丝衣霉属、红曲霉属、哈萨克斯坦酵母属和孢圆酵母属为主;ZMQ以红曲霉属、曲霉属和为主;QKQ以哈萨克斯坦酵母属、孢圆酵母属、嗜热真菌属为主。多元分析表明组间分离明显,且从优势属中共获得了10 种显著差异细菌属和9 种显著差异真菌属。目前,对不同原料酒曲微生物的代谢机制不明确,后续研究需进一步利用代谢组学、转录组学和蛋白质组学方法研究酒曲的功能菌株及发酵机制。本研究结果为生产酱香大曲时选择原料提供了指导。
