D-对羟基苯甘氨酸合成酶重组菌的高密度发酵工艺*
2022-06-01陈科奇郑梦泽李婷婷史大华
陈科奇,朱 海,郑梦泽,李婷婷,史大华
(江苏海洋大学 a.药学院;b.江苏省海洋药物活性分子筛选重点实验室;c.江苏省海洋生物资源与环境重点实验室,江苏 连云港 222005)
0 引言
具有光学活性的D-对羟基苯甘氨酸(D-HPG)是最重要的D-氨基酸之一,被广泛用作β-内酰胺类抗生素(如半合成青霉素类和头孢类)的工业生产。D-HPG可由D,L-对羟基苯海因(D,L-HPH)通过双酶法生产[1-3]。D,L-HPH在D-海因酶(DHD)的作用下催化生成中间产物D-氨基甲酰-对羟基苯甘氨酸(D-CpHPG),再经过D-氨甲酰水解酶(DCB)的作用脱去氨甲酰基,得到产物D-对羟基苯甘氨酸(D-HPG)[4]。这种海因酶—氨甲酰水解酶的生物催化方法由于反应条件温和,反应速率快,产率高,成为目前生产D-HPG的主要酶学方法[5]。然而,双酶法工艺的低生产率和高生产成本大大限制了其工业应用。
目前关于酶法催化生产D-HPG的研究主要集中于酶突变的筛选或优化工艺来提高催化效率。如樊帅等[6]基于对海因酶底物结合通道的分析,筛选到了催化效率较高的突变体。Engineer等[7]报道了一种具有广泛底物谱和高催化效率的海因酶。王胜锋等[8]则在双酶反应体系中额外添加海因消旋酶,从而降低转化温度,也有利于降低生产的能耗。但是迄今为止,大部分重组菌构建都选择大肠杆菌作为宿主细胞[9-11]。重组菌的催化活性虽然能够达到应用要求,但在大规模培养方面存在技术困难,例如生产成本高、形成包涵体等问题[12-13],限制了其工业应用。获取规模大且廉价的可用于工业化生产的重组工程菌迫在眉睫,其中对重组菌发酵条件的优化和成本的控制是一个必然选择。
本研究首先构建可溶性表达的DHD和DCB重组大肠杆菌,并分别通过单因素实验对两种酶的诱导表达与发酵培养条件进行优化,如诱导剂浓度、培养温度和培养pH等,然后针对双酶体系中的限速酶DCB进行进一步发酵条件的筛选,通过响应面法对其培养基组分进行优化,从而为获得高效低廉的工程菌提供技术支持,为其工业化生产奠定理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株与质粒D-海因酶基因、D-氨甲酰基水解酶基因与相关引物,由安徽通用生物公司进行合成;实验所用E.coliTOP10,E.coliBL21(DE3)菌株及表达载体pBAD均由作者所在实验室保藏。
1.1.2 试剂与培养基 限制性内切酶NcoⅠ和HindⅢ、质粒小提试剂盒、胶回收试剂盒以及琼脂粉均购自愚公生物科技有限公司;氨苄青霉素(ampicillin,Amp)购自上海生物工程股份有限公司;酵母粉和蛋白胨购自英国OXIOD公司;其他试剂均购自上海国药集团化学试剂有限公司。
LB种子培养基配制:称取5 g酵母粉,10 g胰蛋白胨,10 g NaCl于900 mL去离子水中,定容至1 L,121 ℃高温蒸汽灭菌。
基础发酵培养基配制:称取24 g酵母提取物,12 g胰蛋白胨,4 mL甘油于900 mL去离子水中,121 ℃高温蒸汽灭菌,待冷却后,加入100 mL的磷酸盐缓冲液。磷酸盐缓冲液配置方法为:KH2PO42.31 g,K2HPO412.54 g,溶解定容于100 mL去离子水,抽滤灭菌。
1.1.3 主要仪器 恒温金属浴,杭州米欧仪器有限公司;恒温振荡摇床,上海一恒科技有限公司;GenoSens 1860凝胶成像系统,上海勤翔科学仪器有限公司;JN-02细胞高压破碎仪,广州聚能生物科技有限公司;高速冷冻离心机,美国Beckman公司;T 100梯度PCR仪,美国Bio-Rad公司;Synteny Neo 2多功能酶标仪,美国Bio-Tek公司;六联排玻璃发酵罐(1 L×6)和5 L发酵罐,上海百伦科技有限公司;高效液相色谱仪,日本岛津公司。
1.2 实验方法
1.2.1 工程菌DHD与DCB的构建 采用PCR方法得到合成在PUC19载体上的海因酶(Genebank:X91070)与氨甲酰水解酶(Genebank:X91070)基因;使用HindⅢ和NcoⅠ内切酶对pBAD载体进行双酶切;将得到的基因片段与载体分别使用无缝克隆的方法连接,验证,测序准确后转入E.coliBL21(DE3)菌株,得到DHD与DCB工程菌。
1.2.2 诱导条件的优化
(1)优化诱导剂浓度。将种子液以1∶50的体积比例接种于50 mL含终质量浓度0.05 g/L氨苄青霉素的LB培养基中,37 ℃,220 r/min培养至OD600达到0.8左右,加入不同浓度的阿拉伯糖进行诱导,分别设置诱导诱导剂质量浓度为2,4,6,8 g/L, 发酵12 h。通过50 mL菌液的总酶活高低选定最佳诱导剂质量浓度。
(2)优化诱导温度。将种子液以1∶50的体积比例接种于50 mL含终质量浓度0.05 g/L氨苄青霉素的LB培养基中,37 ℃,220 r/min培养至OD600达到0.8左右,加入阿拉伯糖进行诱导,分别设置诱导温度为16,22,27,32,37 ℃,发酵12 h。通过50 mL菌液的总酶活高低选定最佳温度条件。
(3)优化pH条件。将种子液以1∶50的体积比例接种于500 mL含终质量浓度0.05 g/L氨苄青霉素的LB培养基中,在1 L发酵罐中以37 ℃,220 r/min条件培养至OD600达到0.8左右,加入阿拉伯糖进行诱导,分别设置发酵过程中pH为5,6,7,8,9,发酵12 h。通过50 mL菌液的总酶活高低选定最佳pH条件。
1.2.3 酶活定义 酶活定义方法参考李法彬等[14],具体实施方式如下。
(1)D-海因酶活性的测定。取0.5 mL细胞培养液,13 000 r/min离心3 min,收集菌体;用50 mmol/L,pH为8.0的Tris-HCl缓冲液洗涤菌体两次,用2 mL 质量分数1%的D,L-HPH(溶于Tris-HCl缓冲液)重悬,37 ℃恒温振荡反应60 min,加入10 μL 6 mol/L的HCl终止反应,取上清液用HPLC定量测定D,L-HPH的减少量。1个D-海因酶催化活性单位(U)定义为:在1 min内水解1 mmol/L的D,L-HPH生成D-CpHPG所需要的酶量。即
UDHD=V·ΔC·m菌体/mDHD。
其中:ΔC表示HPLC测得的D,L-HPH减少量,mmol/L;V表示反应体系体积,L;m菌体表示DHD菌体质量,g;mDHD表示反应体系加入的DHD的质量,g。
(2)D-氨甲酰水解酶活性的测定。取 0.5 mL细胞沉淀用等体积的15 mmol/L的D-CpHPG反应液重悬,37 ℃恒温振荡反应60 min, 加入10 μL 6 mol/L的HCl终止反应, 取上清液用HPLC定量测定D-HPG的含量。1个D-氨甲酰水解酶催化活性单位(U)定义为:1 min内水解D-CpHPG生成1 mmol/L的D-HPG所需要的酶量。即
UDCB= ΔC·V·m菌体/mDCB。
其中:ΔC表示HPLC测得的D-HPG生成量,mmol/L;V表示反应体系体积,L;m菌体表示DCB菌体质量,g;mDCB表示反应体系加入的DCB的质量,g。
1.2.4 活性测定方法 活性表征方法参考钮利喜等[15]的HPLC法。HPLC条件为:V(A:50 mmol/L乙酸-乙酸钠溶液,pH=4.2)∶V(B:甲醇)=9∶1,总流速为0.5 mL/min,检测波长254 nm,柱温30 ℃。
1.2.5 菌体密度测定 测量菌液在600 nm下的吸光度,将菌液稀释直至吸光度在0.3~1.0范围内。将测得的吸光度乘以稀释倍数,即为菌体密度。
1.2.6 响应面法优化培养基 通过单因素法对发酵培养基中的碳源与氮源种类进行优化,然后通过Plackett-Burman实验,使用Design Expert 12软件设计实验组,筛选对菌体生长影响显著的培养基成分。然后根据central composite design(CCD)实验原理,对显著因素进行响应面分析实验。实验数据使用Design Expert 12软件经多项式回归分析,并对拟合方程作显著性检验,其统计学上的显著性由F检验确定。
1.2.7 5 L发酵罐验证 在通过上述优化得到的条件后,使用5 L发酵罐进行放大验证。将种子液以1∶50 的体积比例接种于含有3 L发酵培养基的5 L发酵罐中,37 ℃培养。全过程使用体积分数50%的氨水与磷酸维持发酵过程中的pH,通过额外流加0.2 g/mL的葡萄糖与转速调控维持体系溶氧在30%以下。待OD600达到约20时,使用阿拉伯糖进行诱导发酵。
1.2.8 催化反应条件的优化
(1)两种酶的投放比例。在37 ℃,50 mmol/L Tris-HCl(pH=8),5 g/L底物的条件下,固定DCB的加入量(细胞干质量)为底物质量的0.75%,取m(DHD)∶m(DCB)分别为1∶2,1∶4,1∶6,1∶8和1∶10,反应48 h,通过产率来确定最佳投放比例。
(2)两种酶的投放量。在37 ℃,50 mmol/L的Tris-HCl(pH=8),5 g/L底物的条件下,固定DHD与DCB的比例,取DCB(细胞干质量)分别为底物质量的0.25%,0.50%,0.75%,1.00%与1.25%进行试验,反应48 h,通过其产率来确定最佳投放量。
1.2.9 数据处理与分析 如无特别说明,实验部分所述实验均进行3次重复,每次重复进行3组平行试验,数据图像使用GraphPad Prism 8进行绘制。
2 结果与分析
2.1 工程菌DHD与DCB的构建
分别将D-海因酶和D-氨甲酰水解酶基因构建在pBAD载体上,测序成功后转入E.coliBL21(DE3)中,得到工程菌。首先在37 ℃培养OD600约为0.6,然后加入终质量浓度2 g/L的阿拉伯糖诱导发酵4 h,使用SDS-PAGE电泳对蛋白表达情况进行检测。结果如图1所示,DHD蛋白约为53 kDa,DCB蛋白约为34 kDa,与预期一致,两种蛋白成功表达。
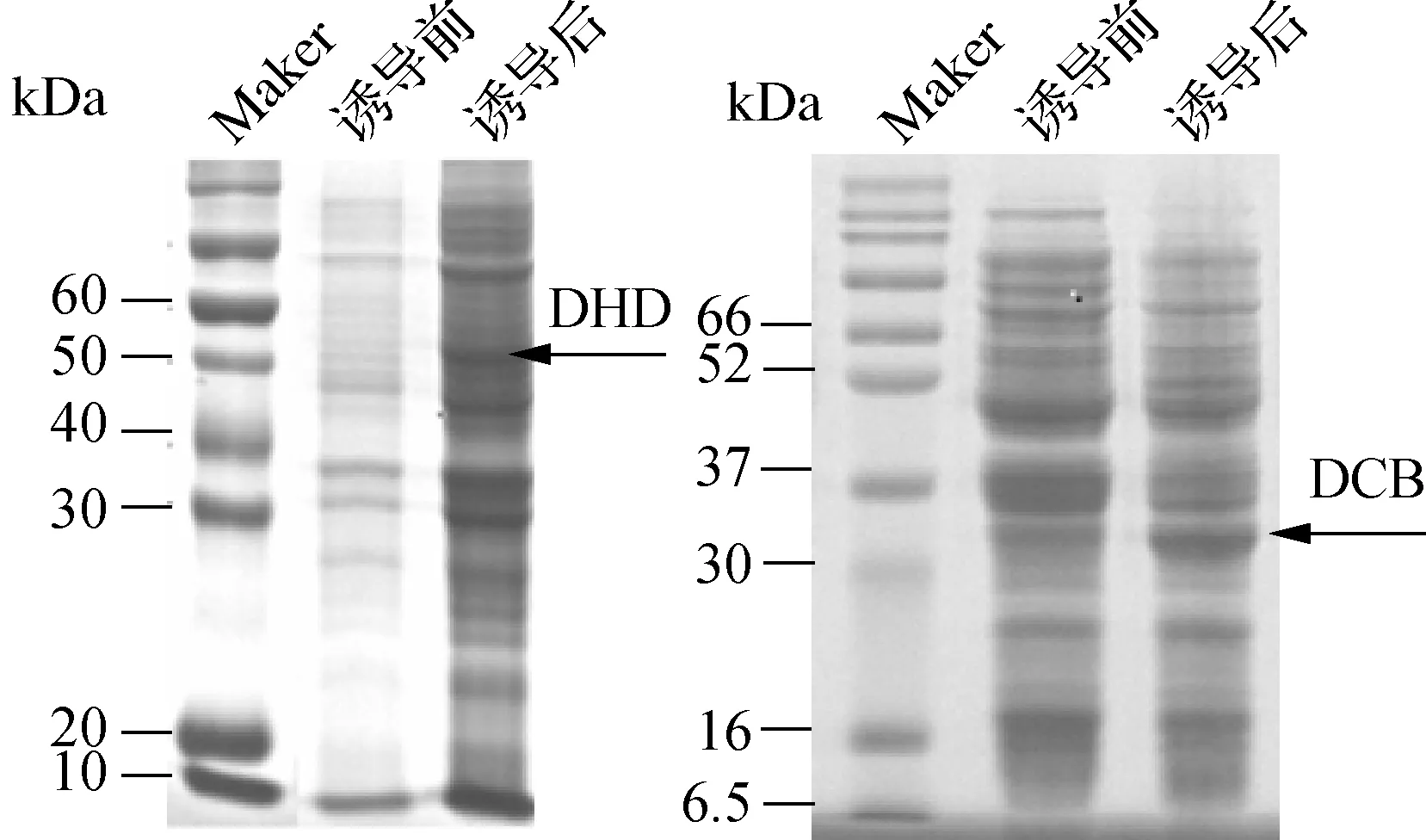
图1 工程菌DHD与DCB蛋白表达
2.2 工程菌DHD与DCB的诱导条件
在蛋白初步表达成功后,为达到最佳的蛋白表达效果,实验对两种工程菌的诱导条件进行了优化。首先是对诱导剂阿拉伯糖浓度进行优化。使用LB培养基分别摇瓶培养重组工程菌,当OD600达到0.8时,分别使用不同终浓度的阿拉伯糖在16 ℃下进行诱导[16-17],实验结果如图2所示。
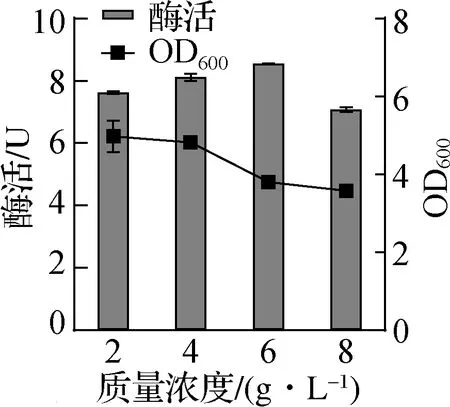
a DHD在不同浓度阿拉伯糖诱导下的OD600与50 mL菌液的酶活
从图2可以看出,在阿拉伯糖的质量浓度为6 g/L时,50 mL菌液的酶活达到最高,当诱导剂质量浓度进一步升高时,酶活水平趋势不变甚至降低。基于工业能耗方面的考虑,选择两种重组菌诱导剂质量浓度为6 g/L。
温度对于菌体生长和活性影响显著,因此对诱导温度进行优化,实验结果如图3所示。两种重组菌在37 ℃时酶活达到最高水平,并且大肠杆菌最佳培养温度在37 ℃,进一步升高温度对大肠杆菌的培养及酶的稳定性具有不利影响,因此选择最佳诱导温度为37 ℃。
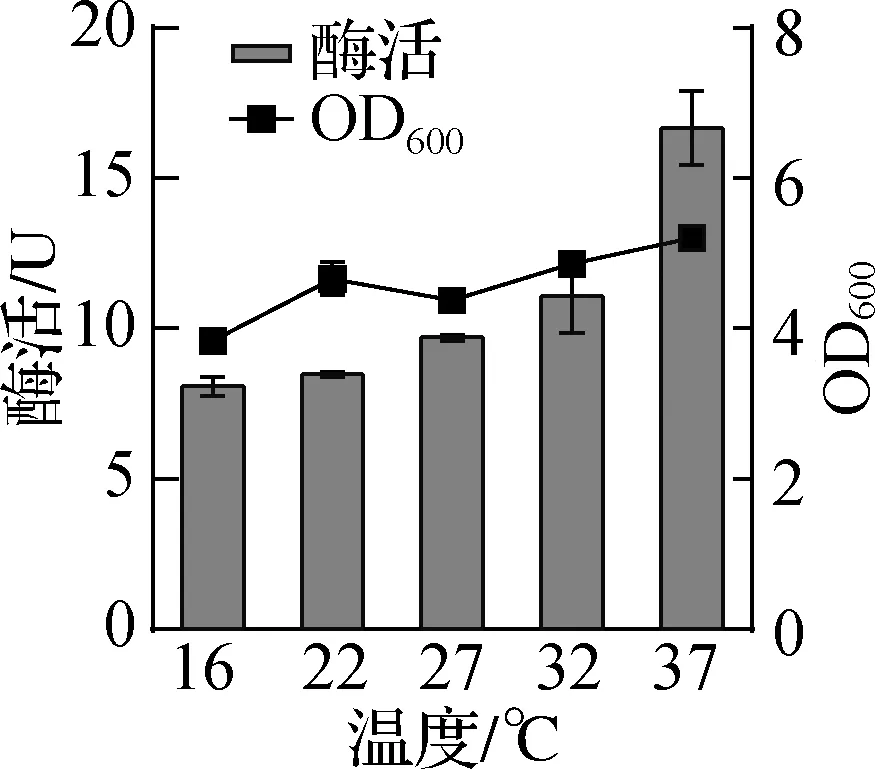
a DHD在不同温度下的OD600与50 mL菌液的酶活
使用六联排发酵罐(6×1 L)进行pH条件的筛选[18]。控制培养过程的pH进行实验,结果见图4。当pH为5和9时,两种酶的总酶活明显低于其他条件,即过酸或过碱的环境对于两种工程菌的培养具有抑制作用。对于DHD而言,pH为6时酶活最高,而DCB在pH为7时表现更为优越。

a DHD在不同pH下的OD600与50 mL菌液的酶活
2.3 工程菌DHD与DCB发酵碳氮源的选择
在包含酵母粉24 g/L,胰蛋白胨12 g/L,K2HPO412.54 g/L,KH2PO42.31 g/L的培养基[19]中加入不同种类的碳源(5 g/L),在37 ℃下培养,并使用终质量浓度6 g/L的阿拉伯糖诱导,实验结果如图5所示。结果表明,以可溶性淀粉为DHD重组菌的碳源时,酶活要明显高于其他种类的碳源,因此优选DHD的碳源为可溶性淀粉;以葡萄糖为DCB重组菌发酵碳源时,无论是菌体密度还是活性都要高于其他种类的碳源,因此优选DCB的碳源为葡萄糖。
固定其他成分,在培养基中加入不同种类的氮源(12 g/L),在37 ℃下培养,并使用终质量浓度6 g/L 阿拉伯糖诱导,实验结果如图5所示。结果表明大豆蛋白胨为两种重组菌氮源时,两种重组菌的酶活性皆优于其他种类的氮源,且大豆蛋白胨具有成本优势,更利于工业化生产,因此优选两种重组菌的氮源为大豆蛋白胨。
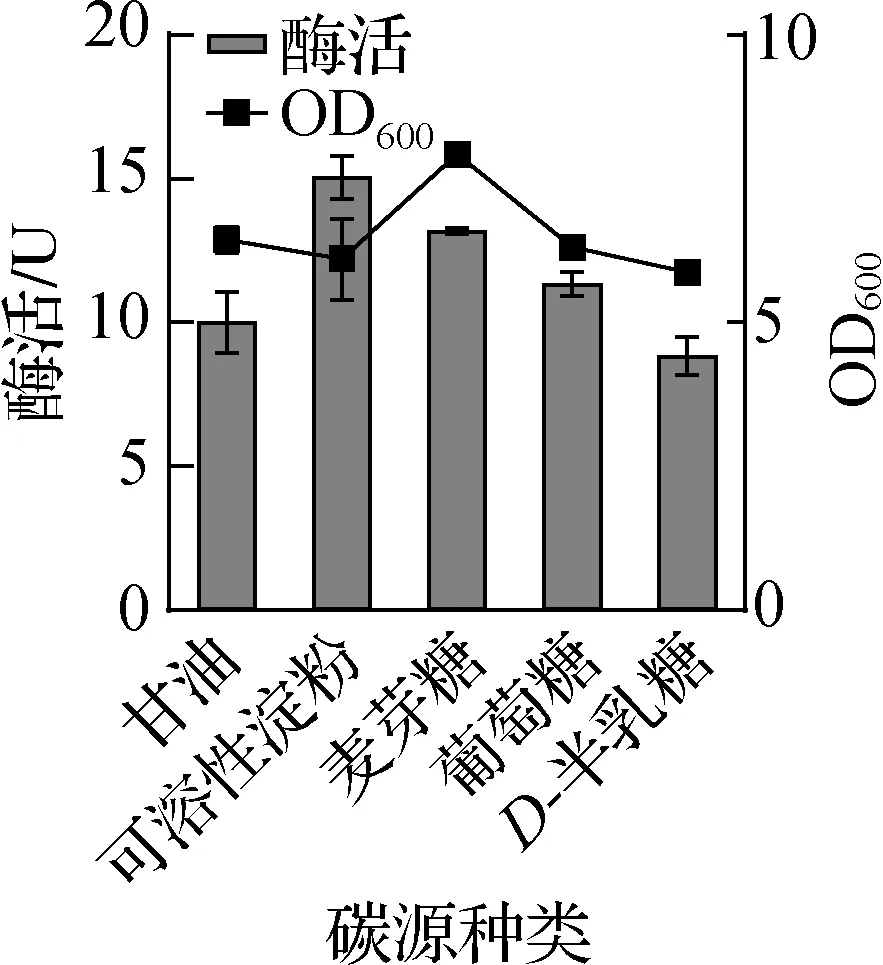
a 不同碳源对DHD的OD600与50 mL菌液酶活的影响
2.4 工程菌DCB的发酵培养基优化
通过上述实验可以看出,所得两种工程菌DHD与DCB的活性较优化前有了显著提高,但催化反应限速酶DCB的表达量达不到预期需求。为提高菌体量,使用响应面法对限速酶DCB的培养基成分进行优化[20]。


表1 Plackett-Burman实验因素水平

表2 Plackett-Burman实验结果

表3 Plackett-Burman实验显著性分析
由结果可知,只有两种为显著因素,因此使用Design Expert 12软件对这两种因素进行二因素五水平的central composite design(CCD)响应面实验设计,以DCB的菌体量为响应值,通过回归拟合及方差分析,得到预测的最佳培养基组分配方。实验的因素、水平设置见表4。

表4 响应面实验因素水平
根据二因素五水平的CCD响应面分析实验设计原则,共设计13组实验,具体实验组及数据见表5。对实验结果进行二阶回归拟合,得到回归方程为
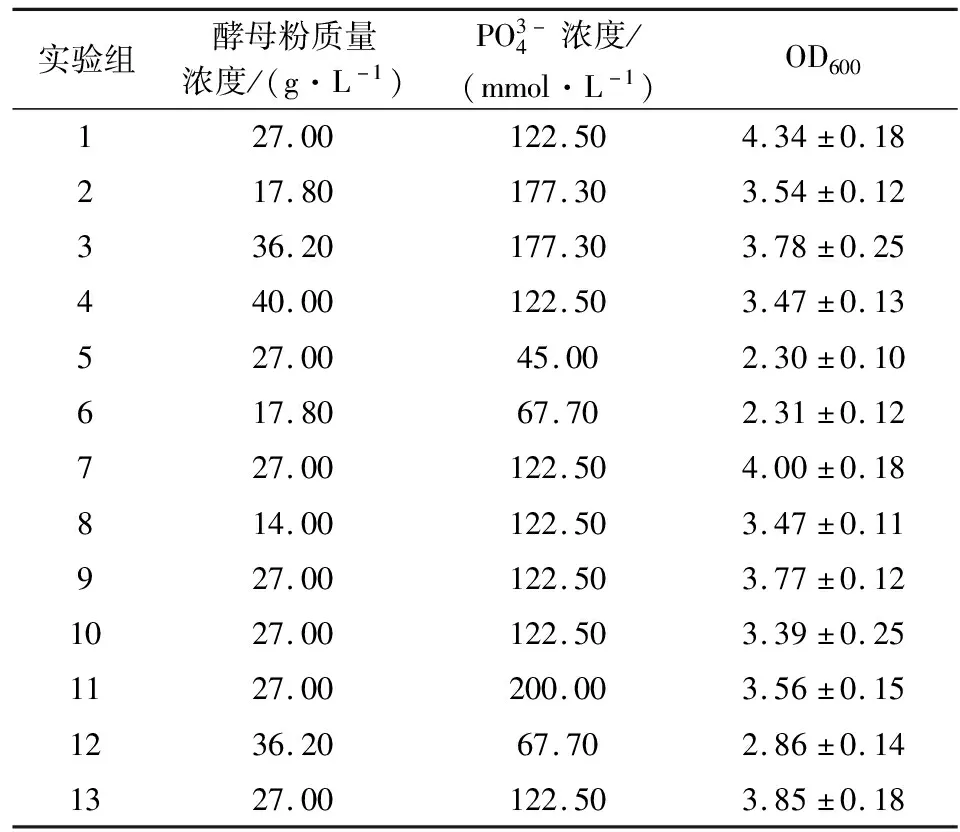
表5 响应面实验结果
Y=0.098 6X1+0.492 2X2-0.080 6X1X2-
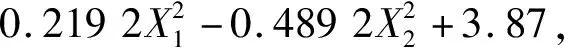
P=0.005 4<0.01。
其中,Y为DCB的OD600值,X1和X2分别为酵母粉和K3PO4浓度在[-α,α]上的比例映射。
由方差分析可知,该模型高度显著,可靠性高。模型存在最优极值条件,摇瓶发酵时,在响应曲面最高点处有OD600极值(见图6),此时最优条件为酵母粉28.24 g/L,K3PO4149.51 mmol/L(即3.88 g/L的KH2PO4与21.07 g/L的K2HPO4)。在最优条件下进行3次平行试验,其结果与模型方程预测结果基本一致,表明该模型方程能很好地预测实际发酵效果。

a 三维图
2.5 工程菌DHD与DCB的5 L发酵罐发酵
基于上述“2.1”“2.2”“2.3”部分的实验结果,在5 L发酵罐中进行DHD发酵验证,发酵培养基配方为:酵母粉24 g/L,大豆蛋白胨12 g/L,可溶性淀粉5 g/L,K2HPO412.54 g/L,KH2PO42.31 g/L。控制溶解氧为30%,发酵pH为6,在37 ℃下进行诱导发酵,分别发酵不同的时长,研究不同发酵时间下菌体生长状态与活性表达情况,结果如图7a所示。DHD工程菌随着发酵时间的增长,其菌体密度随之增长,所以总酶活呈上升趋势;发酵24 h后,随着发酵时间进一步延长,菌体可能出现自溶或死亡,总酶活下降,因此选择最佳发酵时间为24 h。3 L培养基得到了(160.3±2.25)g的DHD菌体,1 L菌液的总酶活为(939.4±4.80)U,为未优化的LB培养基的14.4倍。
基于上述“2.1”“2.2”“2.3”“2.4”部分的实验结果,在5 L发酵罐中进行DCB发酵验证,发酵培养基配方为酵母粉28.24 g/L,大豆蛋白胨12 g/L,葡萄糖5 g/L,K2HPO421.07 g/L,KH2PO43.88 g/L。控制发酵罐中溶解氧为30%,发酵pH为7,在37 ℃下培养至OD600在20左右,加入6 g/L的阿拉伯糖进行诱导,分别发酵不同的时长,研究不同发酵时间下菌体生长状态与活性表达情况,结果如图7b所示。DCB工程菌随着发酵时间的增长,总酶活呈上升趋势,在24 h后,随着发酵时间的延长,总酶活趋于平稳,因此选择最佳发酵时间为24 h。3 L培养基得到了(140.1±2.87)g的DCB 菌体,1 L菌液总酶活为(385.5±3.88)U,为未优化的LB培养基的33.85倍。
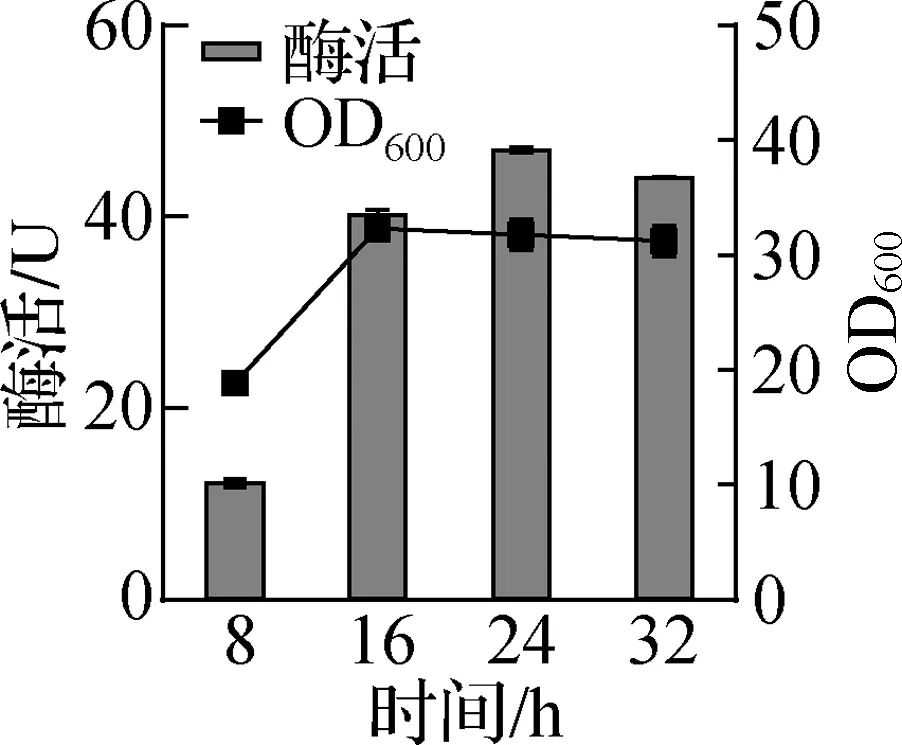
a 对DHD的OD600与50 mL菌液酶活的影响
2.6 催化反应条件的优化
基于两种酶的活性差异,为了提高催化效率,降低工业能耗,需要进一步对催化反应条件进行优化。
因为DHD的酶活性强于DCB,所以首先通过增加反应体系中的DCB含量来对两种酶的投放比例进行初步探索,然后在相同反应条件下,固定上述比例投放不同量的全细胞反应液,研究不同酶量对于反应的影响,结果如图8所示。
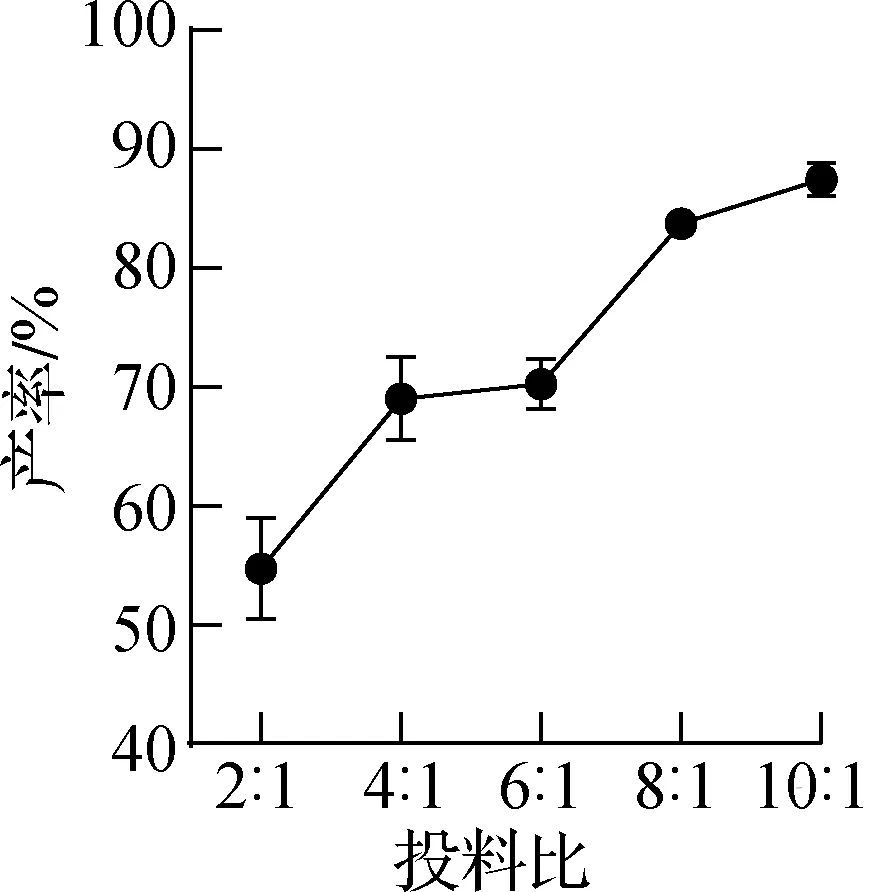
a 投料比例的影响
由图8a可知,随着DCB与DHD投料比的增加,催化效率呈上升趋势。当m(DCB)∶m(DHD)在8∶1之后,产率趋于平稳,最后可以达到90%左右,故确定两种酶的比例m(DCB)∶m(DHD)=8∶1。由图8b可知,在m(DCB)∶m(DHD)=8∶1条件下,随着DCB投放量的增加,催化反应效率呈现上升趋势,而当DCB投放量为1.00%时,产率趋于平缓,可以达到(92.43±3.76)%,因此确定两种酶的添加量为DHD 0.125%(质量分数),DCB 1.00%(质量分数)。
3 结论
虽然目前酶法生产D-对羟基苯甘氨酸已经初步实现了工业化,重组菌的催化活性也能够达到应用要求,但是,重组大肠杆菌在大规模培养方面存在的成本及技术困难,依然制约着其工业应用。针对规模化生产的困境,本研究以合成酶DHD和DCB的重组大肠杆菌为研究对象,进行高密度发酵工艺的初步探索,以期得到规模化的工业用酶。
通过单因素实验筛选了DHD与DCB工程菌的最佳诱导温度、诱导剂浓度、pH及诱导后发酵时间等多个条件,并通过响应面优化得到了限速工程菌DCB的最佳培养基组成为酵母粉28.24 g/L,大豆蛋白胨12 g/L,葡萄糖5 g/L,K2HPO421.07 g/L,KH2PO43.88 g/L。在5 L发酵罐进行验证,结果显示:在碳源为葡萄糖,氮源为大豆蛋白胨,诱导温度为37 ℃,控制发酵体系pH为7,开始发酵16 h,添加终质量浓度为6 g/L的阿拉伯糖诱导24 h时,DCB工程菌的菌体产量为(46.7±0.96)g/L,1 L菌液总酶活(385.5±3.88)U;在碳源为可溶性淀粉,氮源为大豆蛋白胨,诱导温度为37 ℃,控制发酵体系pH为6,开始发酵12 h,添加终质量浓度为6 g/L的阿拉伯糖诱导24 h时,DHD工程菌的菌体产量为(53.4±0.75)g/L,1 L菌液总酶活为(939.4±4.80)U。在投料比为m(DCB)∶m(DHD)=8∶1,DCB的投放量为底物质量的1.00%时,可以达到(92.43±3.76)%的转化效率。
本研究通过重新构建合成酶重组菌,进行高密度发酵工艺的优化,对反应过程中存在的问题进行了探索和解决,降低了工艺成本,为酶法生产D-对羟基苯甘氨酸的大规模工业化提供了理论和技术支撑。
