宫颈上皮内瘤变患者血清和病灶中HLA-E、HLA-G表达与临床病理特征及术后复发的关系分析
2022-06-01黄晨杨悦李红侠
黄晨,杨悦,李红侠
宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)是与宫颈浸润癌发生和进展密切相关的癌前病变,根据病灶浸润范围和异型程度分为CINⅠ~Ⅲ级,其中CINⅠ级可在1~2年内自行消退,CINⅡ~Ⅲ级进展为宫颈癌的概率则分别为5%和12%,因此其早期识别和治疗对预防宫颈癌发生具有重要意义[1]。近年来随着医学水平快速发展,CIN早期筛查工作取得明显进展,同时冷刀锥切术(cold-knife conization,CKC)和宫颈环形电切术(loop electrosurgical excision procedure,LEEP)等微创手术治疗水平也获得明显提升,有效率可超过90%,但术后病灶残留和复发风险仍然较高,且有研究认为复发患者更容易进展为宫颈癌[2-4]。人类白细胞抗原(human leukocyte antigen,HLA)是人体具有高度多态性的同种异体抗原,其中HLA-E和HLA-G均属于非经典型主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类分子,正常情况下表达水平较低,近年来研究表明其在多种肿瘤复发和转移过程中发挥重要作用[5]。本研究主要分析CIN患者血清和肿瘤组织中HLA-E、HLA-G表达水平及其与临床病理特征和术后复发的关系,现将具体结果报道如下。
1 资料与方法
1.1 一般资料
选取2014年5月至2016年5月民航总医院492例CIN患者,纳入标准:① 经宫颈多点病理活检确诊为CIN;② 年龄18~80岁;③ 均接受CKC或LEEP手术且术后随访时间≥1年;④ 患者及家属知晓本研究内容并签署同意书。排除标准:① 合并其它生殖系统疾病;② 合并其它部位恶性肿瘤;③ 入组前已接受放化疗或免疫治疗者;④ 妊娠期或产褥期女性;⑤ 既往接受子宫全切或其它宫颈锥切术治疗。
1.2 研究方法
1.2.1 血清HLA-E和HLA-G水平检测 采集CIN患者入院第1天空腹外周静脉血3 mL并以3 000 r/min离心10 min,取上清-20℃保存备用,采用ELISA法(试剂盒购自武汉华美生物工程有限公司)检测HLA-E和HLA-G水平,所有操作均严格按照说明书要求完成。
1.2.2 CIN病灶HLA-E和HLA-G水平检测 收集CIN患者术后组织标本并以4%甲醛溶液固定48 h,石蜡包埋后制作厚度5 μm连续切片,采用二甲苯脱蜡后置于PBS缓冲液中温育4~8 h,然后采用无水乙醇、95%和50%浓度乙醇按梯度脱水,柠檬酸盐修复并充分暴露抗原决定簇,3%双氧水室温浸泡10 min进行封闭,然后分别加入鼠抗人HLA-E单克隆抗体和鼠抗人HLA-G单克隆抗体(北京奥维亚生物技术有限公司)并于4℃条件孵育过夜,第2天冲洗干净后加入通用型二抗试剂盒(美国Abcam公司)并室温孵育30 min后采用DAB试剂盒(上海长岛试剂公司)显色,2~5 min后终止反应,苏木素复染1.5~2.0 min,然后以梯度乙醇脱水,中性树胶封片,以PBS缓冲液代替HLA-E和HLA-G一抗进行苏木素复染为阴性对照,观察胞质HLA-E和HLA-G表达情况,根据荧光强度计算HLA-E和HLA-G相对表达量。
1.2.3 人乳头瘤病毒检测和分型 分别取CIN病理标本研碎以1.5 mL离心管保存,加入裂解液150 μL并以12 000 r/min离心5 min,去除上清液,加入DNA提取液50 μL,充分震荡混匀后加热至100℃,10 min后以13 000 r/min离心10 min,取中间层DNA溶液进行PCR反应,采用人乳头瘤病毒(human papillomavirus ,HPV)分型试剂盒(深圳亚能生物技术有限责任公司)进行检测,该试剂盒可同时检测28种亚型,包括23种高危型和5种低危型,测量样本相对发光单位(RLU)和标准阳性对照组临界值(CO),计算RLU/CO比值并以其值≥1为阳性。
1.2.4 患者信息采集和分析 患者入院后详细采集基本资料、病史和婚育史,完善相关检查,明确诊断并评估CIN分级,然后结合患者基础健康水平和自身意愿进行CKC或LEEP手术,术后门诊随访至少1年,1年内每3个月1次,1年后每6个月1次,复查时完成阴道镜、宫颈细胞学和HPV检测,以术后6个月内发现宫颈CIN为病灶残留,6个月后发现宫颈CIN为复发,随访期间连续两次检测宫颈细胞学均无明显异常为无残留或复发。
1.3 统计学方法

2 结果
2.1 CIN患者血清HLA-E和HLA-G水平与临床病理特征的关系
CIN患者血清HLA-E和HLA-G水平随CIN分级增加和高危HPV感染转阳明显升高(P<0.05),年龄、孕次和产次等其他临床病理资料不同的患者血清HLA-E和HLA-G水平比较,差异无统计学意义(P>0.05),详见表1。
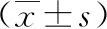
表1 CIN患者血清HLA-E和HLA-G水平与临床病理特征的关系
2.2 CIN患者病灶HLA-E和HLA-G水平与临床病理特征的关系
CIN患者病灶中HLA-E和HLA-G水平随CIN分级增加和高危HPV感染转阳明显升高(P<0.05),年龄、孕次和产次等其他临床病理资料不同的患者病灶中HLA-E和HLA-G水平比较,差异无统计学意义(P>0.05),详见表2。
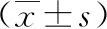
表2 CIN患者病灶HLA-E和HLA-G水平与临床病理特征的关系
2.3 CIN患者血清和病灶HLA-E和HLA-G水平与术后复发的关系
本研究中位随访时间为54(18~72)个月,结果显示492例CIN患者术后复发37例(7.52%),复发组血清和病灶HLA-E和HLA-G水平高于非复发组,差异有统计学意义(P<0.05),详见下页表3。
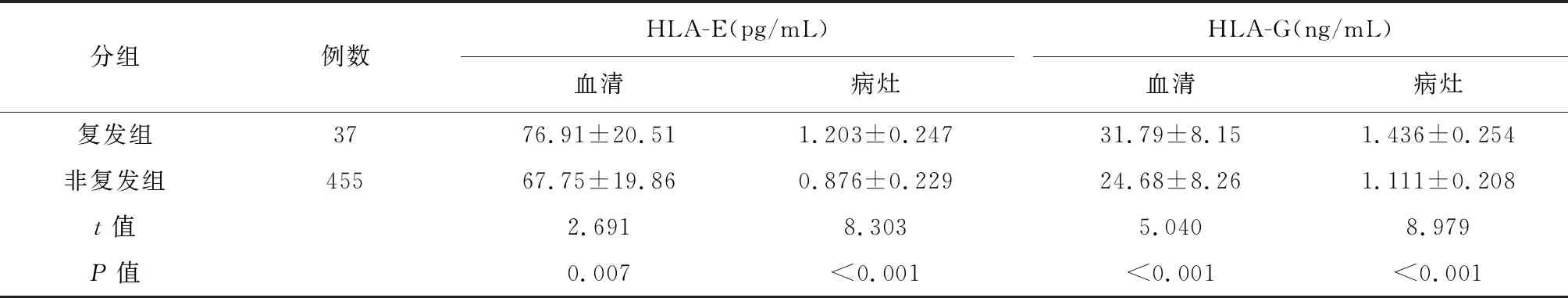
表3 CIN患者血清和病灶HLA-E和HLA-G水平与术后复发的关系
2.4 血清和病灶HLA-E和HLA-G水平对CIN术后复发的预测价值分析
血清HLA-E、HLA-G水平及两者联合检测预测CIN术后复发的AUC分别为0.690、0.709和0.865,病灶HLA-E、HLA-G水平及两者联合检测预测CIN术后复发的AUC分别为0.849、0.891和0.906,详见下页表4、图1(见彩插3)。
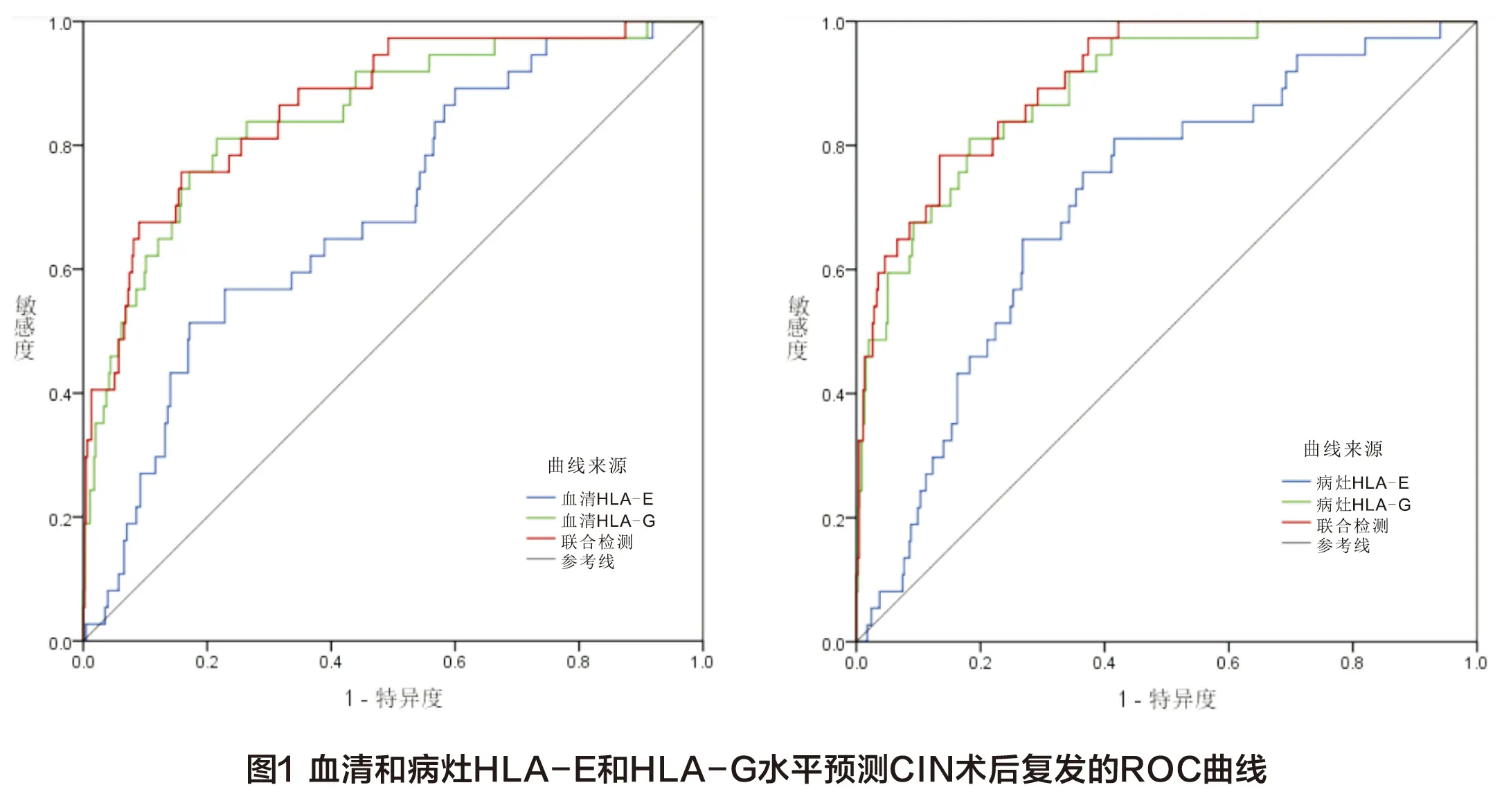
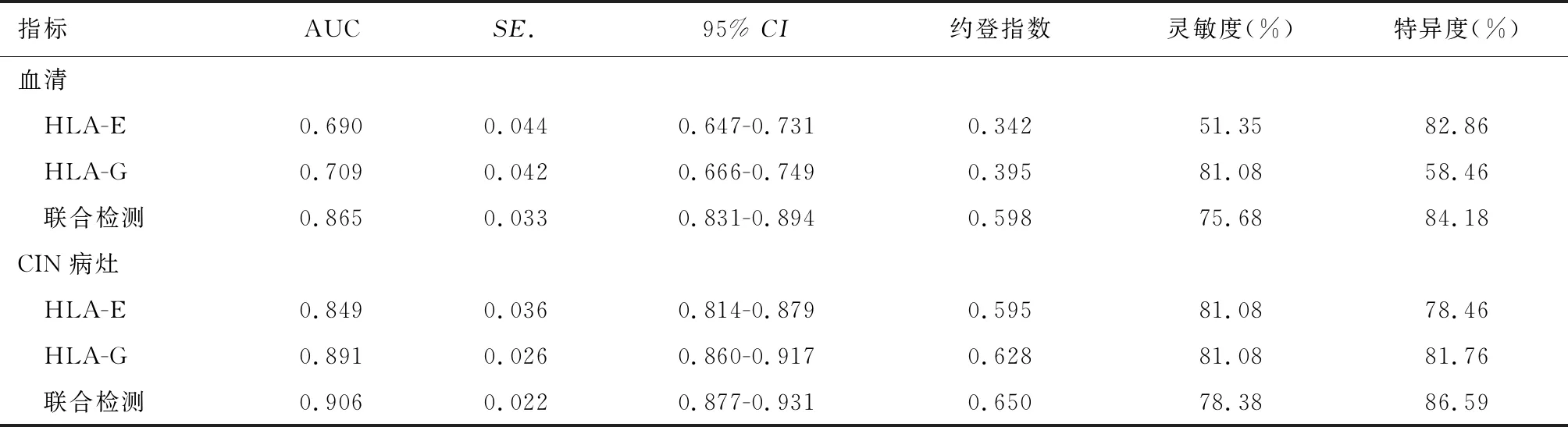
表4 血清和病灶HLA-E和HLA-G水平对CIN术后复发的预测价值分析
3 讨论
宫颈癌是女性发病率仅次于乳腺癌的恶性肿瘤,统计显示全球每年新增患者约53万,同时约27.5万患者因此死亡,在女性癌因性死亡中占比为9%[6]。宫颈癌80%分布于发展中国家,其中我国患病率和死亡率均居于世界前列,且近年来发病率逐渐升高并趋于年轻化[7]。近年来研究表明宫颈癌发生和进展是一个复杂的渐变性过程,癌前病变主要表现为CIN,因此对CIN进行准确诊断和治疗是预防宫颈癌的有效方法,目前主要依据细胞形态学筛查和病理学检查对CIN进行诊断,主观性较强且可重复性偏低,故积极寻找更为准确、安全和易行的实验室检测指标具有重要意义[8]。
机体免疫功能异常与多种恶性肿瘤密切相关,其中HLA-E和HLA-G在介导免疫耐受过程中发挥关键作用,正常情况下与抑制型受体CD94/NKG2A的亲和力较激活型受体CD94/NKG2C更强,因此有利于靶细胞免除自然杀伤细胞的杀伤作用,对维持免疫功能稳定和机体正常生理功能具有重要意义[9]。文献报道HLA-E和HLA-G异常表达对自然杀伤细胞、B细胞以及T细胞的影响大致相近,均可与细胞表面受体结合而造成免疫抑制,且两者还可产生协同作用,从而导致肿瘤细胞免疫逃逸,此外可溶性HLA-E和HLA-G还可经外周血循环作用于全身各组织器官并引起免疫抑制[10-12]。近年来研究表明卵巢癌[13]、口腔癌[14]和宫颈癌[15]等恶性肿瘤患者血清HLA-E和HLA-G水平明显升高,提示HLA-E和HLA-G对免疫功能的负性调控机制可参与多种恶性肿瘤发生和进展过程。CIN为宫颈癌前病变,张莉等[16]报道显示宫颈组织中HLA-E和HLA-G表达水平随宫颈癌病变程度增加而升高,且可与HPV感染共同作用,参与宫颈癌发生和进展。本研究分析CIN患者血清和病灶中HLA-E和HLA-G表达水平,结果显示均随CIN分级增加和高危HPV感染明显升高,表明两者均可能参与CIN发病,其作用机制与启动CD8+T细胞下游信号并抑制免疫细胞活化有关,同时本研究中CIN患者外周血HLA-E和HLA-G表达水平与病灶组织具有一致性,因此通过检测血清HLA-E和HLA-G即可为判断CIN病情严重程度提供参考信息。
HPV感染是宫颈癌重要危险因素,目前已发现100多种HPV亚型,且可致病者达30种以上,其中高危型HPV可将自身DNA整合到宿主基因组中并导致细胞遗传稳定性明显下降,发生癌变风险大幅度增加[17]。张倩等[18]开展的一项包含1997例35~45岁女性的宫颈癌筛查队列调查显示高危型HPV感染者发生中度及以上CIN的风险明显升高。本研究492例CIN患者中合并高危型HPV感染者319例,合并高危型HPV感染者血清和病灶HLA-E和HLA-G表达水平明显升高。Swets等[19]研究认为HPV E6蛋白可与p53结合并抑制肿瘤细胞凋亡,同时p53又可参与调节HLA-G表达,从而参与肿瘤发生和进展。Tawfeek等[20]等报道显示HLA-E可促进核因子-κB(NF-κB)靶基因cIAP1和cIAP2表达,HPV18 E6可参与调节NF-κB磷酸化,从而产生抗凋亡作用,可见高危型HPV感染与HLA-E和HLA-G在CIN和宫颈癌的发病中的作用机制具有相同之处。
CIN术后容易复发,且复发患者进展为宫颈癌的风险明显升高,既往研究表明其危险因素包括病理分级、持续HPV感染及腺体受累等[21]。本研究492例CIN患者中位随访时间为54(18~72)个月,结果显示术后复发37例(7.52%),且复发组血清和病灶HLA-E和HLA-G水平高于非复发组,提示HLA-E和HLA-G表达水平较高的患者术后复发风险更高,其原因可能与机体免疫抑制状态有关,因此检测HLA-E和HLA-G可为评估CIN术后复发风险提供参考信息,从而有利于临床采取合理治疗策略。本研究结果显示血清HLA-E、HLA-G水平预测CIN术后复发的AUC分别为0.690和0.709和0.865,相较CIN病灶HLA-E和HLA-G预测价值偏低,可能是因为部分CIN患者HLA-E和HLA-G在外周血与病灶中表达水平不完全一致,但两者联合检测AUC达0.865,敏感度和特异度分别为75.68%和84.18%,与病灶HLA-E和HLA-G联合预测价值相近,表明通过检测血清HLA-E和HLA-G水平来预测CIN术后复发风险具有良好可行性,且该方法简便易行,安全无创,尤其适用于术后长期随访。
综上所述,CIN患者血清和病灶HLA-E和HLA-G表达水平均与CIN分级、高危型HPV感染和术后复发存在密切联系,且检测血清HLA-E和HLA-G能为预测CIN术后复发风险提供参考信息。
