马齿苋多糖对LPS诱导小鼠急性肺损伤的实验研究
2022-06-01黄小强祝丹江王鲁豫陈雨田孙嘉宁黄涛贾安
黄小强 祝丹江 王鲁豫 陈雨田 孙嘉宁 黄涛 贾安


【摘 要】 目的:研究馬齿苋多糖对脂多糖(LPS)诱导小鼠急性肺损伤(ALI)的影响。方法:将60只体重为18~20 g昆明种小鼠随机分6组。分别为正常组,LPS组,醋酸地塞米松组[0.005 g/(kg·d)],马齿苋多糖低、中、高剂量组[1.5、3、6 g/kg/d,生药量],每组10只,先连续灌胃给药14 d,每天1次,第14天给药2 h后,利用LPS建立小鼠ALI动物模型,除正常组小鼠气管滴注等量生理盐水外,其他各组滴注LPS(10 mg/kg)溶液,12 h后酶联免疫吸附剂法测定血清中肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)和白介素6(IL-6)含量以及肺组织中髓过氧化物酶(MPO)活性,计算肺组织湿/干重(W/D)值,并进行肺组织病理切片检查。结果:与正常组比较,LPS组中W/D值,TNF-α和IL-1β含量及MPO活性均显著性升高(P<0.05或0.01);与LPS组比较,醋酸地塞米松组、马齿苋多糖中剂量和高剂量组中W/D值,TNF-α和IL-1β含量及MPO活性、肺损伤评分均显著降低(P<0.05或0.01)。结论:马齿苋多糖具有一定的保护ALI作用,其机制可能与抑制体内炎性介质释放有关。
【关键词】 马齿苋多糖;脂多糖;急性肺损伤;小鼠
【中图分类号】R285.5 【文献标志码】 A 【文章编号】1007-8517(2022)06-0035-05
Experimental Study of Purslane Polysaccharide on LPS-induced Acute Lung Injury in Mice
HUANG Xiaoqiang ZHU Danjiang WANG Luyu CHEN Yutian SUN Jianing HUANG Tao JIA An*
Medical School, Huanghe Science & Technology College, Zhengzhou 450063, China
Abstract:Objective To investigate the effects of Purslane Polysaccharide on lipopolysaccharide induced ALI in mice. Methods Sixty KM mice weighing 18-20 g were randomly divided into 6 groups: Normal group, LPS group, Dexamethasone group (0.005 g/kg/d), Purslane Polysaccharide low-dose, medium-dose and high-dose groups (1.5, 3, 6 g/kg/d ), with 10 mice in each group, First continuous gavage for 14 days, once a day. 2 hours after the last administration, On the 14th day, 2 hour after administration, LPS was used to establish ALI animal model, Except for the normal group, the mice were injected with the same amount of normal saline in the trachea, and the other groups were injected with LPS (10 mg/kg) solution. After 12 hours, the levels of TNF-α, IL-1β and IL-6 in serum and the activity of myeloperoxidase (MPO) in lung tissue were measured, and pathological examination of lung tissue was performed. Results Compared with the normal group, The contents of W/D, TNF-α, IL-1β and MPO activity in LPS group were significantly increased (P<0.05, P<0.01); Compared with LPS group, W/D value, contents of TNF - α and IL-1 β, MPO activity and lung injury score in dexamethasone acetate group, Purslane Polysaccharide medium dose group and high dose group were significantly decreased (P<0.05,P< 0.01). Conclusion Purslane Polysaccharide can protect the acute lung injury induced by lipopolysaccharide in mice, and its mechanism may be related to inhibiting the release of inflammatory mediators in the body.
Key words:Purslane Polysaccharide; Lipopolysaccharide; Acute Lung Injury; Mice3279B876-4376-42C3-901C-A70546950AAD
急性肺損伤(Acute lung injury,ALI)是急诊科室中最常见的危重病之一,它的特点是肺泡上皮细胞及毛细血管内皮细胞损伤,造成弥漫性肺间质及肺泡水肿,同时伴随蛋白质的渗出、大量炎症介质及因子的释放[1]。炎症细胞因子和相关介质伴随ALI的发生与发展全过程,例如TNF-α、IL-6、IL-1β、iNOS和NO等[2]。ALI在临床上具有较高的死亡率和发病率,其死亡率然高达40%~60%[3]。马齿苋为马齿苋科植物马齿苋(Portulaca oleracea L.)的干燥地上部分,全国绝大地区均有分布,中国药典(2020版)记载具有清热解毒、凉血止血、止痢的功效[4];由于富含多种营养成分,其中以维生素及ω-3脂肪酸最为突出,因此马齿苋也是一种营养价值较高的食物[5]。国内外学者研究[6-8]发现马齿苋的主要化学成分包括:多糖类、黄酮类、生物碱类、有机酚酸类等,同时药理学研究[9-12]发现,马齿苋多糖具有一定程度地降低炎症因子和护肝等作用。为了探讨马齿苋多糖是否对ALI的保护作用,本研究应用马齿苋多糖对LPS诱导ALI小鼠模型开展相关研究。为马齿苋今后进一步深入开发和临床应用提供一定参考。
1 材料与仪器
1.1 试药 马齿苋(张仲景大药房);脂多糖(美国Sigma公司);醋酸地塞米松片(遂成药业股份有限公司);肿瘤坏死因子ɑ(TNF-α)、白介素1β(IL-1β)和白介素6(IL-6)ELISA检测试剂盒(上海西塘生物科技有限公司);髓过氧化物酶(MPO)活性检测试剂盒(南京建成生物工程研究所)。
1.2 动物 60只清洁级KM雄性小鼠,体重18~20 g,由黄河科技学院医学院实验动物中心提供,动物房光照条件12 h/d,温度20~23 ℃,相对湿度40%~60%,小鼠适应性饲养7 d后用于实验。
1.3 仪器 多功能酶标仪(奥地利,Infinite公司);高速台式冷冻离心机(美国,赛默飞世尔科技有限公司);FY135型中草药粉碎机(天津市泰斯特仪器有限公司);DHP-9052电热恒温培养箱(上海-恒科技有限公司);BS-3000A系列电子天平(上海友声衡器有限公司);光学显微镜(日本,OLYMPUS);RM2125型石蜡切片机(德国,Leica公司)。
2 方法
2.1 药物制备
2.1.1 马齿苋多糖的制备[13-14] 将马齿苋粗粉,过10目筛,称取500 g,加入4倍量无水乙醇浸泡24 h,抽滤,60 ℃烘干药渣,然后加入10倍量的蒸馏水,置于80 ℃水浴锅中温浸2 h,温浸提取2次,合并2次滤液,利用旋转蒸发仪减压浓缩至200 mL,然后加入800 mL无水乙醇至80%,剧烈摇匀,4 ℃低温静置分层,抽滤,收集沉淀,即为马齿苋粗多糖。沉淀完全溶于蒸馏水后加入适量活性炭进行脱色,抽滤,再加入少量Sevage试剂,充分震荡,静置分层,收集上清液,减压浓缩,并真空冷冻干燥,得马齿苋多糖,-20 ℃低温保存备用。采用硫酸-苯酚法对马齿苋多糖含量进行测定[15],其工作曲线为C=3.6311A+0.0023,R2=0.9991,测定马齿苋多糖含量为62.22%
2.1.2 醋酸地塞米松溶液的制备 取适量将醋酸地塞米松片置于研钵中,充分研磨,用生理盐水配制成浓度为0.0005 g/mL的溶液,备用。
2.2 分组、造模与给药 将60只清洁级KM小鼠适应性饲养7 d后,随机分为6组:正常组,LPS型组,醋酸地塞米松组(0.005 g/kg·d),马齿苋多糖低、中、高剂量组(1.5、3、6 g/kg/d,生药材),每组10只,按10 mL/kg体重灌胃给药,每天给药1次,连续给药14 d,除正常组和LPS组小鼠给予等量常温生理盐水,其他各组给予相应体积的药物。末次给药后2 h,采用鼻腔滴注法慢慢滴注LPS生理盐水溶液(0.5 mL/kg),正常组按照相同的方法给予相应体积的生理盐水[16]。建立模型[17]后小鼠禁食不禁水12 h,采用眼眶取血,随后脱臼处死,并迅速取出肺组织,备用。
2.3 肺组织W/D值计算[18] 取小鼠右肺上叶,剔除肺组织上面结缔组织,同时利用滤纸吸尽组织表面水分和血液,并称量记录为肺组织湿重;随后将肺组织放置于温度为80 ℃干燥箱中连续干燥48 h后,称量记录为肺组织干重,计算(W/D)。
2.4 肺组织中MPO活性测定 取适量小鼠肺组织置于组织匀浆器中,按试剂盒说明书操作制备成5%的肺组织匀浆液,并检测MPO活性。
2.5 血清中TNF-α、IL-6、IL-1β含量测定 取血后,在低温条件下4000 r/min离心10 min分离血清,取上清;按照试剂盒说明书步骤,采用酶联免疫吸附剂法测定各组血清中TNF-α、IL-6、IL-1β的含量。
2.6 肺组织病理学检查 切下右肺组织下叶经4%多聚甲醛溶液固定24 h后,用蒸馏水冲洗至无多聚甲醛味;然后进行常规的石蜡包埋,切片厚度5 μm。进行切片脱蜡、苏木素-伊红染色、封片。在光学显微镜下进行病理学观察分析,根据肺泡壁厚度、肺组织破坏和炎症细胞浸润情况进行评分[19]。评分标准:0分=最小损伤;1分=轻度损伤;2分=中度损伤;3分=重度损伤;4分=最大损伤。肺损伤评分为3个指标评得分之总和。
2.7 统计学方法 本实验结果采用SPSS 22.0软件进行统计处理分析,计量资料均以均数加减标准差(x±s)表示,组间比较采用单因素方差分析,P<0.05为差异具有统计学意义。
3 结果
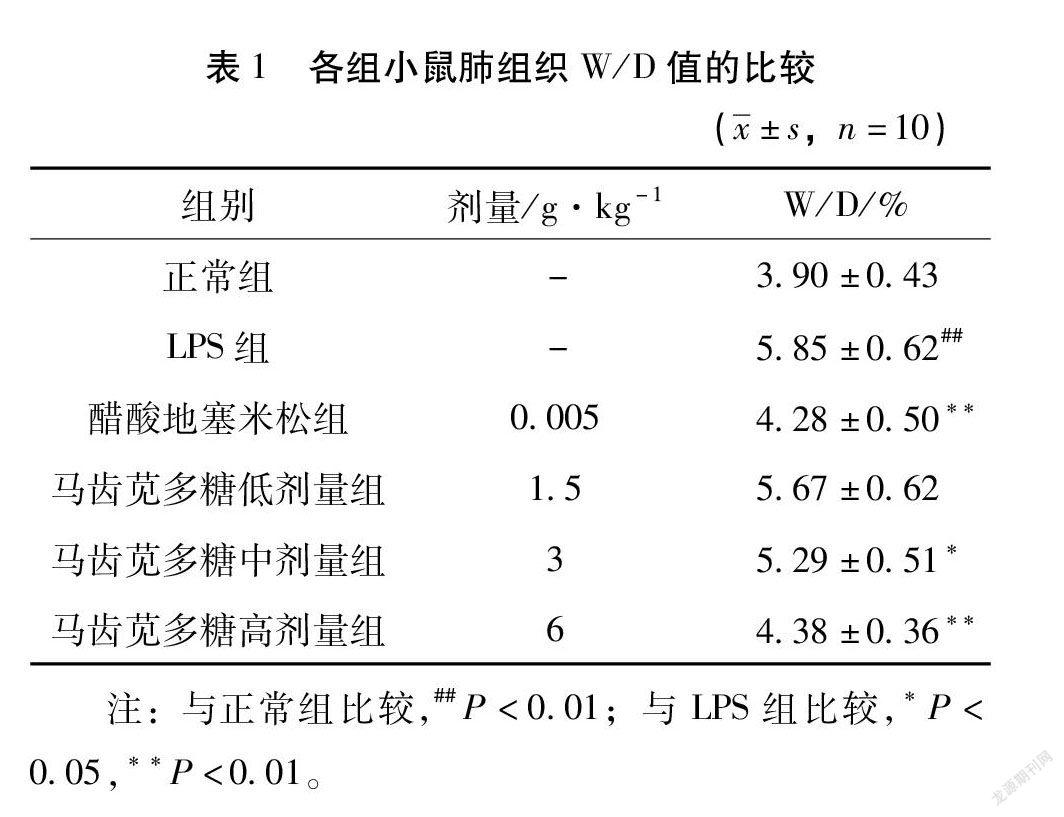
3.1 马齿苋多糖对肺组织W/D值的影响 与正常组比较,LPS组小鼠肺组织W/B值显著性升高(P<0.01)。与LPS组比较,经过马齿苋多糖干预后各剂量组小鼠W/B值均有不同程度降低,其中中剂量和高剂量组均具有统计学差异(P<0.05或0.01)。见表1。3279B876-4376-42C3-901C-A70546950AAD
3.2 马齿苋多糖对肺组织中MPO活性的影响 与正常组比较,LPS组小鼠肺组织中MPO活性显著性升高(P<0.01)。与LPS 组比较,经过马齿苋多糖干预后各剂量组小鼠MPO活性均有不同程度降低,其中中剂量和高剂量组均具有统计学差异(P<0.05或<0.01)。见表2。
3.3 马齿苋多糖对血清中TNF-α、IL-6、IL-1β含量影响 与正常组比较,LPS组小鼠血清中TNF-α、IL-1β和IL-6含量均显著性升高(P<0.01)。与LPS组比较,经过马齿苋多糖干预后各剂量组小鼠血清中TNF-α、IL-1β和IL-6含量均有不同程度降低,其中中剂量和高剂量组均具有统计学差异(P<0.05或P<0.01)。见表3。
3.4 马齿苋多糖对肺组织病理形态学的影响 正常组小鼠肺组织的结构清晰、无渗出液,同时也没有出现水肿及炎细胞浸润等现象。LPS组小鼠的肺组织出现明显的炎性浸润,肺泡间隔增厚及间质水肿等较为严重的病理损伤现象,与正常组比较,LPS组小鼠肺损伤评分显著性升高(P<0.01)。与LPS组比较,经过马齿苋多糖干预后各剂量组小鼠肺组织损伤均有不同程度的改善,同时肺损伤评分也有不同程度降低。如图1所示。
4 讨论
该研究通过鼻腔滴注LPS溶液建立ALI小鼠动物模型。在滴注LPS后2~4 h内可诱发ALI,在24~48 h内便可造成最大肺损伤[20],该种方法可有效避免由于皮下注射LPS溶液引起的全身炎症反应和脏器官衰竭[21]。革兰阴性菌感染导致的肺炎是ALI最常见的诱导因素之一,由于LPS刺激巨噬细胞,从而导致机体大量释放TNF-α、IL-1β、IL-6等炎症因子,进一步引发急性炎症反应[22]。目前国内外关于ALI的致病机制尚不明确,有学者[23]认为,ALI发生的主要原因是体内促炎和抗炎系统失衡。研究结果发现马齿苋多糖能够显著性降低TNF-α、IL-1β和IL-6炎症细胞含量,提示马齿苋多糖对LPS诱导的ALI作用与其抑制炎症因子分泌有关。
肺组织的W/D值大小在一定程度上反映了水肿的程度[24],肺水肿程度与W/D值密切相关,W/D值越大则肺水肿程度越大,研究结果发现马齿苋多糖能够显著降低W/D值,从而缓解LPS所诱导的ALI。肺组织病理学观察发现LPS组小鼠肺组织损伤严重,通过马齿苋多糖干预后上述病理变化明显得到减轻。
综上,本研究结果显示:马齿苋多糖能够降低肺组织W/D值和肺组织中MPO活性,同时降低血清中TNF-α、IL-1β和IL-6炎症因子含量,提示马齿苋多糖对LPS所致的ALI具有一定的保护作用,其作用机制与抑制炎症因子分泌有关。
参考文献
[1]MARKUS B, WARD P A . Protein-based therapies for acute lung injury: targeting neutrophil extracellular traps[J]. Expert opinion on therapeutic targets, 2014,18(6):703-714.
[2]ASCHNER Y, ZEMANS R L, YAMASHITA C M, et al. Matrix Metalloproteinases and Protein Tyrosine Kinases: Potential Novel Targets in Acute Lung Injury and ARDS[J]. Chest, 2014, 146(4):1081-1091.
[3]卢悦,张平平,王东强,等.急性肺损伤中医病因病机的探讨[J].中国中医急症,2020,29(2):280-282.
[4]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2020:51.
[5]ALAM M A, JURAIMI A S, RAFII M Y, et al. Genetic improvement of Purslane (Portulaca oleracea L.) and its future prospects[J]. Molecular Biology Reports, 2014,41(11):7395-7411.
[6]李海涛,葛翎,段国梅,等.马齿苋的化学成分及药理活性研究进展[J].中国野生植物资源,2020,39(6):43-47.
[7]王文举,孔莹.马齿苋化学成分研究[J].辽宁师范大学学报(自然科学版),2016,39(4):517-521.
[8]姚佳琪, 孟娜, 宋少江,等.马齿苋的化学成分[J].沈阳药科大学学报, 2007 (12) :751-753.
[9]赵蕊,吴桐,陈昭,等.马齿苋多糖对小鼠抗炎及镇痛作用的实验研究[J].黑龙江八一农垦大学学报,2017,29(5):28-32.
[10]欧海玲,张秀玲,孙平良,等.马齿苋多糖对胃癌SGC7901细胞增殖和凋亡的影响[J].中国癌症防治杂志,2020,12(4):431-434.
[11]黄小强,丁辉,刘顺和,等.马齿苋多糖對四氯化碳诱导的小鼠急性肝损伤的保护作用[J].食品工业科技,2020,41(23):315-319,324.
[12]梁彦,张传军,吕艳荣.马齿苋多糖对高脂饮食联合链脲佐菌素诱导的糖尿病小鼠的作用及机制[J].食品科学,2014,35(3):217-220.
[13]赵二劳,刘乐,杨洁,等.菜籽粕多糖提取纯化及其功能活性研究进展[J].食品研究与开发,2020,41(16):214-219.3279B876-4376-42C3-901C-A70546950AAD
[14]杨金磊.马齿苋多糖的分离纯化及结构分析[D].长春:东北师范大学,2019.
[15]陈红惠, 牛念拉姆. 底圩茶多糖的超声波辅助提取及其抗氧化活性[J]. 食品工业科技, 2020, 41(21):187-192.
[16]JIANG K F, ZHANG T, YIN N N, et al. Geraniol alleviates LPS-induced acute lung injury in mice via inhibiting inflammation and apoptosis[J]. Oncotarget, 2017, 8(41):71038-71053.
[17]曹志敏,唐明美,文强,等. 内毒素所致急性肺损伤动物模型的研究进展[J]. 实验动物科学, 2017, 1(34):66-69,74.
[18]王林,李红波,刘南,等.和厚朴酚对脂多糖诱导的急性肺损伤小鼠的保护作用[J].中药新药与临床药理, 2016, 27(6):810-815.
[19]LIU T, ZHOU Y, LI P, et al. Blocking triggering receptor expressed on myeloid cells-1 attenuates lipopolysaccharide-induced acute lung injury via inhibiting NLRP3 inflammasome activation[J]. Scientific reports, 2016, 6(1):39473-39480.
[20] CHEN H, BAI C, WANG X . The value of the lipopolysaccharide-induced acute lung injury model in respiratory medicine.[J]. Expert Rev Respir Med, 2010, 4(6):773-783.
[21]褚纯隽,任慧玲,李显伦,等.野马追提取物对脂多糖诱导小鼠急性肺损伤的保护作用[J].華西药学杂志, 2015, 30(6):653-656.
[22]郭苏兰,李佳娜,肖水秀.阿里红多糖对用脂多糖诱导的急性肺损伤小鼠肺组织的保护作用及相关机制[J].当代医药论丛, 2019,17(10):127-130.
[23]肖归,陈广文,李涛,等.HSF1通过抑制中性粒细胞浸润减轻LPS诱导的小鼠急性肺损伤[J].中国病理生理杂志,2022,38(1):26-32.
[24]洪辉华,蔡宛如.急性肺损伤的发病机制及中医药治疗的实验研究进展[J].浙江中医药大学学报,2007,31(1):133-135.
(收稿日期:2021-08-06 编辑:陶希睿)3279B876-4376-42C3-901C-A70546950AAD
