基于网络药理学探讨地榆抗菌活性成分研究及初步实验验证
2022-05-30朱洁张斌王英英陈勇褚以文倪彩霞
朱洁 张斌 王英英 陈勇 褚以文 倪彩霞
摘要:目的 采用網络药理学方法探讨地榆抗菌活性成分,并结合抗菌药效学实验进行验证。方法 基于TCMSP数据库获取地榆化学成分及其对应靶点,通过Gene cards和OMIM数据库获取细菌感染靶点。通过Cytoscape构建药物-疾病-靶点网络图,利用STRING数据库构建蛋白互作网络,采用DAVID数据库开展预测靶点的GO和KEGG分析。采用琼脂二倍稀释法对预测的活性成分进行体外最低抑菌浓度(MIC)测定,进一步利用临床分离菌耐甲氧西林金黄色葡萄球菌(MRSA)和铜绿假单胞菌(Pseudomonas aeruginosa, PA)建立秀丽隐杆线虫感染和药物救治模型,观察线虫的存活情况,计算存活率。结果 共筛选出8个潜在活性成分,其中山奈酚和槲皮素Degree值高于平均Degree值,得到17个关键靶点;GO和KEGG富集分析显示地榆抗细菌感染主要涉及细胞增殖、细胞凋亡、免疫应答等生物学过程,主要作用与调控Toll样受体、TNF、MAPK等信号通路相关。山奈酚对革兰阳性菌MRSA和MSSA的MIC50和MIC90均为128 μg/mL。山奈酚、槲皮素对革兰阴性菌铜绿假单胞菌的MIC50和MIC90均为128 μg/mL。与菌对照组比较,山奈酚(2.56 mg/mL)对MRSA和铜绿假单胞菌感染的秀丽隐杆线虫存活率明显升高(P<0.05),槲皮素(5.12 mg/mL)可明显提高铜绿假单胞菌感染线虫的存活率(P<0.05)。结论 该研究初步揭示了山奈酚和槲皮素可能是地榆抗菌作用的物质基础之一,其作用机制可能与网络药理学预测的调节机体免疫和炎症反应等有关,为进一步实验研究奠定一定基础。
关键词:地榆;抗菌活性成分;网络药理学;初步实验验证
中图分类号:R978.1文献标志码:A
Study on the Antibacterial active ingredients of Sanguisorba officinalis based
on network pharmacology and preliminary experimental verification
Zhu Jie, Zhang Bin, Wang Ying-ying, Chen Yong, Chu Yi-wen, and Ni Cai-xia
(Antibiotics Research and Re-evaluation Key Laboratory of Sichuan Province, Sichuan Industrial Institute of Antibiotics, School of Pharmacy, Chengdu University, Chengdu 610106)
Abstract Objective Based on the results of preliminary research in the laboratory, network pharmacology methods were used to explore the antibacterial active components and verified it with antibacterial pharmacodynamic experiments. Methods Based on the TCMSP database to obtain the chemical constituents and corresponding targets of Sanguisorba officinalis, obtain bacterial infection targets through Gene cards and OMIM database, and map the drugs and disease targets to obtain the predicted targets of the chemical composition of Sanguisorba officinalis. The Cytoscape software was used to construct a component-target-disease network diagram, STRING database was used to build a protein interaction network, GO and KEGG analysis was constructed by DAVID database. The agar double dilution method was used to determine the minimum inhibitory concentration (MIC) of the predicted active ingredients. The clinical isolates of methicillin-resistant Staphylococcus aureus (MRSA) and Pseudomonas aeruginosa (PA) were used to infect Caenorhabditis elegans (C. elegans). Established infection and drug treatment models under solid conditions, and verified the antibacterial activity of the predicted ingredients by observing the survivals of Caenorhabditis elegans. Results Sanguisorba officinalis could have eight potential active ingredients, the degree values of kaempferol and quercetin were higher than the average degree value. There were 88 targets that may be related to the anti-drug resistant bacteria, while 17 key targets were obtained; GO and KEGG enrichment analysis showed that the resistance to bacterial infection of Sanguisorba officinalis was mainly involved in biological processes such as cell proliferation, cell apoptosis, and immune response, and the main effects were related to the regulation of Toll-like receptor, TNF, MAPK, and other signaling pathways. The results of MIC determination showed that the MIC50 and MIC90 of kaempferol against Gram-positive bacteria MRSA and MSSA were both 128 μg/mL. The MIC50 and MIC90 of kaempferol and quercetin against the Gram-negative bacteria PA were both 128 μg/mL. In addition, after C. elegans ware infected with clinical isolates, the lethalities of different strains to C. elegans were different. After treatment with drugs, the survival rates of infected C. elegans were significantly improved. Compared with the bacterial control group, the survival rates of kaempferol (2.56 mg/mL) against C. elegans infected by MRSA and PA were significantly increased (P<0.05). Quercetin (5.12 mg/mL) could significantly increase the survival rate of C. elegans infected by PA (P<0.05). Conclusion The study initially reveals that kaempferol and quercetin may be one of the material bases for the antibacterial activity of Sanguis elmoides, and their mechanism of action may be related to the regulation of immunity and inflammation. This study lays a certain foundation for further experimental research.
Key words Sanguisorba officinalis; Antibacterial active ingredients; Network pharmacology; Preliminary experimental verification
细菌感染是致病菌或条件致病菌侵入机体并不断增殖的病理症状,感染过程中产生的毒素和其他代谢产物会导致机体免疫系统不断被激活,临床上常以抗生素对因治疗。据统计,在2000—2015年期间,全世界抗生素使用量较20世纪增长65%[1]。不少学者指出,抗生素滥用会导致细菌耐药谱越来越广,耐药强度日益增强,甚至导致“超级细菌”频繁出现。因此,抗生素滥用所致细菌耐药性问题已成为全世界日益严峻的公共卫生问题[2-3]。2016年,o'Neill研究小组指出,若细菌耐药性问题若得不到解决,预测到2050年全世界每年因此导致的死亡可能达1000万人次[4]。如何解决此问题,有学者认为一方面需制定和完善相关法律法规以加强对抗生素应用的监管,另一方面应积极寻找抗菌谱广,副作用小或无,对环境无污染且不易产生耐药性的绿色抗生素[5]。
中药具有多途径,多靶点,毒性小,疗效明确等优点,其临床应用已有上千年历史。近年来,不少学者致力于中药抗菌活性成分的发掘,并发现某些中药提取物或者单体化合物具有良好的抗菌活性[6]。课题组前期研究发现,地榆(Sanguisorba officinalis)水提取液对临床分离菌株具有较好的抗菌活性,尤其对临床耐药菌耐甲氧西林金黄色葡萄球菌(methicillin resistant Staphylococcus aureus, MRSA),其MIC50和MIC90均为生药2.1 mg/mL,口服给予剂量为10 g/kg的地榆水提取液可提高MRSA所致急性腹腔感染模型小鼠的生存率[7],但地榆发挥药效的物质基础亟待进一步探讨。
网络药理学(network pharmacology)是基于系统生物学、网络科学、生物信息学等研究方法,通过多种数据库构建基因与药物、疾病和靶标等之间的相互作用网络,研究中药的“多成分、多靶点、多途径”的系统性药理机制和中医潜在疾病的治疗机制,是大数据时代药物系统性和人工智能相关研究的新兴学科。利用网络药理学技术构建多层次网络模型,科学阐释中医药科学性以及有效性,该方法目前已广泛应用于中医药相关研究,但根据现有的技术手段,该方法存在一定局限性。首先,网络药理学侧重于定性研究,尚未考虑药物剂量,中药有效成分在体内的实际分布和含量不明确。其次,网络药理学尚无标准化研究方法,对于预测结果缺乏验证性研究。另外,部分数据库存在信息不全面,更新不及时等因素,使得网络药理学研究结果亦存在一定局限性和片面性。尽管网络药理学存在不可避免的局限性,但是它为中医药的研究提供了多维度研究策略,众多学者以此为导向可对中医药进行更深更广的研究,推动了中医药现代化研究进程。
本研究基于前期实验基础,拟通过网络药理学方法从整体性角度对地榆抗菌药效物质基础和作用机制进行探讨,并结合抗菌药效学相关实验进行初步验证,为后续实验研究方向奠定一定基础。
1 材料与方法
1.1 试验药物
受试药物:地榆购自四川德仁堂药业连锁有限公司,经鉴定符合2020年版《中国药典》标准。山奈酚和槲皮素均购自源叶生物科技有限公司,批号分别为G11A11L110978,C28J11Y6820。地榆水提液(含生药1 g/mL)参照文献制备[7]。
1.2 线虫和菌株
标准菌株金黄色葡萄球菌ATCC29213、铜绿假单胞菌ATCC27853、大肠埃希菌ATCC25922购自北纳创联生物科技有限公司。临床菌株:耐甲氧西林金黄色葡萄球菌(MRSA)、甲氧西林敏感金黄色葡萄球菌(methicillin sensitive Staphylococcus aureus, MSSA)、铜绿假单胞菌(Pseudomonas aeruginosa, PA)、产ESBLs大肠埃希菌和非产ESBLs大肠埃希菌,来自于近2~3年成都地区医院收集的临床分离致病菌。标准菌株和临床菌株由本实验室保藏。野生型秀丽隐杆线虫(Caenorhabditis elegans, C. elegans)N2和大肠埃希菌OP50(Escherichia coli OP50)由本学院微生物学实验室惠赠。
1.3 主要培养基和试剂
LB液体培养基(北京索莱宝科技有限公司,批号20200616),线虫生长培养基(NGM培养基[8]),PGS培养基[9],MHA培养基(北京奥博星生物技术有限责任公司,批号20200730)。5-氟-2'-脱氧尿苷(5-fluoro-2'-deoxyuridine,FUDR)(源叶生物科技有限公司,批号M29GS150283)。蛋白胨(上海泰坦科技股份有限公司,批号P1857310)。胆固醇(北京索莱宝科技有限公司,批号111M033)。
1.4 主要仪器
Denley A400型多点接种仪(England)、BioTek光吸收酶标仪、体式显微镜(SMZ-168,麦克奥迪实业集团有限公司),恒温恒湿培养箱(HWS型,北京中兴伟业仪器有限公司),立式高压蒸汽灭菌器(LDZX-75L,上海申安医疗器械厂),隔水式恒温培养箱(GNP-9080,上海精宏实验设備有限公司)。
1.5 方法
1.5.1 地榆抗菌活性研究的网络药理学分析
(1)地榆潜在活性成分及靶点预测:利用TCMSP数据库[10]以生物利用度(OB)≥30%和类药性(DL)≥0.18为筛选条件,检索地榆的潜在活性成分及相应靶点。利用PubChem和Chemical Book确定地榆活性成分化学结构。
(2)地榆抗菌作用靶点网络构建与分析:通过Gene cards[11]数据库和OMIM以“bacterial infections”,“resistance gene”,“bacterial resistance”为关键词,收集细菌感染相关基因,并与上述活性成分靶点取交集,所得靶点即为地榆抗菌的潜在作用靶点。将地榆活性成分、成分靶点导入Cytoscape软件构建“潜在活性成分-疾病靶点”网络。
(3)蛋白间相互作用关系:将地榆抗细菌感染潜在靶点导入STRING数据库,构建靶点蛋白互作網络(PPI)。将PPI结果导入Cytoscape软件进行相关拓扑学分析。
(4)富集分析:将地榆抗细菌感染的关键靶点导入DAVID数据库,以P<0.05为筛选标准,限定物种为人类“Homo sapiens”进行GO富集分析和KEGG信号通路富集分析。以Count值降序排列,选取前10位进行可视化。
(5)地榆抗菌化学成分-靶点-通路可视化互作网络:将成分、靶点以及KEGG富集分析所得前10条通路汇导入Cytoscape软件,构建成分-靶点-通路网络并进行可视化分析。
1.5.2 地榆预测活性成分对临床菌株的体外抗菌作用
选择MSSA、MRSA、铜绿假单胞菌、大肠埃希菌产Esbls(Esbls+)和大肠埃希菌非产Esbls(Esbls-)各5株,采用琼脂二倍稀释法,进行最低抑菌浓度(MIC)的测定。
1.5.3 地榆预测活性成分对秀丽隐杆线虫感染模型的实验研究
(1)菌悬液的制备:将MRSA菌株、铜绿假单胞菌菌株复苏,挑取单菌落,接种于LB液体培养基,37℃震荡培养16 h。将菌悬液离心去上清后,用NS稀释到所需浓度(A600约为1),备用。
(2)线虫同期化处理:将5只怀孕成虫接种到含E. coli OP50NGM平板上,20℃培养,过夜产卵后挑出所有成虫,剩余卵继续培养48~56 h后成L4期成虫。
(3)感染平板及感染致死实验:根据文献[12]改良感染模型,在PGS平板上均匀涂抹一定量的FUDR,防止线虫繁殖,再涂抹上述制备好的菌悬液。按MRSA 100 μL/皿,PA50 μL/皿均匀涂布在PGS平板上,晾干倒置于37℃培养箱过夜培养后挑取10条L4期未孕成虫置于平板上,于20℃培养箱培养,每天观察线虫生长情况,记录线虫死亡只数,连续观察10 d。正常对照组加入等量的E. coli OP50菌液。所有组均重复3次。
(4)感染救治实验:分别吸取180 μL地榆水提液(含生药1 g/mL),山奈酚(2.56 mg/mL)、槲皮素(5.12 mg/mL)倒入60 mm平板,再倒入PGS培养基,均匀摇晃至药液完全溶解,晾干,再加入FUDR,后续步骤同上。
1.6 统计分析方法
对MIC值,计算受试药物MIC50和MIC90、MIC众数及MICrange。线虫感染实验设置3次独立重复实验,观察线虫生长情况,计算线虫存活率,存活率=(存活只数/总只数)×100%,数据以均值±标准差表示,作存活率曲线图。利用Graphpad Prism8统计软件进行分析,Kaplan-Meier方法进行生存分析,log-rank检验法用于组间差异显著性分析,P<0.05为差异有统计学意义。
2 结果
2.1 地榆抗菌活性研究的网络药理学预测结果
2.1.1 地榆化学成分的筛选
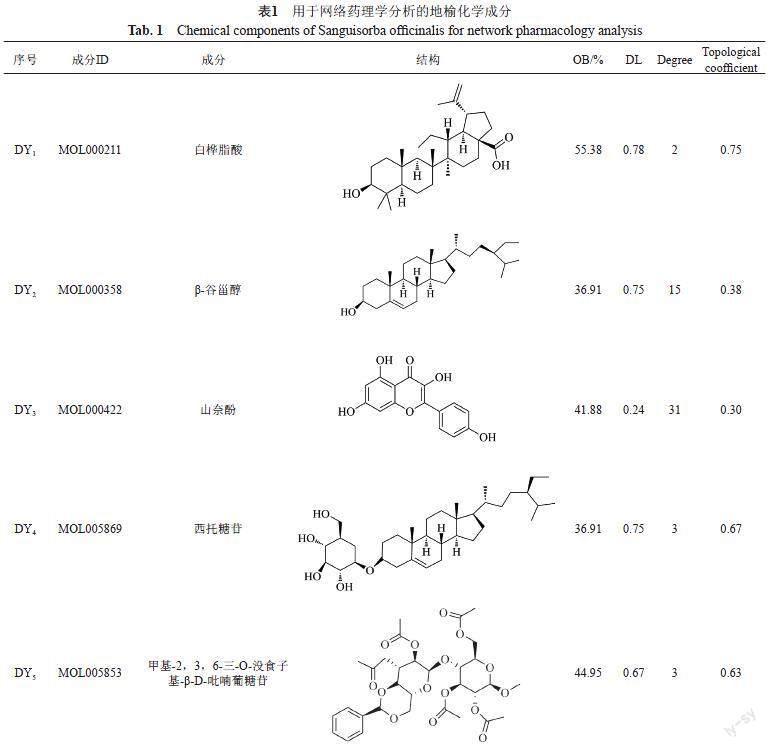
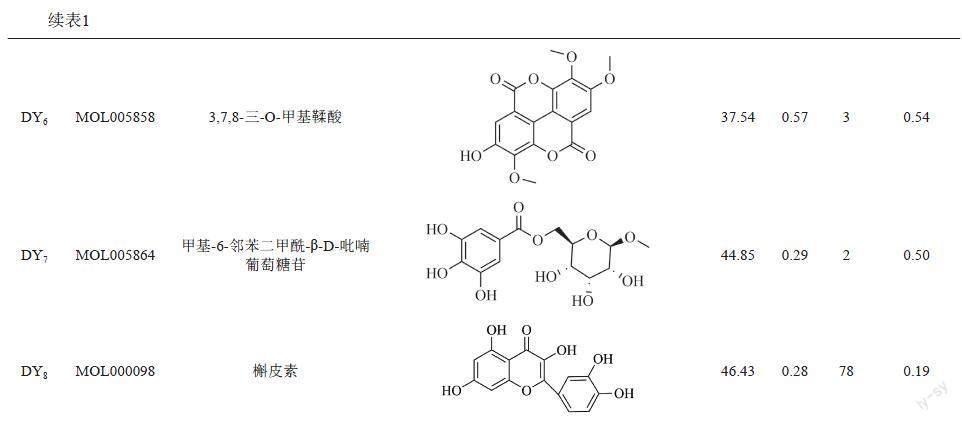
经过筛选获得地榆化合物共41个,再以OB≥30%和DL≥0.18为条件进行筛选,最后得到地榆活性成分8个,见表1。其中鞣质类3个,黄酮类2个,甾体类2个,有机酸类1个。其中度值较高(Degree>10)的化合物是DY2、DY3、DY8,即β-谷甾醇、山奈酚和槲皮素。
2.1.2 地榆抗耐药菌相关靶点
地榆的8个活性成分在TCMSP、Drugbank数据库中获得并去重后,得相关靶点数148个。将疾病靶点与药物靶点对比取交集,筛选出共有靶点88个,绘制韦恩图,见图1。
2.1.3 化合物-靶点网络构建与分析
将活性成分与交集靶点导入Cytoscape软件构建成分-靶点网络图,见图2所示。图中共得到98个节点(8个成分,88个靶点)、225条边。网络拓扑学结构分析显示,化合物的平均度值为17.125,说明地榆抗菌有多靶点属性,其中度值较大(度值>10)的化合物为DY2、DY3和DY8,度值分别为15、31和78。化合物拓扑学参数见表1。同时,许多靶点与多种成分相关,表明地榆发挥抗菌作用过程中其所含的不同化合物可能具有协同作用。
2.1.4共有靶点的蛋白互作网络分析
将88个共有靶点上传至String数据库构建PPI网络,PPI网络图包含77个节点数、254条相互作用连线。运用Network analyzer分析其Degree、Betweenness centrality、Closeness centrality等网络拓扑特征值。选取Degree值在2倍中位数之上的靶点构建关键靶点网络图,共得到17个地榆抗细菌感染的关键靶点,见图3。节点越大、颜色越深其对应Degree值就越大,该靶点的重要性也越大。边越粗颜色越深对应的Combine score越大,表示蛋白之间相互作用强度越强。由下图可知,最关键靶点是JUN、TNF、RELA、MAPK1、IL6、TP53和AKT1。17个关键靶点的拓扑参数详见表2。
2.1.5GO功能富集分析和KEGG通路富集分析
对表2筛选出的17个关键靶点通过David进行富集分析,GO功能富集分析得到222个注释信息条目(P<0.05),其中生物过程(BP)条目175个,细胞成分(CC)条目12个,分子功能(MF)条目35个,分别占78.8%、5.4%和15.8%。以Count值降序排列筛选出排名前10位的GO条目,见图4。由图4可发现,地榆抗细菌感染涉及的生物方面主要是DNA模板转录的正调控,RNA聚合酶Ⅱ启动子,凋亡过程负调控,炎症反应,转录因子活性,基因表达正调控等;细胞方面关键靶点主要涉及细胞核浆、细胞膜、细胞核、线粒体和溶酶体等;分子功能方面,关键靶点主要体现在与蛋白结合、DNA结合、酶结合、转录因子活性和细胞因子活性等方面,GO功能富集分析结果提示地榆能通过多种生物学途径发挥抗细菌活性作用。
以P<0.05为筛选条件,KEGG通路富集分析共得到90条通路,Count值降序排列可视化前10条KEGG条目,见图5。KEGG通路富集分析结果显示,17个关键靶点涉及的排名前10条通路包括3条信号通路(Toll样受体、TNF、MAPK)、癌症通路以及6条疾病通路(乙型肝炎、恰加斯病、百日咳、甲型流感、单纯疱疹病毒感染、肺结核),结果提示地榆对于某些病毒引起的疾病可能有药效作用。
2.1.6 地榆抗菌化学成分-靶点-通路网络可视化
將Degree大于10的化合物以及Degree在2倍中位数以上的靶点和前10条KEGG富集通路做可视化分析,结果见图6。从图中可看出,3个化合物,16个关键靶点,10条通路之间存在复杂的网络关系,提示地榆的活性成分通过不同的靶蛋白在多条通路中发挥作用。
2.2 地榆预测活性成分的抗菌药效学研究
2.2.1 预测活性成分对临床菌株的体外抗菌作用
肉眼观察发现菌对照组正常生长。质控菌株的MIC值在质控范围内,说明本实验系统和方法可靠。由表3可知,山奈酚对受试革兰阳性菌MRSA和MSSA的MIC50和MIC90均为128 μg/mL。山奈酚、槲皮素对受试革兰阴性菌铜绿假单胞菌的MIC50和MIC90均为128 μg/mL。山奈酚和槲皮素对大肠埃希菌抑菌作用较弱。
2.2.2 铜绿假单胞菌和MRSA对秀丽隐杆线虫的感染致死判定
体式显微镜下观察,线虫感染细菌前呈曲线特征,咽部肌肉运动明显,运动速度快,而细菌感染致死的线虫,体长缩短,咽部无运动,呈透明僵直状态,见图7。
2.2.3 药物对铜绿假单胞菌感染的秀丽隐杆线虫存活率的影响
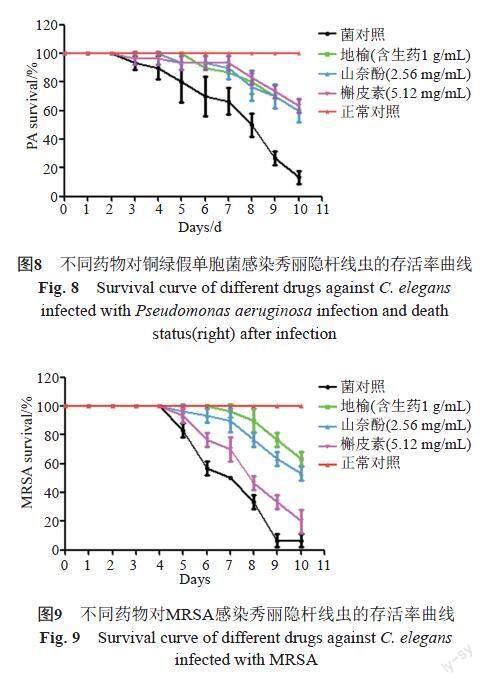
线虫经铜绿假单胞菌感染后,随时间的延长,菌对照组线虫运动功能逐渐降低,生长被抑制,身体越来越透明,甚至出现死亡,而正常对照组线虫生长良好,身体粗长。由图8可知,连续观察10 d后,与菌对照组比较,地榆水提液(含生药1 g/mL),山奈酚(2.56 mg/mL)、槲皮素(5.12 mg/mL)组线虫存活率明显升高,分别为60.0%、60.0%和63.3%差异具有统计学意义(P<0.05)。
2.2.4 药物对MRSA感染秀丽隐杆线虫存活率的影响
线虫经MRSA感染后,随时间的延长,菌对照组线虫运动功能逐渐降低,生长被抑制,身体越来越透明,甚至出现死亡,而正常对照组线虫生长良好,身体亦粗长。由图9可知,连续观察10 d后与菌对照组比较,地榆水提液(含生药1 g/mL),山奈酚(2.56 mg/mL)组线虫存活率明显升高,分别为63.3%,53.3%,差异具有统计学意义(P<0.05);槲皮素(5.12 mg/mL)组存活率差异无统计学意义(P>0.05)。
3 讨论
地榆来源于蔷薇科植物地榆(Sanguisorba officinalis L.)或长叶地榆(Sanguisorba officinalis L var.longifolia(Bert.)Yu et Li)的干燥根,广泛分布于世界各地,以北半球温带地区居多[13]。查阅文献发现,地榆化学成分丰富,主要包括皂苷、黄酮、鞣质以及有机酸、甾体及蒽醌类[14]。本研究基于前期地榆水提取液对多种临床耐药菌均有抑制作用的研究基础,应用网络药理学研究方法对地榆抗菌作用活性成分进行筛选,靶点预测及网络构建,并结合抗菌药效学实验进行初步验证。
利用网络药理学,对地榆活性化合物进行分析获得8个活性成分,其中β-谷甾醇、山奈酚、槲皮素的Degree大于10,分别为15、31和78。国内外研究资料显示上述3种化合物在体内外试验中均有一定抗菌活性。Joanda等[15]通过微量稀释法发现,β-谷甾醇对金黄色葡萄球菌菌株ATCC25923和大肠埃希菌(E. coli)有较强的抗菌活性,其MIC值分别为125和500 μg/mL。
此外,将β-谷甾醇同头孢菌素类药物头孢曲松钠和头孢唑啉,喹诺酮类药物环丙沙星和诺氟沙星联用时均能显著降低常规抗菌药物的MIC,提示β-谷甾醇可能具有一定的抗菌活性并和常规抗菌药物之间存在协同效应。Cruz等[16]研究发现,浓度为128 μg/mL的山奈酚与庆大霉素联用时亦有协同作用,将庆大霉素MIC分别从16 μg/mL降低到4 μg/mL。山奈酚与阿米卡星联用时亦存在协同效应,可将山奈酚MIC从
128 μg/mL降至32 μg/mL,结果表明山奈酚的发挥效应的基础可能与结构上的羟基苯基对蛋白质具有亲和力从而干扰细菌蛋白质合成有关。Lv等[17]发现,以12 h的间隔皮下注射给药25 mg/kg槲皮素72 h,96 h内记录肺炎链球菌所致鼻内感染模型小鼠存活率,槲皮素能显著降低模型小鼠的肺组织水肿和病理损伤,抑制炎症反应,提高被感染小鼠的存活率,显示出抗感染作用。此外,体外128 μg/mL槲皮素给药4~6 h可杀死99.95%的大肠埃希菌和肺炎克雷伯菌,且槲皮素与美洛培南之间存在协同作用,其抗菌活性可能是通过破坏细菌细胞形态和下调blaVIM和ompC表达实现[18]。查阅文献发现β-谷甾醇、山奈酚、槲皮素有一定抗菌活性,与常规抗菌药物之间存在协同效应,但研究较零散,较浅,多数只通过体外实验测定MIC来判断有无抗菌活性,无论是地榆还是其活性成分的系统研究,深入研究均鲜见报道。本研究通过体外测定MIC和体内研究(临床致病菌致秀丽隐杆线虫感染模型)同时进行山奈酚和槲皮素的抗菌药效学研究,为后续深入研究奠定基础。
通过靶点互作PPI网络图,筛选地榆抗菌的关键靶点主要包括IL10、MYC、FOS、MAPK1、TNF、JUN、AKT1和ESR1等17个靶点,其中Degree值大于15的是JUN、TNF、RELA、MAPK1、IL6、TP53和AKT1。涉及的主要通路有Toll样受体、TNF、MAPK、NF-κB、百日咳、甲型流感和单纯疱疹病毒感染等。
Toll样受体(Toll-like receptors, TLRs)是一类I型跨膜糖蛋白模式识别受体,其通过识别病原体相关分子模式(pathogen associated molecular pattern, PAMP),激活天然免疫,诱导产生多种细胞因子,在抗感染免疫反应中担任重要角色,是研究细菌性感染疾病分子机制的重要途径之一[19]。TLR家族中现已发现13种受体,目前研究较多的是TLR2和TLR4,它们在细菌感染的炎症反应中起着重要作用,TLR2可识别革兰阳性菌的PGN、LTA,革兰阳性菌、革兰阴性菌等,TLR4通过与CD4、MD-2或RP105构成复合受体协同识别革兰阴性菌的LPS[20-22]。NF-kB是多向性核转录调节因子,由Rel蛋白家族成员以同源或者异源二聚体形式组成,位于TLRs介导的信号通路下游的重要位置,对应激反应、免疫应答、细胞增殖分化等过程的发生发展发挥重要作用[23]。RELA即p56为NF-kB 5个家族成员之一,本研究结果中,该靶点Degree为22(表2),排第三,PPI预测结果显示其为17个关键靶点之一(图3),结果提示该靶点在地榆抗细菌感染分子机制中可能发挥重要作用。MAPK是信号从细胞表面传导到细胞核内部的重要传递者[24]。本研究结果中所展现出的JUN,CASP8,MAPK8,MAPK1,AKT1均是该通路上的重要靶点。NF-κB及MAPK信号通路是启动细胞内炎症信号转导的重要通路,二者激活后通过不同途径启动相关因子进而大量上调IL-1B,IL-6,IL-8和TNF-α等促炎细胞因子以及抗炎性因子IL-10和趋化因子的表达导致炎症失衡,引发一系列的细菌感染症状[22]。
基于现有的文献报道,发现应用网络药理学方法获得的Degree值较大的地榆3个活性成分β-谷甾醇、山奈酚、槲皮素均具有一定抗菌活性,与常规抗菌药物之间存在协同效应。将活性成分进行度值评价,经网络拓扑学结构分析显示,化合物平均Degree值为17.125。选取高于平均度值的化合物即山奈酚Degree为31,槲皮素Drgree为78进行药效学研究,进行实验验证。体外MIC测定结果显示山奈酚对受试革兰式阳性菌MRSA和MSSA的MIC50和MIC90均为128 μg/mL。山奈酚、槲皮素对受试革兰式阴性菌铜绿假单胞菌的MIC50和MIC90均为128 μg/mL,而对大肠埃希菌的抑菌作用较弱,实验结果与网络药理学预测结果以及已知文献报道基本吻合,说明网络药理学的筛选与预测有一定准确性。进一步研究发现,地榆水提液(含生药1 g/mL),山奈酚(2.56 mg/mL)对MRSA和铜绿假单胞菌感染的秀丽隐杆线虫存活率明显升高,槲皮素(5.12 mg/mL)可明显提高铜绿假单胞菌感染线虫的存活率。实验结果提示,山奈酚和槲皮素可能是地榆抗菌作用的物质基础之一,其作用机制可能与网络药理学预测以及文献报道的Toll样受体、MAPK、TNF、NF-kB和P13K-AKT等信号通路有关,通路上的关键靶点有JUN、TNF、RELA、MAPK1、IL6、TP53和AKT1等。本次研究初步证实了山奈酚和槲皮素具有一定的抗菌活性,可能是地榆抗菌作用的物质基础之一。山奈酚和槲皮素同属于黄酮类化合物,二者之间是否存在协同效应,以及黄酮类化合物在地榆抗菌效应中的作用程度,均有待进一步探讨。下一步课题组将通过一系列动物实验对筛选出的化合物和地榆水提取液进行深入药效学研究,同时结合本研究的网络药理学预测结果进行相关的生物学过程、信号通路以及关键靶点的系统研究,从而阐释地榆抗菌作用的系统药理学机制,为地榆在抗感染领域中的应用提供科学支撑。
参 考 文 献
[1]Diallo O O, Baron S A, Abat C, et al. Antibiotic resistance surveillance systems: A review[J]. J Glob Antimicrob Resist, 2020, 23: 430-438.
[2]Ancillotti M, Eriksson S, Andersson D I, et al. Preferences regarding antibiotic treatment and the role of antibiotic resistance: A discrete choice experiment[J]. Int J Antimicrob Agents, 2020, 56(6): 106198.
[3]Wang H, Zhang J, Song Z, et al. An intelligent platform based on acidity-triggered aggregation of gold nanoparticles for precise photothermal ablation of focal bacterial infection[J]. Chem Eng J, 2020, 407: 127076.
[4]Piddock L J V. Reflecting on the final report of the ONeill review on antimicrobial resistance[J]. Lancet Infect Dis, 2016, 16(7): 767-768.
[5]王梁鳳, 李慧婷, 陈青垚, 等. 中药挥发油抗菌作用的研究进展[J]. 中国中药杂志, 2021, 46(5): 1026-1033.
[6]Rosalucia M, Marco L, Santo S, et al. A review of the antimicrobial potential of herbal drugs used in popular Italian medicine (1850s–1950s) to treat bacterial skin diseases[J]. J Ethnopharmacol, 2020, 250: 112443.
[7]張斌, 鲁兰, 王英英, 等. 地榆水提液对临床耐药菌MRSA的抗菌活性及机理研究[J]. 中药药理与临床, 2020, 36(4): 120-124.
[8]周雨朦, 李继安, 沈舜义, 等. 基于秀丽隐杆线虫耐药菌感染模型筛选活性化合物[J]. 中国抗生素杂志, 2014, 39(7): 481-485.
[9]Tan M W, Mahajan-Miklos S, Ausubel F M. Killing of Caenorhabditis elegans by Pseudomonas aeruginosa used to model mammalian bacterial pathogenesis[J]. Proc Natl Acad Sci USA, 1999, 96(2): 715-720.
[10]Ru J, Li P, Wang J, et al. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6: 13.
[11]Gil S, Inbar P, Danit-Oz L, et al. VarElect: The phenotype-based variation prioritizer of the GeneCards Suite[J]. BMC Genomics, 2016, 17(2): 195-206.
[12]付如意, 褚以文, 李静, 等. D-环丝氨酸抑制铜绿假单胞菌群体感应活性研究[J]. 中国抗生素杂志, 2021, 46(6): 545-551.
[13]Su X D, Guo R H, Li H X, et al. Anti-allergic inflammatory components from Sanguisorba officinalis L.[J]. Bioorg Med Chem Lett, 2018, 28(12): 2210-2216.
[14]Wang R S, Jin M, Jin C S, et al. Three new ursane-type triterpenoids from the roots of Sanguisorba officinalis L. and their cytotoxic activity[J]. Phytochem Lett, 2019, 32: 96-100.
[15]Silva J P R E, Policarpo I, Chaves T P, et al. A glycosylated β-sitosterol, isolated from Tacinga inamoena (Cactaceae), enhances the antibacterial activity of conventional antibiotics[J]. S Afr J Bot, 2020, 133(4): 193-200.
[16]Cruz B G, dos Santos H S, Bandeira P N, et al. Evaluation of antibacterial and enhancement of antibiotic action by the flavonoid kaempferol 7-O-β-D-(6''-O-cumaroyl)-glucopyranoside isolated from Croton piauhiensis müll[J]. Microb Pathog, 2020, 143: 104144.
[17]Lv Q, Zhang P, Quan P, et al. Quercetin, a pneumolysin inhibitor, protects mice against Streptococcus pneumoniae infection[J]. Microb Pathog, 2019, 140: 103934.
[18]Pal A, Tripathi A. Demonstration of bactericidal and synergistic activity of quercetin with meropenem among pathogenic carbapenem resistant Escherichia coli and Klebsiella pneumoniae[J]. Microb Pathog, 2020, 143: 104120.
[19]Kaisho T, Akira S. Toll-like receptor function and signaling[J]. J Allergy Clin Immunol, 2006, 117(5): 979-987.
[20]Simpson M E, Petri W A. TLR2 as a therapeutic target in bacterial infection[J]. Trends Mol Med, 2020, 26(8): 715-717.
[21]Tang J, Xu L Q, Zeng Y W, et al. Effect of gut microbiota on LPS-induced acute lung injury by regulating the TLR4/NF-κB signaling pathway[J]. Int Immunopharmacol, 2021, 91: 107272.
[22]Keara L, Marta A T, Takamasa K, et al. Escalating threat levels of bacterial infection can be discriminated by distinct MAPK and NF-κB signaling dynamics in single host cells[J]. Cell Syst, 2019, 8(3): 183-196.
[23]Pattanaik K P, Ganguli G, Nail S K, et al. Mycobacterium tuberculosis EsxL induces TNF-α secretion through activation of TLR2 dependent MAPK and NF-κB pathways[J]. Mol Immunol, 2021, 130: 133-141.
[24]Jisun L, Hyeon J K, Trang T H, et al. Emodin 8-O-glucoside primes macrophages more strongly than emodin aglycone via activation of phagocytic activity and TLR-2/MAPK/NF-κB signalling pathway[J]. Int Immunopharmacol, 2020, 88: 106936.
