纳米给药系统在幽门螺杆菌靶向治疗中的研究进展
2022-05-30严晓敏王文俊陈自强胡慧玲王战国
严晓敏 王文俊 陈自强 胡慧玲 王战国
摘要:幽门螺杆菌是一种定植于胃黏液层和胃黏膜表面的常见致病菌,全球感染率已超过50%。幽门螺杆菌感染与消化性溃疡、慢性胃炎、胃癌等多种消化系统疾病的发生发展有着密切的联系,临床以抗生素为主的联合疗法为常见。随著抗生素的酸不稳定及细菌耐药性的不断升高,幽门螺杆菌的根除率不断下降,为药物递送提出了新的挑战。纳米给药系统在提高药物生物利用度、达到靶向、缓控释递药等方面具有独特优势,为幽门螺杆菌感染治疗带来了机遇。本文分析了H. pylori的结构特征与其定植、耐药性的产生之间的联系,并针对H. pylori特征结构,归纳总结了纳米给药系统在幽门螺杆菌靶向治疗中的研究进展,以期为幽门螺杆菌的治疗研究和制剂开发提供参考。
关键词:幽门螺杆菌;纳米给药系统;抗生素;靶向治疗
中图分类号:R943.1文献标志码:A
Research progress of nanoparticle delivery system
in targeted therapy of Helicobacter pylori
Yan Xiao-min1, Wang Wen-jun1, Chen Zi-qiang1, Hu Hui-ling1, and Wang Zhan-guo2
(1 Key Laboratory of Standardization of Chinese Herbal Medicine, Pharmacy College, Chengdu University of Traditional Chinese Medicine, Ministry of Education, State Key Laboratory of Characteristic Chinese Medicine Resources in Southwest China, Chengdu 611137; 2 Collaborative Innovation Laboratory of Metabonomics, College of Medicine, Chengdu University, Standard Research
and Extension Base (Collaborative Innovation Center) of Qiang Medicine, Chengdu 610106)
Abstract Helicobacter pylori is a common pathogenic bacterium colonized in the gastric mucosal layer as well as at the gastric epithelial surface, with the global infection rate exceeded 50%. Helicobacter pylori infection is closely related to the occurrence and development of peptic ulcer, chronic gastritis, gastric cancer and other digestive system diseases. Antibiotic-based combination therapy is commonly used in clinical treatment. However, the eradication rate is gradually decreased due to the acid instability of antibiotics and the increasing drug resistance of bacteria, which brings new challenges for the drug delivery. Nanoparticle delivery system has the unique superiorities in improving bioavailability and targeted, sustained and controlled drug delivery, which bring an opportunity to the eradication of Helicobacter pylori. In this paper, the relationship between the structural characteristics of Helicobacter pylori and its colonization and resistance was analyzed. And according to the characteristic structure of Helicobacter pylori, the research progress of nanoparticle delivery system in the targeted therapy of Helicobacter pylori was summarized, so as to provide reference for the treatment research and preparation development of Helicobacter pylori.
Key words Helicobacter pylori; Nanoparticle delivery system; Antibiotic; Targeted therapy
1982年,澳大利亚学者Marshall和Warren首次从慢性胃炎和胃溃疡患者胃黏膜中分离并培养出了一种螺旋状、多鞭毛和微嗜氧性的革兰阴性细菌,即为幽门螺杆菌(H. pylori)。1994年,世界卫生组织国际癌症研究机构将H. pylori列为Ⅰ类致癌物[1]。它是胃十二指肠疾病的主要病原体,与胃炎、消化性溃疡和胃癌等疾病的发生发展具有密切的联系,此外,缺铁性贫血、特发性血小板减少性紫癜和维生素B12缺乏、自身免疫性甲状腺疾病和心肌梗死也被报道与幽门螺杆菌感染有关[2-3]。迄今为止,H. pylori的全球感染率已超过50%,而在中国,H. pylori的平均感染率也已经达到56%,有的地区甚至逼近90%[4]。针对H. pylori感染,临床主要通过质子泵抑制剂 (PPI) 和抗生素进行联合治疗,周期长达两周。然而研究数据显示,经14 d的三联疗法治疗,H. pylori根除率仅为70%~80%[5]。一方面,抗生素的酸不稳定性及胃黏液屏障的阻碍使抗生素有效杀菌浓度降低[6];另一方面,高剂量抗生素对H. pylori特异性较差,疗程长,患者依从性差,常出现恶心、呕吐、腹胀及肠道菌群失调等副作用[7]。而更为重要的是,研究表明H. pylori通过多维度的定植机制对胃酸环境显示出极强的适应性,同时H. pylori易对抗生素产生耐药性[8-9]。因此,如何提高抗生素对H. pylori的特异性清除并逆转耐药,为H. pylori感染的药物治疗提出了新的挑战。
由于高比表面积和黏膜通透性等物理化学特质,纳米给药系统在提高药物生物利用度、实现靶向给药、达到缓控释以及降低药物的毒副作用等方面有着独特优势[10-11]。本文分析了H. pylori的結构特征与其定植、耐药性的产生之间的联系,并针对H. pylori的特征结构,归纳总结了纳米给药系统在H. pylori的靶向治疗中的研究进展,以期为H. pylori的治疗及制剂研发提供参考。
1 基于H. pylori表面黏附因子的靶向策略
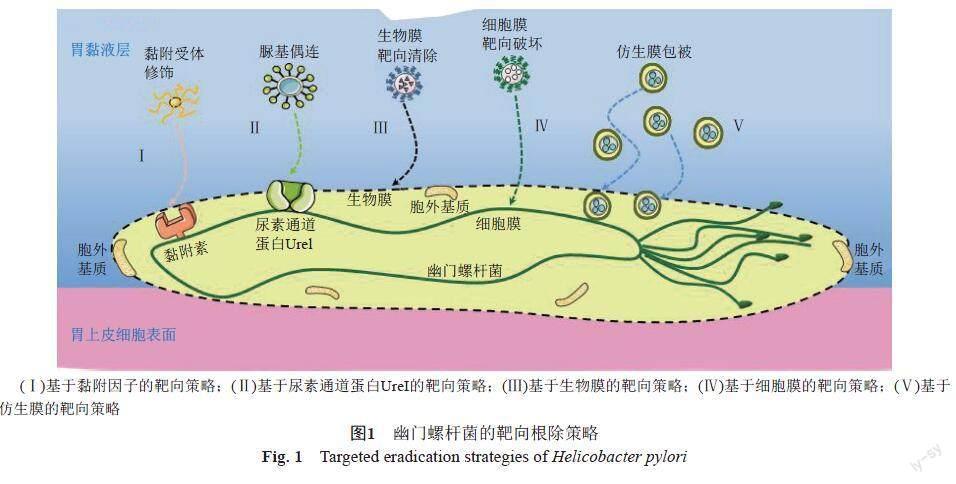
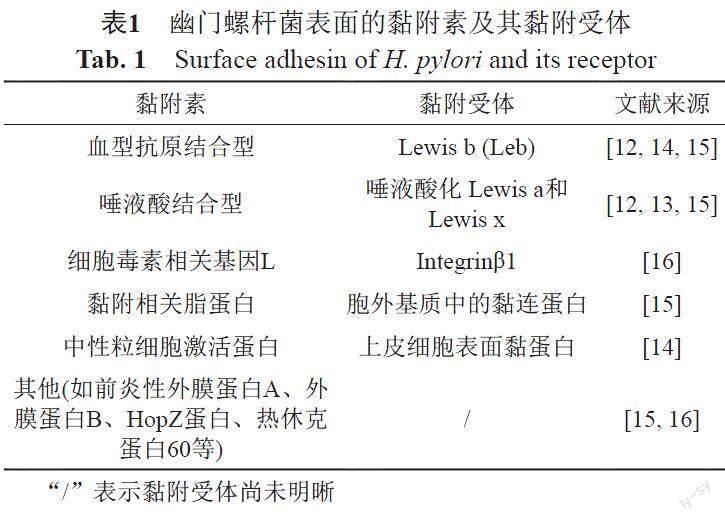
细菌病原体黏附到黏膜表面,避免由于自身的蠕动排出机体,对H. pylori的定殖至关重要。研究发现H. pylori表面存在黏附素,其中以黏附素HpaA为代表,包括血型抗原结合型(BabA)、唾液酸结合型黏附素(SabA),他们能与胃黏膜上皮表达的Lewis抗原特异性结合,促进H. pylori在胃黏膜的长期根植[12-13];除此之外,细胞毒素相关基因L(CagL)、黏附相关脂蛋白(AlpA/B)、中性粒细胞激活蛋白(NA)等黏附因子均能与上皮表面特异性受体结合而促进H. pylori的黏附;相比之下,前炎性外膜蛋白A(OipA)、外膜蛋白B(HomB)和HopZ蛋白等,以及热休克蛋白60(Hsp60)的黏附受体还未明确,这些黏附因子不仅是H. pylori根植在胃黏液深层的主要原因,也是抗生素递送的常用靶点[14-16](图1和表1)。
Lin等[17]学者以岩藻糖为靶分子,通过识别H. pylori细胞壁表面的岩藻糖残基而达到对H. pylori的特异性根除,激光共聚焦显微镜下观察到该纳米粒在H. pylori感染的上皮细胞系内部产生强烈的荧光,证实了岩藻糖的修饰能够实现药物的靶向递送;体内外抑菌实验均证实了岩藻糖偶连的纳米粒的抑菌率显著高于游离的小檗碱溶液(P<0.05),并能明显降低胃组织中H. pylori的菌落数,有效减轻H. pylori感染引起的炎性细胞浸润[17]。在靶向前提下,H. pylori的根除需要高浓度的药物在胃黏膜内维持更长时间。果胶、醇溶蛋白等生物黏附载体能在实现特异性识别H. pylori的同时,使所载药物达到“胃滞留”效果。Gottesmann等[18]基于果胶的生物黏附性能,及其能与菌膜表面的黏附素BabA等发生特异性结合等特质,制备了果胶包衣的阿莫西林脂质体。研究在荧光显微镜和共聚焦显微镜下均观察到果胶包衣脂质体与H. pylori的共定位,说明两者发生特异性结合;体外黏液结合试验发现该脂质体与黏液蛋白结合后,粒径均从160 nm左右增大至700 nm,电位减小约50%,且其与人源结肠癌细胞(HT29-MTX)分泌的黏液的相互作用表现出明显的浓度依赖性,说明果胶的包被能显著提高该脂质体的胃黏膜黏附性,这可能进一步延长药物对H. pylori的靶向清除效能。此外,Umamaheshw等[19]基于醇溶蛋白优良的胃肠黏附性,采用两步碳二亚胺法分别制备了岩藻糖特异性(UEA-GNP)和甘露糖特异性凝集素结合的醇溶蛋白纳米粒(Con A-GNP)。凝集实验表明里两种凝集素纳米粒均能与H. pylori发生强烈结合反应,原位黏附试验证实了其显著的胃黏附特性,发现UEA-GNP和Con A-GNP均能竞争H. pylori在人胃细胞上的结合位点,减少H. pylori在胃部的定植,最终在12 h内达到了100%的抑制率。
2 基于尿素通道蛋白UreI的靶向策略
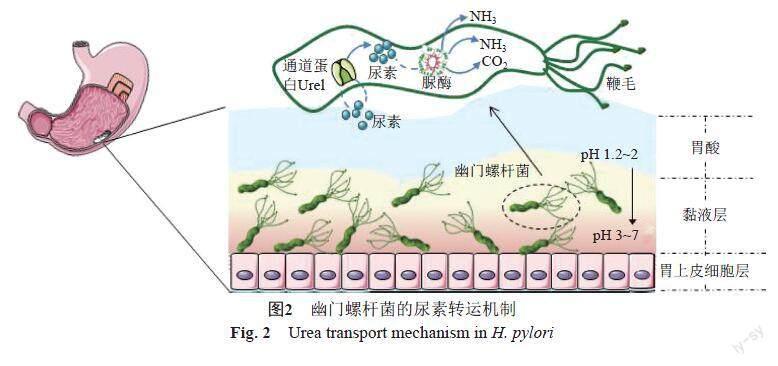
H. pylori可以表达尿素通道蛋白UreI,当幽门螺杆菌的外部pH降至弱酸时,UreI被激活,将环境中的尿素转运至胞内,在尿素酶的作用下将尿素分解为CO2和NH3,NH3进一步扩散至胞外形成“氨云”,改变胃中的酸性环境,从而利于自身的定植及繁殖[20-22](图2)。利用H. pylori通道蛋白UreI与尿素的特异性结合,将尿素基团偶连至药物分子,是对H. pylori进行靶向清除又一策略(图1-Ⅱ)。
壳聚糖分子链上的-NH2和-OH赋予了其极强的化学可修饰性,是脲基偶连的常用位点;而其生物黏附性使壳聚糖纳米粒作为药物载体,能在实现靶向清除H. pylori的同时,达到胃滞留的目的。Jing等[23]采用离子凝胶法制备了脲基偶连的阿莫西林-壳聚糖纳米粒(AMX -UCCs-2/NPs),以实现H. pylori的pH敏感化的靶向清除。结果表明环境pH降低时,大量的尿素通道蛋白UreI打开,导致H. pylori对脲基偶连纳米粒的摄取增加(P<0.05),摄取量与尿素浓度呈负相关,且具有温度依赖性,这可能源于37℃下UreI的活性最高;经AMX -UCCs-2/NPs干预后,小鼠胃组织中的菌落数显著降低(P<0.01),并能明显降低白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)等炎性因子表达水平,减轻H. pylori感染引起的胃组织损伤;活体成像下观察到AMX -UCCs-2/NPs在小鼠胃内滞留超过6 h [23],这归因于在胃酸环境下,壳聚糖表面携带的NH3+基团能与黏蛋白形成氢键并产生静电相互作用[24-26]。
此外,由于壳聚糖在酸性条件下的溶解限制,常通过衍生化改善,所得到的壳聚糖衍生物能在打破此应用局限的同时,进一步增强生物黏附性[27]。因此,通过脲基修饰后,进一步延长对H. pylori的靶向根除时间。Arif等[28]研究发现硫代化壳聚糖(Cys-CS)纳米粒对H. pylori的生长抑制率比壳聚糖纳米粒高了近2倍,这归因于Cys-CS在保留了壳聚糖生物黏附机制的同时,还能与黏蛋白之间形成二硫键,这进一步强化了载药纳米粒的胃滞留效应,从而提升抗菌药效的发挥[28]。Cong等[29]学者选用羧甲基壳聚糖(CMCS)作为骨架材料,以硬脂酸(SA)进行疏水改性,再通过NHS/EDC法进行尿素枝接,得到羧甲基壳聚糖-硬脂酸-尿素(U-CMCS-g-S)共聚物,超声处理后形成纳米胶束(UCS-NMs)。研究在共聚焦显微镜下观察到UCS-NMs与H. pylori的共定位,且其能在胃中滞留时间长达24 h,相比游离的克拉霉素,UCS-NMs的抗菌效力显著提升,浓度为24 μg/mL的UCS-NMs在30min内即可杀灭92.0%以上的H. pylori。
3 基于生物膜的靶向策略
H. pylori在根植过程中不断分泌一些蛋白质、多糖等形成胞外基质(EPS)将自身包裹其中,并在菌落表面形成一层膜状物,即为生物膜[30]。生物膜不仅对H. pylori的增殖生长起到保护作用,还能阻止抗生素的渗透,是造成H. pylori耐药的重要原因[31-32]。选择对H. pylori生物膜具有一定功能化的载体进行纳米给药系统的开发,能进一步提高抗生素对H. pylori的特异性根除,并逆转耐药(图1-Ⅲ)。如鼠李糖脂(RHL)已被报道对H. pylori生物膜具有破坏作用,基于此,Li等[33]选择RHL为纳米粒的壳层材料对克拉霉素(CLR)纳米粒进行包封。研究结果显示RHL作为壳层,在抑制生物膜形成、降低H. pylori生物膜生物量和活性、清除胞外基质等方面发挥着重要作用,且这种特异性破坏作用与RHL浓度呈正相关;CLR经RHL的包载后对生物膜内的H. pylori最大清除率达到97%。
金属纳米粒的量子效应、小尺寸效应和极大的表面积赋予了其突出的抗菌性能[34];它们可通过与细菌细胞壁直接作用、诱导适应性和先天免疫应答、产生活性氧、抑制生物膜形成等逆转耐药[35-36]。其中,纳米银是根除H. pylori最常见的金属纳米形式[37]。Gurunathan等[38]以青蒿叶提取物为生物还原剂,合成了银纳米粒(AgNPs),并且考察了该银纳米粒的抗H. pylori活性及其对H. pylori生物膜形成的影响。研究发现AgNPs对H. pylori的杀灭作用呈剂量依赖性上升,用5 μg/mL AgNPs处理H. pylori,24 h后发现其生物膜活性下降90%~95%,研究提出这可能与AgNPs能有效提高活性氧(ROS)释放诱导细菌细胞凋亡、抑制胞外多糖的产生有关[38]。但值得注意的是,金属纳米粒具有一定的肝肾毒性,而其对于胃细胞系的毒理研究还有待深入,因此,实际应用中,还需进一步考察其生物降解性并进行安全性评价。
除此之外,有研究证明一些无机矿物也能与H. pylori分泌的EPS发生特异性相互作用,他们通过疏水、静电、共价等分子间力作用实现靶向黏附,从而将药物靶向递送至H. pylori。Ping等[39]学者基于高度剥离蒙脱土(eMMT)对EPS的特异性识别和黏附,线性聚乙烯亚胺(lPEI)对脂多糖(LPS)的特异性溶解为依据,制备了负载甲硝唑(MTZ)的eMMT-lPEI纳米粒(eMMT-lPEI/MTZ)。该纳米粒首先通过对EPS的靶向识别而黏附于H. pylori,进一步通过lPEI溶解菌膜并形成跨膜通道,将抗生素输送到细胞质内达到杀菌作用。扫描电镜下几乎观察不到具有完整结构的H. pylori,而eMMT-lPEI/MTZ的干预明显减轻了H. pylori感染引起的胃组织损伤,使组织结构与正常水平相当。进一步检测发现,相比游离的MTZ,eMMT-lPEI/MTZ更大程度降低了小鼠体内的血清胃蛋白酶原I、胃蛋白酶原Ⅱ和胃泌素17的浓度,进而证实eMMT对EPS的靶向黏附以及lPEI链的对LPS的特异性溶解促进了甲硝唑抗菌药效的发挥。
4 基于细胞膜的靶向策略
H. pylori细胞膜是其摄取养分、排泄并进行信息传递的重要结构,直接破坏细胞膜能显著提高药物对H. pylori的靶向清除效力(图1-Ⅳ)。脂质体的磷脂双分子层形成了单层或多层球形囊泡, 赋予了脂质体对细菌细胞膜的天然亲和性,能显著改善药物的组织分布,提高细胞内抗菌活性,是此靶向策略下最常用纳米载体形式[40-41]。Seabra等[42-43]以棕榈酸甘油酯、辛酸/癸酸甘油酯、聚山梨酯60为原料,采用高剪切热均质超声法制备了空白脂质纳米粒(NLC)并考察其抗H. pylori活性。研究结果发现,低中浓度的NLC均能在不影响其他受试菌(乳杆菌、大肠埃希菌、表皮葡萄球菌和金黄色葡萄球菌)的生长情况下,达到对H. pylori的100%清除。該研究团队采用相同的方法进一步对二十二碳六烯酸(DHA)进行载药,其最小抑菌浓度仅为游离DHA的1/4;机制研究结果显示,空白和载药NLC均能通过与H. pylori菌膜结合,破坏其稳定性,导致膜破裂及细胞质渗漏,最终使细菌死亡。除了DHA,月桂酸、亚麻酸等游离脂肪酸也被证明相比抗生素,其诱导H. pylori产生耐药性的频率更低。Thamphiwatana等[44]学者研究制备了亚麻酸脂质体(LipoLLA)用于H. pylori的感染治疗,体外抗菌试验结果显示,LipoLLA能在30 min内杀灭99.9%的H. pylori;荧光显微镜的观察揭示这种抗菌机制在于LipoLLA能与细菌膜发生融合,破坏其结构完整性,这种高度破坏性机制能有效降低耐药性发展的敏感性。经该亚麻酸脂质体干预后,小鼠胃组织中白细胞介素1β、白细胞介素6和肿瘤坏死因子α等炎性因子的表达水平均显著降低(P<0.001),进一步说明LipoLLA在杀菌的同时也能改善H. pylori感染引起的炎症反应。
虽然脂质纳米粒具有低毒性、生物可降解性、生物相容性等优势,但其稳定性和靶向选择性能均需进一步强化。因此,选择细胞膜具有特异性的聚合物载体进行靶向修饰,也是实现药物对H. pylori靶向清除的有效方式。Chakraborti等[45]基于聚乙烯亚胺(PEI)的膜渗透性及其对革兰阴性细菌外膜LPS的靶向性,采用湿化学法制备了ZnO-PEI纳米粒。研究发现制备的ZnO-PEI纳米粒能有效地内化入H. pylori细胞中,同时产生大量的ROS,导致膜损伤和RNA降解,最终细菌膜形态转变为球形并失活,同时研究表明在毒理学安全浓度(20 mg/mL)下,ZnO-PEI纳米粒与其他抗生素联合使用,对H. pylori的根除具有显著的协同效应。
5 基于仿生膜的靶向策略
通过载体功能化修饰的纳米给药系统能使药物与H. pylori表面的受体发生相互作用,以此达到靶向效果,然而这种靶向载体始终存在着生物相容性的问题[46]。近年来,“仿生纳米粒”的出现为H. pylori的根除提供了更安全有效的靶向模式(图1-Ⅴ)。这种纳米粒由细胞膜、菌膜等的包被构建仿生型纳米递药系统,通过模拟内源性物质的生物学行为或复制病原体结构功能而获得对H. pylori的亲和力,从而将药物精准靶向至病灶部位,且不易被免疫系统识别,延长药物的体循环时间[47-49]。Angsantikul等[50]通过提取胃上皮细胞膜(AGS),并采用超声法将其包覆在负载CLR的PLGA聚合物核上,由此得到的仿生纳米粒(AGS-NP)具有与源AGS细胞表面相同的抗原,能对H. pylori进行靶向黏附。抗菌试验结果显示游离CLR和非仿生纳米粒均不能根除H. pylori,而AGS-NP的最小杀菌浓度(MBC)仅为4 μg/mL;口服6 d AGS-NP后,小鼠胃组织中的H. pylori含量降低了3.08个数量级,显示出了突出的靶向清除优势。此外,阻止H. pylori与宿主结合,或者充当H. pylori的黏附类似物,与细菌争夺宿主上的结合位点,以避免细菌的黏附定植,并促进免疫系统清除病原体,是从根源上达到杀菌作用的有效途径[51-52]。基于此,Zhang等[53]学者采用纳米沉淀法制备了PLGA纳米粒,并选用H. pylori外膜囊泡(OMV)作为仿生膜来源,通过超声作用融合到PLGA聚合物纳米粒上,结果发现经OMV包被的纳米粒能与AGS细胞系发生特异性结合,显著减少H. pylori在胃组织的定植量。此类抗黏附杀菌机制并不直接干扰细菌的杀灭周期,进而避免了耐药性的增强,与抗生素联合已经显示出协同作用。
6 总结与展望
目前,H. pylori的临床治疗多以抗生素为主的联合疗法为常用,但均不可避免需要高频率给药,且特异性低,导致患者耐受性差、H. pylori的高耐药性及低根除率等[54]。纳米制剂的靶向治疗被认为是提高H. pylori根除率的有效方法,但其研究仍处于临床前的探索阶段,还未有相关制剂批准上市。调查显示,目前进入临床试验阶段的纳米制剂多用于肿瘤及传染性疾病,且以脂质体制剂为主[55-57],仅有进入临床试验的纳米银制剂也多用于创面修复和感染性疾病的治疗[58-62]。尽管如此,纳米给药系统在实现H. pylori靶向清除的应用前景也不可忽视。
根据H. pylori的结构特征,本文综述了靶向根除H. pylori的策略,其中,基于H. pylori表面黏附因子、尿素通道蛋白UreI及生物膜的靶向策略,研究常采用特异性基团对药物载体进行修饰,或选择对H. pylori的结构具有破坏作用的功能化载体,从而达到对H. pylori的主动靶向。然而,可选择的配体是有限的,这使得以上靶向策略的实际应用受限;基于细胞膜的靶向策略以具有“膜亲和力”的脂质纳米载体为常见,但其靶向效率和稳定性是限制其应用的主要因素;基于仿生膜的靶向策略一般通过细胞膜与细菌病原体的包被而获取“天然靶向性”,其兼具纳米体系与生物体系优势,能减少机体对载药纳米粒的排斥反应,并降低毒副作用,是最安全有效的靶向模式,临床应用前景广阔。但值得注意的是,仿生膜的供应、提取方法以及仿生纳米粒的制备技术、表征手段等仍需深入研究,但宿主与病原体的黏附而使感染加重是各类病原菌的共性之一,因此,仿生纳米粒也为多种传染性疾病的治疗提供了新的参考[50]。总的来说,尽管针对H. pylori治疗的相关纳米制剂仍处于临床前研究阶段,但实现临床实践的跨越是机遇也是挑战,相信随着纳米制剂技术的不断成熟、“产学研”结合的不断深入以及临床经验的不断积累,将有望实现基础研究到产品化的过渡,开创纳米给药系统用于H. pylori靶向治疗的新局面。
参 考 文 献
[1]郭小丹. 中药根除幽门螺杆菌的研究(抑菌实验)[D]. 辽宁中医药大学, 2011.
[2]Lopes D, Nunes C, Martins M C L, et al. Eradication of Helicobacter pylori: Past, present and future[J]. J Control Release, 2014, 189: 169-186.
[3]Georgopoulos S D, Papastergiou V, Karatapanis S. Current options for the treatment of Helicobacter pylori[J]. Expert Opin Pharmacother, 2013, 14(2): 211-223.
[4]周雪亮, 周淵, 朱强, 等. 幽门螺旋杆菌的研究进展[J]. 中国继续医学教育, 2018, 10(33): 101-104.
[5]Zullo A, Hassan C, Ridola L, et al. Standard triple and sequential therapies for Helicobacter pylori eradication: An update[J]. Eur J Intern Med, 2013, 24(1): 16-19.
[6]Zhao S, Lv Y, Zhang J B, et al. Gastroretentive drug delivery systems for the treatment of Helicobacter pylori[J]. World J Gastroenterol, 2014, 20: 9321-9329.
[7]Armuzzi A, Cremonini F, Bartolozzi F, et al. The effect of oral administration of Lactobacillus GG on antibiotic-associated gastrointestinal side-effects during Helicobacter pylori eradication therapy[J]. Aliment Pharmacol Ther, 2001, 15(2): 163-169.
[8]丁曉蕊, 贾兴芳, 刘成霞. 幽门螺杆菌对抗生素的耐药机制进展研究[J]. 中外医疗, 2018, 37(20): 193-195+198.
[9]Thung I, Aramin H, Vavinskaya V, et al. Review article: The global emergence of Helicobacter pylori antibiotic resistance[J]. Aliment Pharmacol Ther, 2016, 43(4): 514-533.
[10]李战, 吴敏. 纳米技术和纳米中药的研究进展[J]. 上海中医药杂志, 2003, 37(1): 61-64.
[11]彭美萍, 李培源. 纳米技术在中药现代化应用的研究[J]. 广州化工, 2019, 47(19): 26-28.
[12]白韦钰. 幽门螺旋杆菌免疫逃逸机制研究进展[J]. 职业与健康, 2020, 36(16): 2297-2300.
[13]申玲玲, 赵福广. 幽门螺旋杆菌与胃溃疡的致病关系[J]. 生命的化学, 2019, 39(6): 1070-1075.
[14]吴利先. 幽门螺杆菌黏附机制及抗粘附剂研究[J]. 国外医学(流行病学传染病学分册), 2002, 29(2): 108-110.
[15]赵巧云, 谢勇. 幽门螺杆菌外膜蛋白与黏附机制的研究进展[J]. 上海交通大学学报(医学版), 2017, 37(2): 249-252.
[16]金麟. “幽门螺杆菌—胃黏膜上皮”生物界面黏附行为的研究[D]. 南方医科大学, 2014.
[17]Lin Y H, Lin J H, Chou S C, et al. Berberine-loaded targeted nanoparticles as specific Helicobacter pylori eradication therapy: In vitro and in vivo study[J]. Nanomedicine, 2015, 10(1): 57-71.
[18]Gottesmann M, Goycoolea F M, Steinbacher T, et al. Smart drug delivery against Helicobacter pylori: Pectin-coated, mucoadhesive liposomes with antiadhesive activity and antibiotic cargo[J]. Appl Microbiol Biotechnol, 2020,104 (13): 5943-5957.
[19]Umamaheshwari R B, Jain N K. Receptor mediated targeting of lectin conjugated gliadin nanoparticles in the treatment of Helicobacter pylori[J]. J Drug Target, 2003, 11 (7): 415-423; discussion 423-424.
[20]Schoep T D, Fulurija A, Good F, et al. Surface properties of Helicobacter pylori urease complex are essential for persistence[J]. PLoS One, 2010, 5(11): e15042.
[21]Weeks D L, Eskandari S, Scott D R, et al. A H+-gated urea channel: The link between Helicobacter pylori urease and gastric colonization[J]. Science, 2000, 287(5452): 482-485.
[22]Scott D R, Weeks D, Hong C, et al. The role of internal urease in acid resistance of Helicobacter pylori[J]. Gastroenterology, 1998, 114(1): 58-70.
[23]Jing Z W, Luo M, Jia Y Y, et al. Anti-Helicobacter pylori effectiveness and targeted delivery performance of amoxicillin-uccs-2/tpp nanoparticles based on ureido-modified chitosan derivative[J]. Int J Biol Macromol, 2018, 115: 367-374.
[24]Hady W E A, Mohamed E A, Soliman O A A, et al. In vitro-in vivo evaluation of chitosan-plga nanoparticles for potentiated gastric retention and anti-ulcer activity of diosmin[J]. Int J Nanomed, 2019, 14: 7191-7213.
[25]Zhang X, Sun M, Zheng A, et al. Preparation and characterization of insulin-loaded bioadhesive plga nanoparticles for oral administration[J]. Eur J Pharm Sci, 2012, 45: 632-638.
[26]李昕陽, 谢辉, 严国俊. 壳聚糖衍生物在生物黏附药物传输系统中的研究进展[J]. 中国药学杂志, 2014, 49(23): 2053-2057.
[27]TM M W, Lau W M, Khutoryanskiy V V. Chitosan and its derivatives for application in mucoadhesive drug delivery systems[J]. Polymers (Basel), 2018, 10(3): 267.
[28]Arif M, Dong Q J, Raja M A, et al. Development of novel ph-sensitive thiolated chitosan/pmla nanoparticles for amoxicillin delivery to treat Helicobacter pylori[J]. Mater Sci Eng C Mater Biol Appl, 2018, 83: 17-24.
[29]Cong Y, Geng J Y, Wang H Y, et al. Ureido-modified carboxymethyl chitosan-graft-stearic acid polymeric nano-micelles as a targeted delivering carrier of clarithromycin for Helicobacter pylori: Preparation and in vitro evaluation[J]. Int J Biol Macromol, 2019, 129: 686-692.
[30]Krzyzek P, Grande R, Migdal P, et al. Biofilm formation as a complex result of virulence and adaptive responses of Helicobacter pylori[J]. Pathogens, 2020, 9(12): 1062.
[31]Ji J, Yang H. In vitro effects of Lactobacillus plantarum LN66 and antibiotics used alone or in combination on Helicobacter pylori mature biofilm[J]. Microorganisms, 2021, 9(2): 424.
[32]Jin F, Yang H. Effects of Lactobacillus salivarius ln12 in combination with amoxicillin and clarithromycin on Helicobacter pylori biofilm in vitro[J]. Microorganisms, 2021, 9(8): 1611.
[33]Li P, Chen X, Shen Y, et al. Mucus penetration enhanced lipid polymer nanoparticles improve the eradication rate of Helicobacter pylori biofilm[J]. J Control Release, 2019, 300: 52-63.
[34]Tang S, Zheng J. Antibacterial activity of silver nanoparticles: Structural effects[J]. Adv Healthc Mater, 2018, 7(13): e1701503.
[35]Safarov T, Kiran B, Bagirova M, et al. An overview of nanotechnology-based treatment approaches against Helicobacter pylori[J]. Expert Rev Anti Infect Ther, 2019, 17 (10): 829-840.
[36]董浩博. 纳米金对非甾体抗炎药联合超声抑菌活性的影响及其机制研究[D]. 辽宁大学, 2020.
[37]Baptista P V, McCusker M P, Carvalho A, et al. Nano-strategies to fight multidrug resistant bacteria-“a battle of the titans”[J]. Front Microbiol, 2018, 9: 1441.
[38]Gurunathan S, Jeong J K, Han J W, et al. Multidimensional effects of biologically synthesized silver nanoparticles in Helicobacter pylori, helicobacter felis, and human lung (l132) and lung carcinoma a549 cells[J]. Nanoscale Res Lett, 2015, 10: 35.
[39]Ping Y, Hu X R, Yao Q, et al. Engineering bioinspired bacteria-adhesive clay nanoparticles with a membrane-disruptive property for the treatment of Helicobacter pylori infection[J]. Nanoscale, 2016, 8(36): 16486-16498.
[40]李尧, 肖义军. 药物脂质体载体的类型及脂质体药物的应用概述[J]. 生物学教学, 2020, 45(12): 2-4.
[41]Dos Santos Ramos M A, de Toledo L G, Sposito L, et al. Nanotechnology-based lipid systems applied to resistant bacterial control: A review of their use in the past two decades[J]. Int J Pharm, 2021, 603: 120706.
[42]Seabra C L, Nunes C, Bras M, et al. Lipid nanoparticles to counteract gastric infection without affecting gut microbiota[J]. Eur J Pharm Biopharm, 2018, 127: 378-386.
[43]Seabra C L, Nunes C, Gomez-Lazaro M, et al. Docosahexaenoic acid loaded lipid nanoparticles with bactericidal activity against Helicobacter pylori[J]. Int J Pharm, 2017, 519(1-2): 128-137.
[44]Thamphiwatana S, Gao W W, Obonyo M, et al. In vivo treatment of Helicobacter pylori infection with liposomal linolenic acid reduces colonization and ameliorates inflammation[J]. Proc Natl Acad Sci U S A, 2014, 111 (49): 17600-17605.
[45]Chakraborti S, Bhattacharya S, Chowdhury R, et al. The molecular basis of inactivation of metronidazole-resistant Helicobacter pylori using polyethyleneimine functionalized zinc oxide nanoparticles[J]. PLoS One, 2013, 8(8): e70776.
[46]Narain A, Asawa S, Chhabria V, et al. Cell membrane coated nanoparticles: Next-generation therapeutics[J]. Nanomedicine (Lond), 2017, 12(21): 2677-2692.
[47]魏潇萌, 丁维明, 李桂玲. 细胞膜仿生纳米粒的研究与应用[J]. 中国医药生物技术, 2017, 12(4): 337-341.
[48]冯毅, 冯华国, 张玲, 等. 细胞膜包被纳米粒的合成及应用研究进展[J]. 山东医药, 2020, 60(9): 104-107.
[49]Luk B T, Zhang L F. Cell membrane-camouflaged nanoparticles for drug delivery[J]. J Controlled Release, 2015, 220: 600-607.
[50]Angsantikul P, Thamphiwatana S, Zhang Q, et al. Coating nanoparticles with gastric epithelial cell membrane for targeted antibiotic delivery against Helicobacter pylori infection[J]. Adv Ther (Weinh), 2018, 1(2):1800016.
[51]Cusumano C K, Pinkner J S, Han Z, et al. Treatment and prevention of urinary tract infection with orally active fimh inhibitors[J]. Sci Transl Med, 2011, 3(109): 109ra115.
[52]Sharon N. Carbohydrates as future anti-adhesion drugs for infectious diseases[J]. Biochim Biophys Acta, 2006, 1760(4): 527-537.
[53]Zhang Y, Chen Y, Lo C, et al. Inhibition of pathogen adhesion by bacterial outer membrane-coated nanoparticles[J]. Angew Chem Int Ed Engl, 2019, 58(33): 11404-11408.
[54]Verma A, Dubey J, Hegde R R, et al. Helicobacter pylori: Past, current and future treatment strategies with gastroretentive drug delivery systems[J]. J Drug Target, 2016, 24(10): 897-915.
[55]Mi G J, Shi D, Wang M, et al. Reducing bacterial infections and biofilm formation using nanoparticles and nanostructured antibacterial surfaces[J]. Adv Healthc Mater, 2018, 7(13): e1800103.
[56]邢穎, 吴树仙, 李超, 等. 纳米药物研发与商业化趋势统计分析[J]. 工程研究-跨学科视野中的工程, 2017, 9(6): 586-600.
[57]孙慧萍, 张国喜, 程光, 等. 脂质体药物的制备方法及临床应用[J]. 中国医药工业杂志, 2019, 50(10): 1160-1171.
[58]王瑜歆. 纳米银类产品的临床应用[J]. 中国医疗器械信息, 2021, 27(15): 39-41.
[59]柯发军, 谢丹, 韩斌, 等. 重组牛碱性成纤维细胞生长因子凝胶联合纳米银敷料促进烧伤创面修复的临床分析[J]. 中国处方药, 2021, 19(1): 109-110.
[60]沈锦林. 纳米银抗菌剂治疗阴道炎的临床作用效果观察及有效性分析[J]. 人人健康, 2019, (11): 228.
[61]孙小勇, 耿立果, 张金凤, 等. 纳米银水凝胶联合α-受体阻滞剂治疗ⅲa型前列腺炎的临床效果[J]. 中国当代医药, 2019, 26(28): 84-86+97.
[62]邓凡. 纳米银敷料联合银离子水凝胶治疗深二度烧伤创面的临床疗效观察[J]. 临床医药文献电子杂志, 2020, 7 (21): 19.
