脑脊液骨桥蛋白与阿尔茨海默病的关系
2022-05-30李倩倩张钊胡浩郁金泰谭兰
李倩倩 张钊 胡浩 郁金泰 谭兰
[摘要] 目的 評估骨桥蛋白(OPN)是否可以作为阿尔茨海默病(AD)的早期生物标志物。方法 根据临床诊断和生物标志物水平,将纳入人群分为AD组、轻度认知功能障碍(MCI)+β-淀粉样蛋白(Aβ)阳性组(MCI Aβ+组)、MCI+Aβ阴性组(MCI Aβ-组)、认知正常(CN)+Aβ阳性组(CN Aβ+组)及CN+Aβ阴性组(CN Aβ-组),利用协方差分析比较OPN的组间差异。应用相关性分析检验非痴呆人群(包括MCI及CN)脑脊液(CSF)中OPN与AD相关生物标志物及海马体积的相关性。结果 MCI Aβ+组和AD组病人CSF中OPN水平均显著高于CN Aβ-组(H=15.473,P<0.01)。在横向分析中,非痴呆人群CSF中OPN水平与Aβ42水平呈负相关(r=-0.265,P<0.01),与总tau(t-tau)及磷酸化tau(p-tau)水平呈正相关(r=0.527、0.309,P<0.01)。在纵向分析中,非痴呆人群CSF中OPN水平与Aβ42及海马体积的变化率呈负相关(r=-0.129、-0.151,P<0.05),与t-tau和p-tau的变化率呈正相关(r=0.315、0.271,P<0.01)。结论 CSF OPN水平在AD早期阶段升高,并且与AD早期病理改变相关,是AD潜在的早期生物标志物。
[关键词]骨桥蛋白质;阿尔茨海默病;生物标记
[中图分类号]R745.7 [文献标志码]A [文章编号]2096-5532(2022)03-0383-04
doi:10.11712/jms.2096-5532.2022.58.052
ASSOCIATION BETWEEN CEREBROSPINAL FLUID OSTEOPONTIN AND ALZHEIMERS DISEASE
LI Qianqian, ZHANG Zhao, HU Hao, YU Jintai, TAN Lan
(Department of Neurology, Qingdao Municipal Hospital, Qingdao University, Qingdao 266071, China)
[ABSTRACT] Objective To investigate whether osteopontin (OPN) can be used as an early biomarker for Alzheimers di-sease (AD). Methods Based on clinical diagnosis and levels of biomarkers, the subjects enrolled were divided into AD group, mild cognitive impairment (MCI)+β-amyloid (Aβ)-positive group (MCI Aβ+group), MCI+Aβ-negative group (MCI Aβ-group), cognitive normal (CN)+Aβ-positive group (CN Aβ+group), and CN+Aβ-negative group (CN Aβ- group), and a cova-riance analysis was used to compare the difference in OPN between groups. A correlation analysis was used to investigate the correlation of OPN in cerebrospinal fluid (CSF) with AD-related biomarkers and hippocampal volume in the non-dementia population (the population with MCI or CN). Results The MCI Aβ+group and the AD group had a significantly higher level of OPN in CSF than the CN Aβ-group (H=15.473,P<0.01). In the cross-sectional analysis of the non-dementia population, OPN level in CSF was negatively correlated with Aβ42level (r=-0.265,P<0.01) and positively correlated with the levels of total tau (t-tau) and phosphorylated tau (p-tau) (r=0.527,0.309;P<0.01). In the longitudinal analysis of the non-dementia population, OPN level in CSF was negatively correlated with the rates of change of Aβ42and hippocampal volume (r=-0.129,-0.151;P<0.05) and was positively correlated with the rates of change in t-tau and p-tau (r=0.315,0.271;P<0.01). Conclusion There is an increase in the level of OPN in CSF in the early stage of AD, which is associated with early pathological changes of AD, and therefore, it can be used as a potential early biomarker for AD.
[KEY WORDS] osteopontin; Alzheimer disease; biomarkers
阿尔茨海默病(AD)是一种以脑脊液(CSF)蛋白(包括β-淀粉样蛋白(Aβ)和tau蛋白)改变、进行性脑萎缩及认知功能下降为特征的慢性神经退行性疾病[1]。目前AD还没有有效的治疗药物[2]。因此,应加强AD痴呆的早期诊断和预测。骨桥蛋白(OPN)是一种细胞因子,参与多种生理和病理过程[3-5]。先前的研究结果显示,OPN在人类及动物的AD中都起着重要的作用[6-7]。有动物研究结果显示,不管是在基因还是蛋白水平上,APP/PS1KI小鼠的OPN水平均有显著升高[8]。在AD小鼠脑组织中,OPN染色强度与Aβ负荷呈显著正相关,OPN在AD病人大脑皮质中的表达也显著增加[6]。SIMONSEN等[9]使用CSF样本进行蛋白质组学分析结果显示,从轻度认知功能障碍(MCI)进展到AD的病人OPN的磷酸化C末端片段水平比认知状态稳定的病人高。上述研究均提示OPN参与了AD的发生和发展。然而,OPN与AD早期病理改变之间关系的研究较少。故本研究通过比较不同临床诊断和生物标志物水平人群OPN水平的差异,分析OPN与AD生物标志物的相關性,来进一步探讨OPN是否可以作为AD的早期生物标志物。
1资料和方法
1.1数据来源
分析使用的数据来自ADNI数据库(https://adni.loni.usc.edu)。ADNI是一项纵向多中心研究,旨在探索开发用于AD早期诊断及病情监测的临床、影像表现和生物标记物等,其参与者来自美国及加拿大的57个地区。ADNI获得了所有参与机构的地区伦理委员会的批准,以及所有研究参与者的书面知情同意。本文研究对象来自ADNI-1队列。
1.2研究对象及分组
本研究纳入了同时含有CSF OPN(或者血浆OPN)、年龄、性别、受教育年限、诊断、APOE ε4携带状态及CSF核心AD生物标志物等信息的受试者,并在分析中采用平均值±3倍标准差的方法排除OPN值异常的受试者。根据CSF Aβ42浓度将受试者分为Aβ阳性(Aβ42≤192 ng/L)和Aβ阴性(Aβ42>192 ng/L)组[10]。鉴于Aβ阴性的AD病人有误诊可能,将这部分人群也排除。最终纳入的含有CSF OPN 数据的人群包括91例对照、149例MCI病人和65例AD病人;含有血浆OPN 数据的人群包括58例对照、194例MCI病人和98例AD病人;含有神经影像学数据的人群包括82例对照及117例MCI病人。 根据临床诊断和生物标志物水平,将纳入人群分为AD组、MCI+Aβ阳性组(MCI Aβ+组)、MCI+Aβ阴性组(MCI Aβ-组)、认知正常(CN)+Aβ阳性组(CN Aβ+组)及 CN+Aβ阴性组(CN Aβ-组)。
1.3CSF及血浆生物标志物检测
CSF及血浆样本根据ADNI生物标志物核心实验室标准操作程序进行处理、分装和储存。Aβ42、总tau(t-tau)和磷酸化tau(p-tau)及OPN的检测方法参见相关文献[10]。本研究纳入了基线及12、24、36、48和60个月时CSF中Aβ42、t-tau和p-tau的检测数据,并纳入了CSF及血浆中OPN的基线检测数据。
1.4海马体积测量
使用1.5 T磁共振成像系统采集脑结构图像,使用freesurfer软件 (https://surfer.nmr.mgh.athe-rard.edu/)对脑体积进行量化[11]。本研究纳入了基线及6、12、18、24、36、48、60和72个月时的检测数据,所使用的数据为左右海马的平均体积。
1.5数据统计分析
使用R软件(版本3.5.3)来分析数据。分类变量的组间比较采用卡方检验;连续变量的组间比较采用Kruskal-Wallis检验和协方差分析。在横向分析(对基线数据进行分析)中,首先用Spearmans相关分析初步检验非痴呆人群(包括MCI及CN)CSF和血浆中OPN水平与CSF中Aβ42、t-tau、p-tau水平及海马体积的相关性,然后进行多元线性回归分析,进一步检验OPN与CSF中Aβ42、t-tau、p-tau水平和海马体积的关系。在回归分析中,连续反应变量首先要经Kolmogorov-Smirnov检验是否符合正态分布,如不符合正态分布,则通过Box-Cox变换来满足近似正态性。在纵向分析中,使用线性混合模型计算非痴呆人群CSF中Aβ42、t-tau、p-tau水平和海马体积的纵向变化率,再进一步与OPN进行Spearmans相关分析。在进行协方差分析、回归分析以及线性混合模型分析时均对年龄、性别、受教育程度、诊断和APOE ε4携带状态进行校正。P<0.05表示差异有统计学意义。
2结果
2.1各组临床资料比较
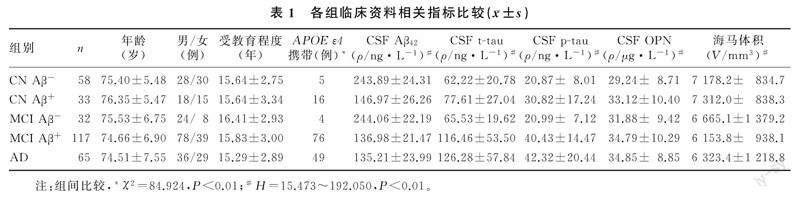
各组APOE ε4携带状态比较,差异有统计学意义(χ2=84.924,P<0.01)。各组CSF中Aβ42、t-tau、p-tau水平以及海马体积比较差异均具有统计学意义(H=44.037~192.050,P<0.01)。MCI Aβ+和AD组病人CSF OPN水平均显著高于CN Aβ-组(H=15.473,P<0.01)。各组年龄、性别及受教育程度比较差异均无统计学意义(P>0.05)。见表1。
2.2各组CSF OPN比较
以CN Aβ-组为对照,将年龄、性别、受教育程度和APOE ε4携带状态等研究表明与AD有关的因素纳入到协方差分析中来调整混杂。结果显示,AD及MCI Aβ+组CSF OPN水平均显著高于CN Aβ-组(F=12.329、12.291,P<0.01),而MCI Aβ-及CN Aβ+组CSF OPN水平与CN Aβ-组比较差异无显著性(P>0.05)。
2.3CSF OPN与核心AD生物标志物的相关性
2.3.1横向分析在非痴呆人群、MCI组及CN组中,CSF OPN与CSF t-tau水平均呈正相关(r=0.404~0.574,P<0.01)。在非痴呆人群以及MCI组中,CSF OPN均与CSF Aβ42水平呈负相关(r=-0.265、-0.256,P<0.01),与CSF p-tau水平呈正相关(r=0.309、0.399,P<0.01)。但在CN组中,CSF OPN与CSF Aβ42及CSF p-tau水平均无相关性(P>0.05)。
进一步的多元线性回归分析显示,非痴呆人群CSF中OPN与Aβ42、t-tau和p-tau水平均顯著相关(β=-0.004、0.020、0.006,P<0.05)。亚组分析显示,MCI组CSF中OPN与t-tau及p-tau水平显著相关(β=0.025、0.013,P<0.01),而与Aβ42水平无相关性(P>0.05);CN组CSF中OPN与t-tau水平显著相关(β=0.013,P<0.01),而与Aβ42及p-tau水平无相关性(P>0.05)。
2.3.2纵向分析在非痴呆人群中,高的基线CSF OPN水平与CSF中p-tau和t-tau水平的快速升高相关(r=0.271、0.315,P<0.01),并且与CSF Aβ42水平的快速下降相关(r=-0.129,P<0.05)。亚组分析显示,MCI组高的CSF OPN水平与CSF中p-tau水平的快速升高相关(r=0.357,P<0.01);CN组高的CSF OPN水平与CSF中Aβ42水平的快速下降相关(r=-0.217,P<0.05),并与t-tau水平的快速升高相关(r=0.366,P<0.01)。
2.4血浆OPN与核心AD生物标志物的相关性
在非痴呆人群中,血浆OPN的水平与CSF中Aβ42、t-tau和p-tau的基线水平均无相关性(P>0.05),与CSF中p-tau、t-tau及Aβ42的变化率也均无相关性(P>0.05)。
2.5OPN与海马体积的相关性
横向分析显示,在非痴呆人群中,CSF和血浆中OPN水平与海马体积均无相关性(P>0.05);纵向分析显示,CSF OPN水平的升高与海马体积加速萎缩相关(r=-0.151,P<0.05),而血浆OPN水平与海马体积变化无关(r=0.068,P>0.05)。
3讨论
目前的医疗技术尚不能逆转AD的疾病进程。近年来众多关于AD疾病修饰治疗药物的临床试验最终也以失败告终。与此同时,众多的流行病学研究结果表明AD是可以预防的,可以通过利用保护因素并控制危险因素来降低疾病的发生率。因此,有助于AD早期诊断的生物标志物对疾病防治有重要意义。业已证实,OPN参与了AD的发生及发展。本文研究结果显示,AD和MCI Aβ+组的CSF OPN水平均明显高于CN Aβ-组。这与AD病人CSF OPN水平显著高于CN组这一先前研究结果相一致[12-13]。提示CSF OPN水平增高可作为诊断或者识别AD高危人群的指标。本研究及先前的一项研究均未显示AD病人和对照组之间血清OPN浓度差异有显著性[12]。然而,另一项研究表明,新近诊断AD病人的血浆OPN浓度显著高于CN组[13]。这种不一致可能是由于血浆OPN更容易受到其他因素的影响,如骨重塑、伤口愈合、癌症生物学反应、血管紊乱和炎症性疾病[14-15]。因此,血浆OPN与AD的关系需要更多的研究来进一步探讨。
以往的研究表明,AD核心生物标志物Aβ42、p-tau和t-tau也是AD早期病理改变的生物标志物,均已被纳入到ATN诊断体系中[16]。因此,本研究探讨了OPN与这些生物标志物的关系,以进一步研究OPN是否参与AD的早期病理改变。本研究结果显示,在非痴呆人群中,CSF OPN与CSF中Aβ42、p-tau和t-tau水平显著相关,提示CSF OPN与AD的早期病理改变相关。此外,纵向分析显示,高的CSF OPN水平与CSF中t-tau和p-tau水平的加速升高以及CSF中Aβ42水平的加速下降显著相关。虽然之前并没有类似的研究报道,但是先前的研究仍然可以为本研究提供证据支持。有动物研究表明,OPN在APP/PS1KI小鼠中表达上调[8];并且有研究发现,在AD模型中OPN是巨噬细胞参与Aβ清除的关键免疫调节因子[6]。此外,有尸检研究结果显示,OPN在AD病人大脑锥体神经元中的表达增加[7]。还有研究结果显示,从MCI进展到AD病人的CSF OPN表达增加[13]。上述研究表明,CSF OPN可能通过影响AD的早期病理改变参与AD的发生发展。
本文研究结果还显示,在非痴呆人群中,基线CSF OPN水平与海马萎缩的速率有关。先前有研究证实,通过MRI评估的脑萎缩是AD相关神经变性的有效标志[17]。CSF OPN水平与海马体积的变化率呈负相关,提示CSF OPN促进AD相关神经退行性变。综合以上研究结果,CSF OPN可能通过参与Aβ和tau病理改变而影响海马结构。OPN影响AD发生的途径很复杂,其确切的机制还有待进一步研究。
综上所述,CSF OPN在AD早期阶段水平升高,并且与AD早期病理改变相关,本研究进一步证明了CSF OPN是AD潜在的早期生物标志物,具有监测AD病理进展和判断预后的潜力。该生物标志物可能对AD临床研究、药物开发等具有一定的作用。
[参考文献]
[1]Alzheimers Association. 2016 Alzheimers disease facts and figures[J]. Alzheimers Dement, 2016,12(4):459-509.
[2]AN N, JIN L Q, YANG J Y, et al. Data platform for the research and prevention of Alzheimers disease[J]. Advances in Experimental Medicine and Biology, 2017,1028:55-78.
[3]XANTHOU G, ALISSAFI T, SEMITEKOLOU M, et al. Osteopontin has a crucial role in allergic airway disease through regulation of dendritic cell subsets[J]. Nature Medicine, 2007,13(5):570-578.
[4]SHINOHARA M L, LU L R, BU J, et al. Osteopontin expression is essential for interferon-alpha production by plasmacytoid dendritic cells[J]. Nature Immunology, 2006,7(5):498-506.
[5]CASTELLO L M, RAINERI D, SALMI L, et al. Osteopontin at the crossroads of inflammation and tumor progression[J]. Mediators of Inflammation, 2017, 2017:4049098.
[6]RENTSENDORJ A, SHEYN J, FUCHS D T, et al. A novel role for osteopontin in macrophage-mediated amyloid-β clea-rance in Alzheimers models[J]. Brain, Behavior, and Immunity, 2018,67:163-180.
[7]WUNG J, PERRY G, KOWALSKI A, et al. Increased expression of the remodeling-and tumorigenic-associated factor osteopontin in pyramidal neurons of the Alzheimers disease brain[J]. Current Alzheimer Research, 2007,4(1):67-72.
[8]WIRTHS O, BREYHAN H, MARCELLO A, et al. Inflammatory changes are tightly associated with neurodegeneration in the brain and spinal cord of the APP/PS1KI mouse model of Alzheimers disease[J]. Neurobiology of Aging, 2010,31(5):747-757.
[9]SIMONSEN A H, MCGUIRE J, HANSSON O, et al. Novel panel of cerebrospinal fluid biomarkers for the prediction of progression to Alzheimer dementia in patients with mild cognitive impairment[J]. Archives of Neurology, 2007,64(3):366-370.
[10]SHAW L M, VANDERSTICHELE H, KNAPIK-CZAJKA M, et al. Cerebrospinal fluid biomarker signature in Alzheimers disease neuroimaging initiative subjects[J]. Annals of Neurology, 2009,65(4):403-413.
[11]SIMMONS A, WESTMAN E, MUEHLBOECK S, et al. MRI measures of Alzheimers disease and the AddNeuroMed study[J]. Annals of the New York Academy of Sciences, 2009,1180:47-55.
[12]COMI C, CARECCHIO M, CHIOCCHETTI A, et al. Osteopontin is increased in the cerebrospinal fluid of patients with Alzheimers disease and its levels correlate with cognitive decline[J]. Journal of Alzheimers Disease: JAD, 2010,19(4):1143-1148.
[13]SUN Y, YIN X S, GUO H, et al. Elevated osteopontin levels in mild cognitive impairment and Alzheimers disease[J]. Mediators of Inflammation, 2013, 2013:615745.
[14]WOLAK T. Osteopontin-a multi-modal marker and mediator in atherosclerotic vascular disease[J]. Atherosclerosis, 2014,236(2):327-337.
[15]BERGLUND L M, LYSSENKO V, LADENVALL C, et al. Glucose-dependent insulinotropic polypeptide stimulates osteopontin expression in the vasculature via endothelin-1 and CREB[J]. Diabetes, 2016,65(1):239-254.
[16]JACK C R Jr, BENNETT D A Jr, BLENNOW K Jr, et al. NIA-AA research framework: toward a biological definition of Alzheimers disease[J]. Alzheimers & Dementia, 2018,14(4):535-562.
[17]WHITWELL J L, DICKSON D W, MURRAY M E, et al. Neuroimaging correlates of pathologically defined subtypes of Alzheimers disease: a case-control study[J]. The Lancet Neurology, 2012,11(10):868-877.
(本文編辑马伟平)