知母多糖复合酶提取工艺优化及其免疫活性
2022-05-29王歆彤李朋月吴兰芳武英杰郑玉光刘丛颖严玉平景松松
王歆彤,李朋月,吴兰芳,武英杰,郑玉光,3,刘丛颖,严玉平, ,景松松,
(1.河北中医学院药学院,河北石家庄 050200;2.河北中医学院河北省中药炮制技术创新中心,河北石家庄 050200;3.河北化工医药职业技术学院,河北石家庄 050026)
知母为百合科知母(Anemarrhena asphodeloidesBunge)的干燥根茎,为药食两用的药材,具有清热泻火,滋阴润燥的功效[1]。研究表明其主要含有甾体皂苷类、双苯吡酮类、木脂素类、黄酮类、多糖类等有效成分,多糖为主要有效成分之一[2−3]。药理实验表明,知母多糖具有明显的降血糖、抗炎和抗氧化等活性[4−7]。尤其是,知母多糖还具有良好的免疫活性,实验表明热水提取知母多糖可以促进小鼠巨噬细胞RAW264.7 释放NO,促进分泌因子IL-1、IL-6、TNF-α、IL-1β和COX-2 的表达,进而增强巨噬细胞的免疫活性[8−9]。
知母多糖提取主要方法包括热水提取、超声波提取[10−11]。热水提取需要高温、提取时间长,可能导致非活性成分的共提取,并对活性成分产生不利影响[12];超声波提取方法要求设备复杂,较难实现工业化。酶辅助提取具有操作简单、高效、环境友好、易于保持多糖结构的优点,酶辅助提取多糖已经成为研究热点[13]。由于植物细胞壁组成结构复杂,单一酶破解细胞壁及细胞膜结构较难,易导致成分溶出不完全。复合酶解法可针对植物细胞壁组成和结构,充分破坏植物细胞结构,条件温和,在多糖提取率提高的同时,可有效保护多糖的结构和活性[14]。其中,纤维素酶、果胶酶、木瓜蛋白酶为常用酶类[15−17]。目前,对知母多糖成分的研究,主要集中在热水提取知母多糖的结构研究及其药理活性方面,而针对复合酶提取知母多糖未见报道,知母多糖的复合酶提取工艺有待研究。
本研究采用正交试验确定复合酶(纤维素酶、果胶酶、木瓜蛋白酶)配比,通过单因素实验和响应面法优化建立一种新的复合酶法提取知母多糖的工艺,同时采用小鼠巨噬细胞RAW264.7 对复合酶提取知母多糖进行初步的免疫活性评价,以期为知母多糖的进一步研究开发利用提供参考。
1 材料与方法
1.1 材料与仪器
知母 采自河北张家口市尚义县;经严玉平教授鉴定为百合科知母Anemarrhena asphodeloidesBunge 的干燥根茎;果胶酶(40 U/mg)、纤维素酶(3 U/mg)、木瓜蛋白酶(80×104U/g)、DEAE-52 纤维素、脂多糖 北京索莱宝科技有限公司。
VICTOR NivoTM酶标仪 珀金埃尔默有限公司;EYELA 旋转蒸发仪、EYELA 水浴锅 上海爱朗仪器有限公司;Eppendorf Centrifuge 5804 R 冷冻型多动能台式离心机 德国艾本德股份公司。
1.2 实验方法
1.2.1 复合酶提取知母粗多糖工艺 知母根茎去除杂质,切厚片(0.4 cm),置于50 ℃烘箱烘干,粉碎过40 目筛。预处理方法:取干燥的知母粉末500.00 g,加10 倍体积80%乙醇进行脱脂,干燥滤渣得脱脂知母残渣,备用。参考复合酶提取多糖工艺[17−18],称取一定量的复合酶(纤维素酶、果胶酶、木瓜蛋白酶),加入pH 为5.5 的柠檬酸-磷酸氢二钠缓冲盐,在一定的温度下恒温酶解一定的时间,沸水浴灭酶10 min。酶提液过滤,浓缩,放置室温。加入4 倍无水乙醇,在4 ℃冰箱放置24 h,4200 r/min 离心10 min,将沉淀用80%的乙醇洗涤3 次,去离子水复溶,采用3500 Da 透析袋透析,冻干后即得知母粗多糖(APSE)。多糖得率计算公式:多糖得率(%)=(提取得到的知母多糖质量/脱脂原料质量)×100
1.2.2 复合酶添加量的优化
1.2.2.1 单因素实验 a.木瓜蛋白酶辅助提取:取5.00 g 预处理的知母粉末,保持液料比15:1(mL/g)、温度55 ℃和酶解时间1.5 h 不变,以木瓜蛋白酶的添加量(4000、8000、12000、16000、20000 U/g)为自变量,按照 1.2.1 的实验步骤进行操作,测定多糖得率。
b.纤维素酶辅助提取:取5.00 g 预处理的知母粉末,保持液料比15:1(mL/g)、温度55 ℃和酶解时间1.5 h 不变,以纤维素酶的添加量(750、900、1050、1200、1350 U/g)为自变量,按照 1.2.1 的实验步骤进行操作,测定多糖得率。
c.果胶酶辅助提取:取5.00 g 预处理的知母粉末,保持液料比15:1(mL/g)、温度55 ℃和酶解时间1.5 h 不变,以果胶酶的添加量(400、800、1200、1600、2000 U/g)为自变量,按照 1.2.1 的实验步骤进行操作,测定多糖得率。
d.复合酶辅助提取及单酶对比:取5.00 g 预处理的知母粉末,保持液料比15:1(mL/g)、温度55 ℃和酶解时间1.5 h 不变,添加木瓜蛋白酶、纤维素酶和果胶酶(根据1.2.2.1 中a、b、c 的试验结果确定添加量),按照 1.2.1 的实验步骤进行操作,测定多糖得率。对比分析各单酶以及复合酶对知母多糖的影响。
1.2.2.2 正交试验设计复合酶浓度 在单因素实验的基础上,以木瓜蛋白酶(A)、纤维素酶(B)和果胶酶(C)添加量为自变量,以知母多糖得率为因变量,进行三因素三水平正交试验,确定最佳复合酶配比,试验设计见表1。

表1 L9(34)正交试验因素水平及编码Table 1 The factors and levels of L9(34) orthogonal experiment
1.2.3 复合酶提取条件的优化
1.2.3.1 单因素实验 a.酶解温度:取5 g 经预处理的知母粉末,固定上述最佳酶配比,液料比为15:1(mL/g),提取时间为2 h。考察酶解温度(45、50、55、60、65 ℃)对多糖得率的影响。
b.酶解时间:取5 g 经预处理的知母粉末,固定上述最佳酶配比,酶解温度55 ℃,液料比为15:1(mL/g)。考察酶提取时间(1.0、1.5、2.0、2.5、3.0 h)对多糖得率的影响。
c.液料比:取5 g 经预处理的知母粉末,固定上述最佳酶配比,酶解温度55 ℃,提取时间2 h。考察液料比(10:1、15:1、20:1、25:1、30:1 mL/g)对多糖得率的影响。
1.2.3.2 Box-Behnken 响应面优化试验设计 在单因素优化实验基础上,选取液料比(A)、酶解时间(B)和酶解温度(C)作为Box-Behnken 响应面试验设计的3 个自变量,通过响应面试验设计建立知母多糖得率(Y)与自变量之间的函数关系[19]。响应面试验因素与水平见表2。

表2 Box-Behnken 试验设计因素水平表Table 2 Factor and level table of Box-Behnken experimental design
1.2.4 知母多糖的分离纯化 采用DEAE-52 纤维素阴离子交换层析柱对知母粗多糖进行初步分离[20]。配制质量浓度为20.0 mg/mL 溶液,分别以蒸馏水、0.05、0.1、0.2、0.3、0.5 和0.8 mol/L NaCl 溶液梯度洗脱,设置流速为1 mL/min,每管收集10 mL。根据苯酚-硫酸法[21]检测总糖含量。
1.2.5 知母多糖对RAW 264.7 巨噬细胞的免疫活性
1.2.5.1 细胞复苏和培养 将液氮中冻存的RAW264.7巨噬细胞,迅速解冻,37 ℃水浴1~2 min 使其融化。细胞解冻后,用75%酒精擦拭外壁,转移无菌操作台。将细胞转移至离心管中,加入DMEM 完全培养基(含10%胎牛血清,1%青-链霉素),1000 r/min离心5 min,弃去上清液,加入完全培养基重悬细胞,转移至培养瓶,37 ℃、5% CO2培养箱中培养,取对数生长期的细胞用于后续实验。
1.2.5.2 细胞增殖实验 采用MTT 法[22]检测APSE-0、APSE-1、APSE-2 和APSE-3 的细胞存活率。细胞以2×105个/mL 接种于96 孔板中,每孔100 μL,置于培养箱中培养24 h 后,弃去上清液。设置对照组(DMEM 培养基)、脂多糖组(Lipopolysaccharide,LPS,1 μg/mL)和试验组(APSE-0、APSE-1、APSE-2、APSE-3:1、10、50、100、250、500 μg/mL),每组设置3 个重复孔,继续培养24 h。吸取上清液,每孔加入10 μL 5 mg/mL 的噻唑蓝试剂(MTT),在培养箱中继续孵育4 h。去除上清液后,每孔加入150 μL二甲基亚砜(DMSO),充分振荡3 min,在490 nm波长处测定吸光度。细胞增殖率(%)=(试验组OD 值/细胞对照组OD 值)×100
1.2.5.3 NO 释放量检测 采用Griess 法[23]测定上清液中NO 的含量。将RAW264.7 细胞(5×105个/mL)接种在96 孔板,每孔100 μL,培养24 h。设置对照组、LPS 组(1 μg/mL)和 试 验 组(APSE-0、APSE-1、APSE-2、APSE-3:1、10、50、100、250、500 μg/mL),每组设置3 个复孔,继续培养24 h。收集上清液与Griess Ⅰ(5%磷酸中含1%磺胺嘧啶)和GriessⅡ(蒸馏水中含0.1% 1-萘二酰胺二盐酸盐)混合。10 min 后,在540 nm 波长下测定吸光度。根据标准曲 线(y=0.0165x−0.0226,R2=0.999)计 算 各 组 分NO 的相对释放量。
1.3 数据处理
单因素实验和免疫活性试验分别采用Origin 2021 和GraphPad Prism 8.3.0 进行数据处理和绘图,数据以平均值±标准差(SD)表示;响应面试验数据利用Design-Expert 8.0.6 进行响应面设计及参数优化和统计分析;试验均重复3 次。
2 结果与分析
2.1 复合酶添加量配比优化
2.1.1 酶添加量对知母多糖得率的影响 纤维素、果胶是植物细胞壁的主要构成物质,纤维素酶可以高效地破坏细胞壁的组织结构,加快知母多糖的溶出[24];果胶酶更多的是协同分解果胶为半乳糖醛酸等小分子,破坏知母细胞壁,分解细胞壁上的多糖基质;木瓜蛋白酶不仅对多糖的提取起辅助作用,还能够有效酶解与多糖结合在一起的蛋白质,从而将多糖释放出来,提高多糖得率。纤维素酶、果胶酶和木瓜蛋白酶添加量对知母多糖提取效果的影响见图1,不同种类以及不同添加量的酶对知母多糖有明显的影响,其中,木瓜蛋白酶添加量为8000 U/g 时多糖得率达到最高,随着酶浓度的持续增加,多糖得率逐渐降低;纤维素酶添加量在750~1200 U/g 范围内,多糖得率持续增加,添加量大于1200 U/g 时多糖得率变化较为平缓;果胶酶添加量在400~1200 U/g 时,多糖得率随着添加量的增加而增加,继续增加后多糖得率略有降低。因此,3 种单一酶的最佳添加量分别为木瓜蛋白酶添加量为8000 U/g,纤维素酶添加量为1200 U/g,果胶酶添加量为1200 U/g。

图1 酶添加量对知母多糖得率的影响Fig.1 Effect of enzyme addition on the extraction yield ofAnemarrhena asphodeloidesBunge polysaccharide
木瓜蛋白酶、纤维素、果胶酶及复合酶(木瓜蛋白酶8000 U/g,纤维素酶1200 U/g,果胶酶1200 U/g)分别酶解知母制备知母多糖得率见图2。实验结果表明:3 种酶的复合酶提取效果最好,知母多糖得率为(9.81%±0.09%),均显著大于纤维素酶(8.88%±0.10%)、木瓜蛋白酶(5.05%±0.05%)和果胶酶(3.37%±0.11%)(P<0.05)。从生产效率的角度出发,选取3 种酶的复合酶对提取制备知母多糖的工艺进行优化。

图2 果胶酶、木瓜蛋白酶、纤维素酶及复合酶对知母多糖得率的影响Fig.2 The effect of pectinase, papain, cellulase and compound enzymes added on the extraction yield ofAnemarrhenaasphodeloidesBunge polysaccharide
2.1.2 复合酶添加量配比对知母多糖得率的影响根据单因素实验结果,对木瓜蛋白酶(A)、纤维素酶(B)和果胶酶(C)3 个因素进行正交试验,以确定最佳酶配比,正交试验设计以及结果见表3。分析可知,影响知母多糖主次因素依次是果胶酶(C)>木瓜蛋白酶(A)>纤维素酶(B)。最佳酶解条件为A3B2C3,因此,确定最佳复合酶的比例为木瓜蛋白酶16000 U/g,纤维素酶1200 U/g,果胶酶1600 U/g。在此复合酶比例条件下进行验证试验,重复3 次,测得知母多糖得率为(10.19%±0.03%)。

表3 L9(34)正交试验结果Table 3 L9(34)orthogonal experiment results
2.2 酶解条件优化结果
2.2.1 单因素实验结果
2.2.1.1 酶解温度对知母多糖提取的影响 由图3可知,多糖的得率在40~55 ℃之间随温度的升高而增加,当提取温度为55 ℃时,多糖得率最高,温度在55~65 ℃时,多糖得率迅速下降。这可能是由于复合酶在55 ℃时活性最强,分解细胞壁效果最佳。当温度进一步升高时,酶蛋白开始受热变性,使得酶活性逐渐降低,导致多糖得率下降[25]。故选择酶解温度50~60℃进行响应面试验。

图3 酶解温度对知母多糖得率的影响Fig.3 Effect of enzymolysis temperature on the extraction yield ofAnemarrhena asphodeloidesBunge polysaccharide
2.2.1.2 酶解时间对知母多糖提取的影响 时间处理也是提取知母多糖的一个重要因素。文献研究表明[26],较长的酶处理时间有利于多糖的产生。由图4可知,1~2 h 得率随酶解时间的升高而增加,当提取时间持续增加时,多糖得率有所降低,这可能是由于酶解时间过长,多糖稳定性下降,结构部分易被破坏,致使得率降低[27]。故选择酶解时间1.5~2.5 h 进行响应面试验。
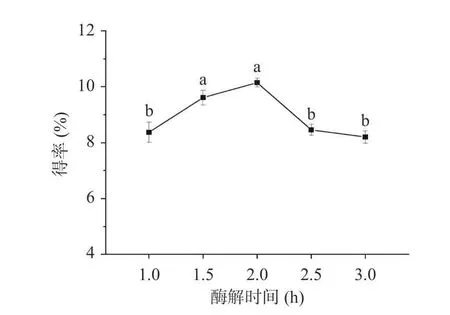
图4 酶解时间对知母多糖得率的影响Fig.4 Effect of enzymolysis time on the extraction yield ofAnemarrhena asphodeloidesBunge polysaccharide
2.2.1.3 液料比对知母多糖提取的影响 如图5 所示,多糖得率最初呈上升趋势,在15:1 mL/g 时达到最大值。这可能是因溶剂增多扩大了反应体系中知母多糖与复合酶的接触面积,随着液料比的增加,提取液粘度降低,多糖分子更多的被溶出。当溶剂用量超过一定范围时,会使得复合酶的质量浓度明显降低,进而影响到酶的催化效率,这可能是后期随着溶剂用量不断增加,知母多糖得率反而降低的原因[28]。故选择液料比为10:1~20:1 mL/g 进行响应面试验。

图5 液料比对知母多糖得率的影响Fig.5 Effect of liquid-solid on the extraction yield ofAnemarrhena asphodeloidesBunge polysaccharide
2.2.2 Box-Behnken 响应面试验结果 本实验以多糖酶解时间(A)、液料比(B)、酶解温度(C)为自变量,以多糖得率(Y)为响应值,根据Box-Behnken 试验设计原理在三因素三水平上对复合酶提取知母多糖工艺进行优化,试验方案及结果见表4。
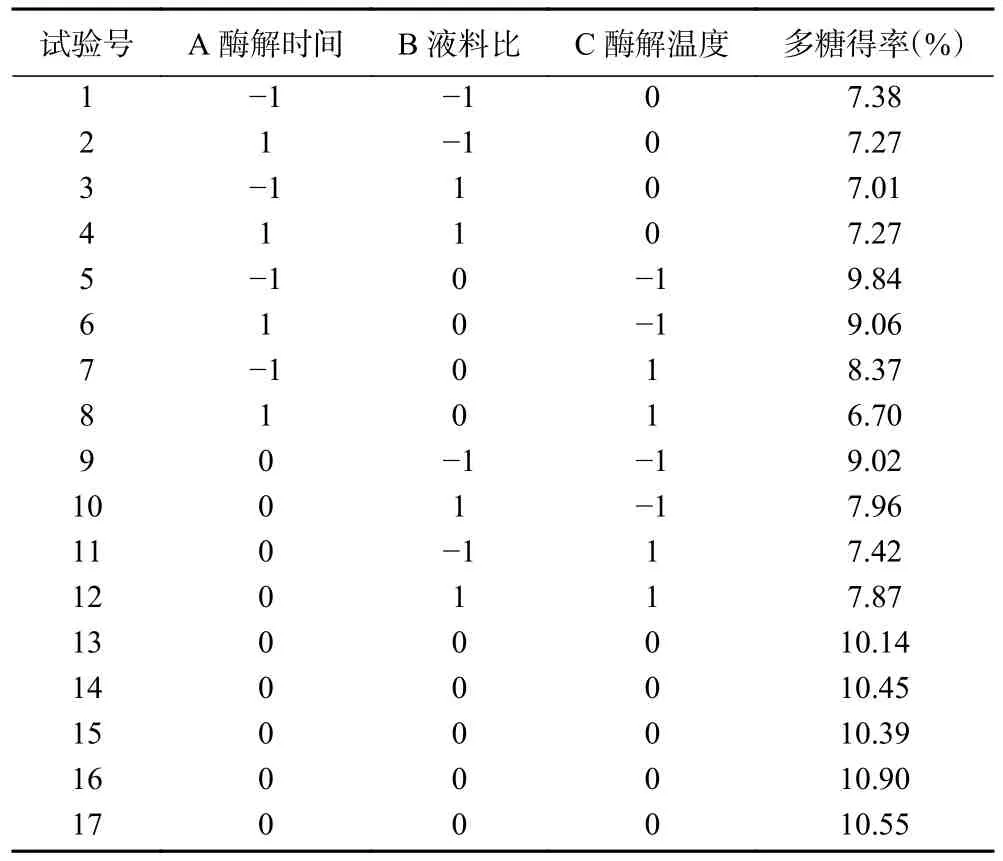
表4 试验设计及结果Table 4 Experimental design and results
使用软件进行多元回归拟合,计算回归系数,可以得到知母多糖得率对液料比(A)、酶解时间(B)和酶解温度(C)的多项回归方程:
Y=10.49−0.29A−0.12B−0.69C+0.09AB−0.22AC+0.38BC−1.41A2−1.84B2−0.58C2
从表5 的模拟方差分析中可知,P=0.001,说明此模型具有显著性;矢拟项P=0.0550>0.05,表明模型拟合较好,在实际实验中非正常误差较小;模型的决定系数R2=0.95,表明此模型拟合度好,可用于模型分析和预测各因素对知母多糖得率的影响;变异系数CV=5.73%,CV 值越大表明该模型的置信度越高[29]。二次项C2对响应值多糖得率影响达到显著水平(P<0.05),一次项C、二次项A2、B2对响应值多糖得率影响达到极显著水平(P<0.01),说明酶解时间、液料比和酶解温度对响应值的影响是非线性的;交互项均为不显著项,表明交互项对多糖得率影响不明显。根据F值,3 个因素对多糖得率影响关系依次为酶解温度>液料比>酶解时间。

表5 回归模型方差分析Table 5 Variance analysis of regression models
2.2.2.1 等高线图和响应面图 三维图形用于表示变量与响应值之间的关系及其相互作用,坡度越陡、等高线越密且椭圆程度越高,表明两因素交互作用对结果的影响越显著[30]。通过响应面的陡峭程度分析发现(图6),3 个因素无明显交互作用。

图6 两因素交互作用对多糖得率的响应面和等高线图Fig.6 Response surface and contour plots of variable parameters on extraction yield of polysaccharide
2.2.2.2 模型准确性分析 试验数据的残差和响应设计如图7 所示,图7(A)显示不同水平知母多糖响应值的残差正态分布曲线图,17 组响应值较为合理分布于一条直线两侧,无明显偏差,表明模型拟合效果较好。如图7(B)所示,实验值与预测值相关性较高,表明本试验建立的模型成功地加强了三个变量与响应值的联系。通过建模拟合,对内部学生化残差与17 组试验运行数据进行分析如图7(C),结果分析,所有数据在-3~3 之间,表明试验数据模型中没有有效误差存在。通过以上回归诊断分析,说明本实验建立的复合酶法提取知母多糖工艺模型准确性较高,可用于知母多糖的提取制备。
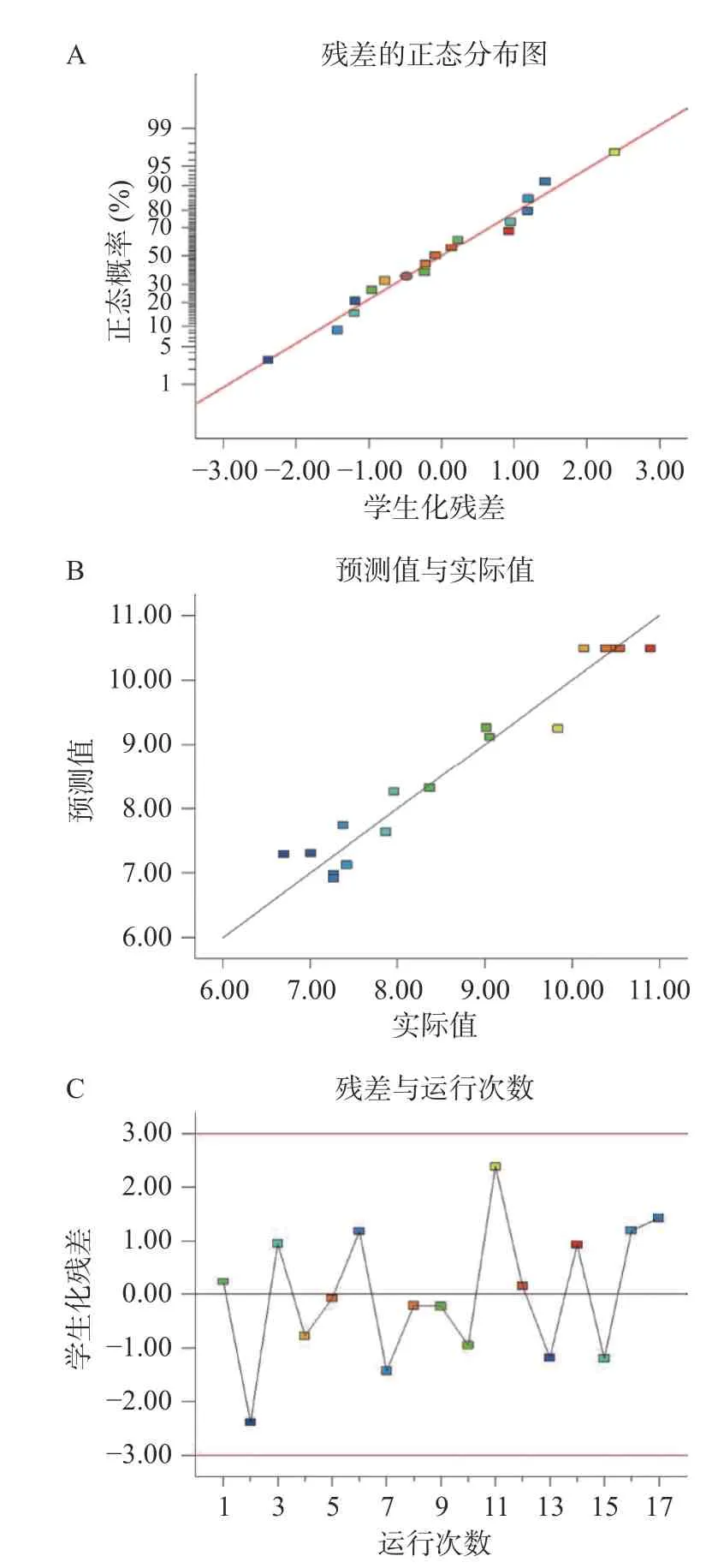
图7 Box-Behnken 模型准确性诊断图Fig.7 Diagnostic plots for the Box-Behnken model accuracy
2.2.2.3 模型验证 通过Design-Expert 8.0.6 软件分析,得到知母多糖提取的最佳工艺为酶解时间1.95 h,液料比14.72:1 mL/g,酶解温度51.92 ℃,在此条件下知母多糖预测得率为10.71%。考虑到实际操作的便利,最优工艺修正为酶解时间2 h,液料比15:1 mL/g,酶解温度52 ℃,进行3 次验证,知母多糖的得率为(10.58%±0.03%),验证实验结果与预测值的误差为1.12%,说明此模型与试验拟合度较好,对复合酶提取知母多糖的工艺优化合理、有效。
2.3 知母粗多糖的分离纯化
知母粗多糖依次用蒸馏水、0.05、0.1、0.2、0.3、0.5、0.8 mol/L NaCl 洗脱后,制图获得4 个形态具有差异的峰,分别收集在蒸馏水、0.05、0.1、0.2 mol/L NaCl 4 处峰内溶液,根据峰合并相应管内的样液(图8),蒸发浓缩、透析,冷冻干燥得4 种多糖组分,得率分别为56.8%、2.20%、3.92%和2.45%,多糖含量分别88.2%、70.4%、72.9%、80.6%,命名为APSE-0、APSE-1、APSE-2 和APSE-3。

图8 DEAE-52 纤维素柱洗脱曲线Fig.8 DEAE-52 cellulose column elution curve
2.4 知母多糖对RAW 264.7 巨噬细胞的免疫活性的影响
2.4.1 细胞增殖实验 巨噬细胞在先天和适应性免疫反应中起着关键的作用,活化的巨噬细胞可以吞噬病原微生物,处理和呈递抗原,同时合成和分泌趋势化因子和细胞因子,以增强机体的免疫防御能力[20]。如图9 所示,与对照组相比,在100~500 μg/mL 浓度内,APSE-0(A)高度显著促进RAW264.7 巨噬细胞增殖(P<0.01);在1~100 μg/mL 浓度内,APSE-1(B)和APSE-2(C)极显著促进RAW264.7 巨噬细胞增殖(P<0.001)。APSE-3(D)在1 μg/mL 浓度下,增殖率最高为(123.05%±6.05%)(P<0.001);与对照组相比,APSE-3 在100、250 和500 μg/mL 下极显著抑制细胞增殖(P<0.001)。因此,对于APSE-3 仅选择浓度为1、10 和50 μg/mL 进行后续NO 释放量的检测。

图9 不同浓度的APSE-0、APSE-1、APSE-2 和APSE-3 对RAW 264.7 巨噬细胞存活率的影响Fig.9 Effect of different components of APSE-0、APSE-1、APSE-2 and APSE-3 on the cell viability of RAW 264.7 cells注:与空白对照组相比,显著*P<0.05;高度显著**P<0.01;极显著***P<0.001;ns 无显著差异P>0,05;图10 同。
2.4.2 NO 释放量 NO 是巨噬细胞免疫应答中分泌的炎性介质,具有抵抗病原体入侵和调节细胞凋亡等多种生理功能[31]。在评估多糖的免疫刺激活性时,NO 释放的增加通常作为巨噬细胞活化水平的指标[32]。如图10 所示,APSE-1 与对照组相比基本无显著的差异,表明APSE-1 不能诱导NO 释放(P>0.05);与对照组相比,在实验浓度内,APSE-0(A)、APSE-2(C)和APSE-3(D)均极显著促进巨噬细胞NO 的释放(P<0.001)。APSE-2、APSE-3 所有浓度对RAW264.7 巨噬细胞都有很强的刺激作用。与对照组对比,APSE-2 处理组以浓度依赖性方式极显著诱导NO 释放(P<0.001),其中,高剂量组(500 μg/mL)NO 分泌量为(14.94±0.06)μg/mL,基本与LPS 组(15.49±0.32)相当。结果表明:APSE-0、APSE-2 和APSE-3 可以刺激RAW264.7 巨噬细胞产生NO。NO 是成熟单核细胞极化为M1 型巨噬细胞后分泌的主要细胞因子或信号分子,M1 型巨噬细胞可产生活性氮或活性氧,发挥机体免疫调节[33]。由此可见,APSE-0、APSE-2 和APSE-3 可能是通过提高巨噬细胞对NO 的合成,促进M1 型巨噬细胞的成熟,调节巨噬细胞的免疫能力,这与CAO 等[8]的研究结果一致。而ZHANG 等[9]分离得到的知母多糖AAP70-1不能诱导NO 的产生,而是通过促进细胞免疫因子IL-6、IL-1β和TNF-α的释放,从而增强巨噬细胞免疫功能。而复合酶提取知母多糖能否通过调节细胞免疫因子水平而发挥免疫活性作用,有待进一步研究。

图10 不同浓度的APSE-0、APSE-1、APSE-2、APSE-3 对RAW 264.7 巨噬细胞分泌NO 的影响Fig.10 Effects of different components of APSE-0、APSE-1、APSE-2 and APSE-3 on nitric oxide (NO) release of RAW 264.7 cells
3 结论
本研究通过正交试验确定复合酶配比为木瓜蛋白酶16000 U/g、纤维素酶1200 U/g、果胶酶1600 U/g。采用响应面Box-Behnken 法优化复合酶提取知母多糖最佳工艺为酶解时间2 h,液料比15:1 mL/g,酶解温度52 ℃,在此条件下得率为(10.58%±0.03%)。本实验所采用的复合酶法提取知母多糖工艺具有总操作时间短、条件温和、耗能低等优点,可用于知母多糖的实际生产中。
体外免疫实验证明4 种知母多糖组分均能促进细胞增殖,并且APSE-0、APSE-2 和APSE-3 均能极显著诱导NO 的释放,表明APSE-0、APSE-2 和APSE-3 对RAW264.7 细胞的有较好的增强免疫活性。其中,APSE-2 对RAW264.7 细胞的免疫效果最好,可作为潜在的功能性食品或作为免疫力低下人群的膳食补充剂。研究表明不同提取方法可能对多糖的结构和免疫活性有显著的影响[34−35],本文初步证实复合酶提法所得知母多糖对RAW264.7 细胞有较好的增强免疫活性,后续将对不同提取方法所得知母多糖的结构特征、免疫活性及其作用机制做进一步研究。
