响应面法优化黄果茄中绿原酸的提取工艺
2022-01-14李学玲徐怀生张建强
李学玲,李 茜,徐怀生,张建强
普洱学院生物与化学学院,云南省高校亚热带药用食用生物资源开发与利用重点实验室,云南 普洱 665000
1 材料与方法
1.1 材料与仪器
黄果茄果实采自云南省8 个不同州县(普洱市思茅区、普洱市景东县、曲靖市罗平县、曲靖市师宗县、红河州个旧县、昆明市寻甸县、文山州马关县、楚雄州武定县),晒干,粉碎,密封保存;绿原酸标准品购自合肥博美生物科技有限责任公司;乙醇、甲醇、丙酮、盐酸、氢氧化钠,均为分析纯试剂。
岛津UV-2550 紫外-可见分光光度计,HH-6恒温水浴锅,FA3204B 电子天平。
1.2 方法[8~10]
1.2.1 绿原酸标准溶液的配制
称取绿原酸标准品5.0mg,精密称量,置于100ml 容量瓶中,继续加入70%的乙醇溶解、定容、摇匀待用,此时浓度为50μg/ml。
1.2.2 最大吸收波长的确定
取绿原酸标准液20ml 于50ml 的容量瓶中,用70%乙醇定容,于紫外分光光度计下在200nm-500nm 波长范围内扫描,结果如图2。

图2 绿原酸的吸收光谱
由图2 可以看出在328nm 处出现了最大吸光度,故绿原酸的最大吸收波长确定为328nm,后续检测波长均设定为328nm。
1.2.3 标准曲线的绘制
分别取绿原酸标准液0.00ml、2.00ml、4.00ml、8.00ml、12.00ml、16.00ml、20.00ml 于7 个50ml 容量瓶中,加70%的乙醇定容,摇匀,测吸光度,绘制标准曲线,结果如图3 所示。

图3 绿原酸的标准曲线
由图3 得出绿原酸的标准曲线的方程为Y=0.0285X-0.011,R2=0.9989,线性关系良好。
1.2.4 样品中绿原酸的提取
称取黄果茄粉末(红河州个旧县)2g(精确至0.01g)于250ml 圆底烧瓶中,加入160ml 70%乙醇溶液,加热回流1.5h,冷却至室温减压过滤,记录滤液的体积,取其提取液1.00ml 于50ml 容量瓶中,70%乙醇溶液定容至刻度,摇匀,测其吸光度,计算提取率。
提取率E(%)=(C×V)/M
式中:C 表示滤液中绿原酸的含量(g/ml);V 表示滤液的体积(ml);M 表示黄果茄粉末质量(g)。
2 结果与分析
2.1 单因素对黄果茄绿原酸提取率的影响与讨论
2.1.1 提取剂对黄果茄绿原酸提取率的影响
选取不同的提取剂在其他条件相同的条件下回流提取黄果茄中的绿原酸,根据滤液吸光度大小即可得出最佳提取剂,实验结果如图4 所示。

图4 不同提取剂对绿原酸提取率的影响
如图4 可知,不同的提取剂对绿原酸的提取效果不同,结果表明乙醇>蒸馏水>甲醇>丙酮,其中乙醇和蒸馏水的提取率相差不大,考虑到环保、经济成本和实用性等因素,最终选取蒸馏水作为绿原酸的提取剂。
2.1.2 液料比对黄果茄绿原酸提取率的影响
准确称量6 份黄果茄样品0.60 g 于150ml 圆底烧瓶中,分别按液料比(ml/g)20:1、30:1、40:1、50:1、60:1、70:1 加入蒸馏水,在相同的温度、时间条件下回流提取黄果茄中的绿原酸,冷却至室温,减压过滤,分别记录滤液的体积,取其提取液1.00ml 于50ml 容量瓶中稀释定容,测其吸光度,计算绿原酸提取率。平行测定3 次,实验结果如图5 所示。

图5 液料比对绿原酸提取率的影响
由图5 可以看出液料比为40:1 之前,提取率随液料比的增加而增大;当液料比达到40:1 时,绿原酸的提取率最大0.196%;之后随着液料比的增加而略有下降,可能是因为液料比增加蒸发浓缩和减压过滤的负荷,导致提取率略有下降。故绿原酸提取的最佳液料比为40:1。
2.1.3 温度对黄果茄绿原酸提取率的影响
准确称量6 份黄果茄样品0.60g 于150ml 圆底烧瓶中,按液料比40:1 加入蒸馏水,分别在40℃、50℃、60℃、70℃、80℃、90℃下的恒温水浴锅中,回流提取相同的时间,冷却至室温,减压过滤,分别记录滤液的体积,取其提取液1.00ml 于50ml 容量瓶中稀释定容,测其吸光度,计算绿原酸提取率。平行测定3 次,实验结果如图6 所示。
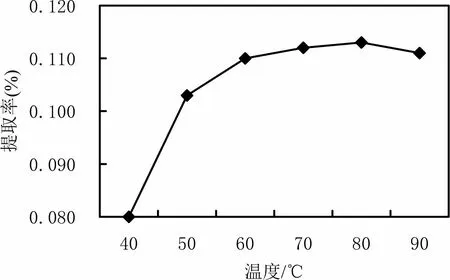
图6 温度对绿原酸提取率的影响
由图6 可知,80℃之前,提取率随温度升高而增大;当温度为80℃时,绿原酸的提取率最大0.113%;超过80℃提取率略下降,这可能是由于绿原酸分子结构中的邻苯二酚结构不稳定,温度过高时部分绿原酸会氧化分解,使提取率下降。故绿原酸的最佳提取温度为80℃。
2.1.4 pH 对黄果茄绿原酸提取率的影响
准确称量6 份黄果茄样品0.60g 于150ml 圆底烧瓶中,按液料比40:1,加入pH 为2、3、5、7、9、11蒸馏水,分别在80℃的恒温水浴锅中回流提取相同时间,冷却至室温,减压过滤,分别记录滤液的体积,取其提取液1.00ml 于50ml 容量瓶中稀释定容,测其吸光度,计算绿原酸提取率。平行测定3 次,实验结果如图7 所示。

图7 pH 对绿原酸提取率的影响
由图7 可知,当pH<3 时,绿原酸的提取率随pH 增大而增大;当pH=3 时,提取率最大0.102%;当pH>3 时,提取率随pH 增加而降低,这可能是因为绿原酸是极性酸,在酸性环境中更稳定,随着pH的增加,绿原酸会有溶解的现象,导致其提取率下降。故绿原酸提取剂的最佳pH 为3。
2.1.5 时间对黄果茄绿原酸提取率的影响
准确称量6 份黄果茄样品0.60g 于150ml 圆底烧瓶中,按液料比40:1,加入pH 为3 的蒸馏水,分别在80℃的恒温水浴锅中回流提取0.5、1.0、1.5、2.0、2.5、3.0 h,冷却至室温,减压过滤,分别记录滤液的体积,取其提取液1.00 ml 于50ml 容量瓶中稀释定容,测其吸光度,计算绿原酸提取率。平行测定3 次,实验结果如图8 所示。
由图8 可知,当提取时间t<1.5h 时,绿原酸的提取率随时间的增加而增大;当t=1.5h,绿原酸的提取率最大0.098%;当t>1.5h 时,这可能是由于绿原酸分子结构中的邻苯二酚结构不稳定,长时间的加热会使绿原酸氧化分解,导致提取率下降。提取率随时间的增加而下降,故绿原酸提取的最佳提取时间为1.5h。

图8 时间对绿原酸提取率的影响
2.2 响应面优化设计结果与讨论
2.2.1 响应面优化实验方法[11~13]与结果
在单因素实验基础上,确定液料比、温度、时间、pH=4 个因素及水平值,运用 Design-Expert 10.0 软件进行Box-Behnken 响应面设计和数据分析。每个因素的高中低水平分别 以1、0、-1 进行编码,各试验因素及水平值见表1。

表1 试验因素及水平
采用Box-Behnken 中心组合试验设计原理,结合单因素试验结果,液料比40∶1、温度80℃、时间1.5h、pH 为4。试验设计及结果如表2 所示。
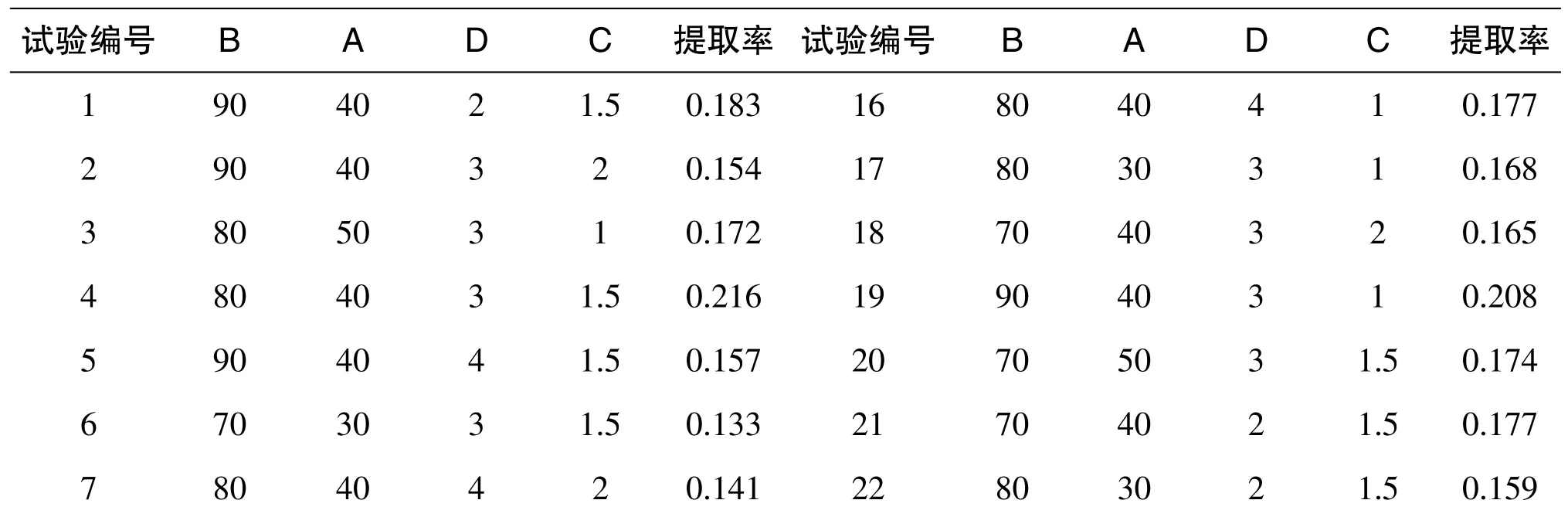
表2 响应面试验设计及结果
利用Design-Expert 8.0 Trial 软件对表2 中数据进行多元回归拟合,得表3。

表3 回归模型及其显著性检验
通过软件模拟出最后的回归线方程为:
Y=-2.38904+0.022925A+0.041658B+0.329C+0.14917D+0.000028AB+0.0029AC-0.0002AD-0.0021BC-0.000125BD-0.0125AC-0.00034A2-0.00024B2-0.089C2-0.02D2,其中:A 表示液料比;B表示温度;C 表示时间;D 表示pH。
由方差分析结果可知,该回归方程呈极显著性(P<0.01),模型失拟项也呈极显著性(P<0.01)。A、C、A2、B2、C2、D2对绿原酸提取率的影响极显著(P<0.01);B、D、AB、AC、AD、BC、BD 对绿原酸提取率的影响不显著(P>0.05)。
通过回归方程的模拟,四个单因素之间两两相互响应对绿原酸提取率的影响,得到相应的响应面结果如下:
图9-2 中提取率随着温度的变化,先增加后减小,液料比的变化趋势相似。温度90℃,液料比50:1时,提取率最大,温度的变化曲面比较陡。由图9-1来看,温度方向等高线密集,说明温度对提取率的影响大于液料比对提取率的影响。

图9-1 温度与液料比对提取率的影响等高线图

图9-2 温度与液料比对提取率的影响
图10-2 中提取率随温度的变化,先增加后减小,pH 的变化趋势相似,温度80℃,pH=3,提取率最大,pH 的变化曲面比较陡。由图10-1 来看,pH 方向等高线密集,说明pH 对提取率的影响大于温度的影响。

图10-1 温度和pH 对提取率的影响等高线图

图10-2 温度和pH 对提取率的影响
图11-2 中提取率随着时间的变化,先增加后减少,温度的变化趋势相似,温度80℃,时间1.5h,提取率最大,时间的变化曲面比温度的变化曲面陡。由图11-1 来看,时间方向等高线密集,说明时间对提取率的影响大于温度的影响。
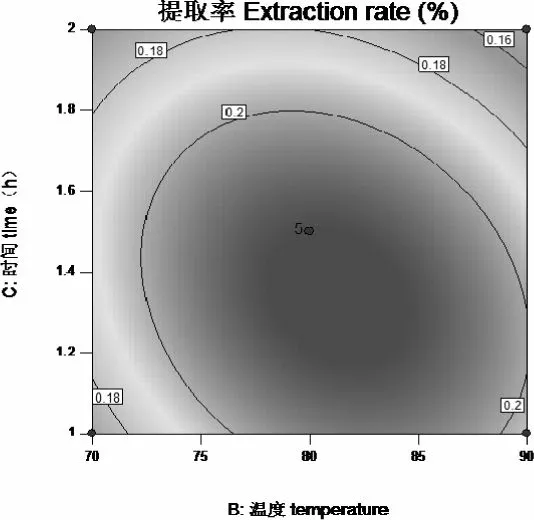
图11-1 温度和时间对提取率的影响等高线图

图11-2 温度和时间对提取率的影响
图12-2 中提取率随着pH 的变化,先增加后减小,液料比的变化趋势相似,pH=4,液料比50:1,提取率最大,pH 的变化曲面比较陡。由图12-1 来看,pH 方向的等高线密集,说明pH 对提取率的影响大于液料比的影响。

图12-1 液料比和pH 对提取率的影响等高线图
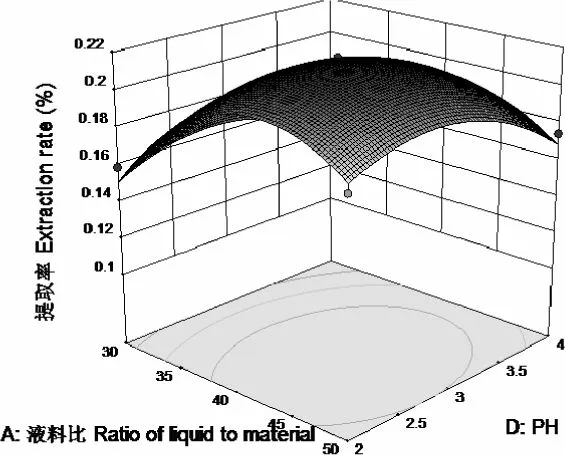
图12-2 液料比和pH 对提取率的影响
图13-2 中提取率随着时间的变化,先增加后减小,液料比的变化趋势相似,时间2h,液料比50:1,提取率最大,时间的变化曲面比液料比的变化曲面陡。由图13-1 来看,时间方向的等高线密集,说明时间的影响大于液料比对提取率的影响。

图13-1 液料比和时间对提取率的影响等高线图

图13-2 液料比和时间对提取率的影响
图14-2 中提取率随着pH 的变化,先增加后减小,时间变化趋势相似,pH=3,时间1.5h,提取率最大,时间的变化曲面相比于pH 的变化曲面陡。由图14-1 来看,时间方向的等高线密集,说明时间对提取率的影响大于pH 的影响。

图14-1 pH 和时间对提取率的影响等高线图
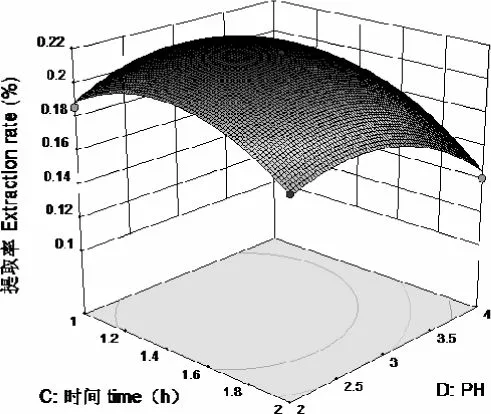
图14-2 pH 和时间对提取率的影响
2.2.2 结果验证与讨论
由响应面优化结果,结合实验室实际情况得出黄果茄中绿原酸的最佳提取方案是:以蒸馏水作为提取剂,液料比为50:1,温度为90℃,pH 为2,时间为1h,绿原酸的提取率最大0.28%。在所选取的各因素范围内,按照响应值的影响顺序,4 个因素对绿原酸提取率的影响顺序是:时间>pH>温度>液料比。
2.3 不同地区黄果茄中绿原酸含量比较
根据响应面得出的最佳提取方案,对不同地区黄果茄中绿原酸进行了含量比较,黄果茄中均含有一定量的绿原酸;不同地区绿原酸的含量有所不同,普洱市思茅区的黄果茄中绿原酸含量最高,曲靖市师宗县的黄果茄中绿原酸含量最低,主要是因为地势和气候的影响,导致绿原酸的含量存在差异。
3 结论与展望
试验采用响应面优化法,以液料比、温度、时间、pH 为自变量,提取率为因变量,利用线性回归方程和二项式拟合,对黄果茄中绿原酸的最佳提取工艺是:蒸馏水作为提取剂,液料比50:1,温度90℃,pH 为2,时间1h,绿原酸的提取率最大0.28%,与预测0.268%相近。其中4 个条件对绿原酸提取率的影响程度从大到小为:时间>PH>温度>液料比。
对于黄果茄中绿原酸的提取率,除了用回流提取法外,还可以借助微波辅助提取、超声波辅助提取。此外,刘艺等[14]通过超临界流体萃取绿原酸,避免了提取过程中绿原酸的氧化分解。温度对绿原酸的稳定性和提取效率起到双重影响的作用。本次实验还进行了不同地区黄果茄中绿原酸的含量比较,可以看出普洱思茅的黄果茄中绿原酸的含量相对于其他地方略高,但总体来看,黄果茄中绿原酸的含量差异不大。
