银屑病和非酒精性脂肪性肝病相关性研究进展
2022-05-28刘克帅张晓艳
刘克帅,高 敏,张晓艳
(1.北京中医药大学,北京 100029;2.中日友好医院皮肤病与性病科,北京 100029)
银屑病是一种免疫介导的慢性炎症性皮肤疾病,以红斑、鳞屑伴有不同程度瘙痒为特征。全球发病率为2~3%,影响全世界超过1.25亿人口。银屑病常合并其他系统疾病如心血管疾病、代谢综合征、关节损害、心理疾病等,给患者带来严重的心理和生理负担[1]。非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)作为一种遗传易感性的肝脏代谢紊乱性疾病,是目前世界上最常见的肝病,在一般成年人中患病率约25%,为发达国家肝功能衰竭最常见的原因[2],它包含了从单纯的脂肪变性到非酒精性脂肪性肝炎(Non-alcoholic steatohepatitis,NASH)等一系列疾病谱,最终可走向肝纤维化、肝硬化、肝细胞肝癌等不良结局[3]。NAFLD与银屑病一样也是一种影响器官外系统的炎症性疾病,特别是心血管系统已成为NAFLD患者死亡的主要原因[4,5]。临床研究已证实银屑病人群患NAFLD几率较正常人群明显升高,高达43~65%不等[3,6,7],且NAFLD与更严重的银屑病相关。
1 银屑病和NAFLD的发病机制
1.1 银屑病 银屑病除了遗传易感性外,先天及适应性免疫参与了发病[8]。在遗传易感性基础上,创伤、辐射、感染等损伤因素会启动免疫炎症级联反应[9]。角质形成细胞通过产生抗菌肽(AMPs)、防御素、趋化因子吸引中性粒细胞等炎症细胞至皮肤中启动先天免疫反应。此外,角质形成细胞释放自身核苷酸,与AMPs等形成复合物,通过TOLL样受体激活树突状细胞成熟(cDC)并促进其向炎性DC(iDC)分化。成熟的cDC和iDC分泌TNF-α、IL-12和IL-23诱导适应性免疫细胞Th1和Th17的激活,产生IL-17、TNF-α等促炎细胞因子,IL-17等可通过刺激角质形成细胞进一步释放趋化因子如CCL20、CXCL1、CXCL2、CXCL9、CXCL10和CXCL11等,增加中性粒细胞及肥大细胞等向表皮的持续迁移,IL-17、TNF-α等炎症因子还可直接作用于角质形成细胞促进其持续的病理性增殖(图1)。这一系列病理生理过程产生了包括真皮血管周围炎、Munro微脓疡和过度角化等现象的形成,使银屑病皮损得以持续产生[9,10]。
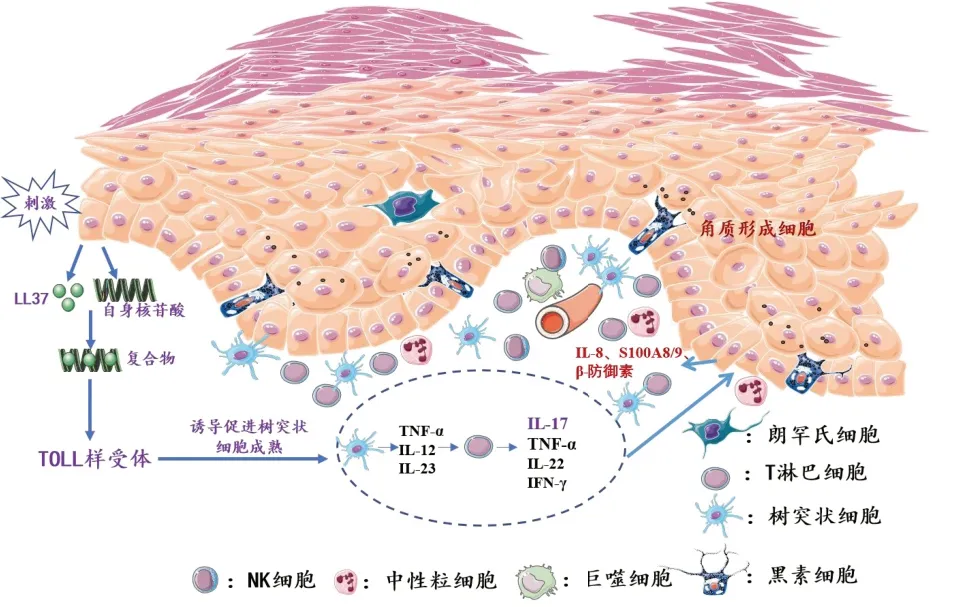
图1: 外伤、辐射等损伤因素导致角质形成细胞(KC)受损,受损的KC释放抗菌肽(LL-37)和自身核苷酸。 LL-37-自核苷酸复合物刺激Toll样受体(TLR7和TLR9)激活树突状细胞,诱导产生IFN-γ、IL-12和IL-23继而诱导Th1、Th22和Th17的成熟和分化,随后产生IL-17,IL-22,TNF-α等作用于角质形成细胞,产生IL-8等趋化因子而诱导中性粒细胞等炎症细胞的聚集。
1.2 NAFLD NAFLD患病率高的原因在于它与饮食导致的肥胖密切相关。肥胖是一种与高热量饮食和低体力活动相关的全球流行疾病,是导致胰岛素抵抗(Insulin resistance,IR)和血脂异常等代谢紊乱的最主要原因。实际上NAFLD患者通常有一种不健康的饮食模式,一方面大量摄入果糖和含有饱和游离脂肪酸、胆固醇的脂肪,另一方面摄入较少的抗氧化维生素和含多不饱和脂肪酸的脂肪。胰岛素抵抗(IR)是NAFLD发生发展的关键环节。“二次打击假说”首次解释了NAFLD的发生机制,“第一次打击”是由于高脂、高糖的摄入和IR导致的肝细胞脂质堆积,循环及肝脏中游离脂肪酸(Free fatty acids,FFAs)升高,这使得肝细胞对损伤因素易感性增加,这些损伤因素统称为“二次打击”,包括氧化应激(OS)、疾病易感性基因多态性增加、库普费细胞(Kupfer Cell)释放促炎症细胞因子、脂肪细胞释放脂肪因子、肝细胞凋亡失调以及肝星状细胞(HSC)激活等[11]。后有学者提出出现了一种新的理论认为单纯的脂肪肝与 NASH是IR引起的两种独立状态。但这均认为IR在NAFLD发病中起着关键的作用[5]。

图2: 饮食、肥胖等因素促进IR的产生,IR导致肝脏脂肪沉积和炎症增加,肝细胞对氧化应激等损伤因素易感性进而增加,不及时干预一部分人则逐步走向肝纤维化、肝硬化、肝细胞肝癌的不良结局。
2 银屑病合并NAFLD的流行病学证据
银屑病与NAFLD都是与全身炎症密切相关的系统性疾病,通过代谢和免疫机制影响器官外系统[4],这可能导致了银屑病与NAFLD之间的串扰。诸多临床证据表明银屑病人群的NAFLD发病率显著升高,部分患者还可进展为更为严重NASH,甚至肝纤维化、肝硬化等[3,6,7,12,13],而伴随了NAFLD的银屑病患者也往往会有更严重的银屑病,且有可能因为更高的炎症负担造成患者对治疗药物的抵抗[3,6,7]。为探索银屑病和NAFLD之间的关系,我们从pubmed上汇总了从2009年至2020年之间关于两者联系的临床研究并进行分析。
2.1 银屑病患者患NAFLD几率升高 Gisondi等[14]在2009年进行了一项纳入130例银屑病和260例健康对照的观察性研究,率先提出银屑病患者比正常人更容易罹患NAFLD(47% Vs 28%)。同年,Miele等[15]通过一项纳入142例银屑病患者和125例单纯NAFLD的病例对照研究发现59.2%的银屑病患者合并了NAFLD,其中有5名银屑病患者接受了肝脏活检,3例为更为严重的NASH。Roberts KK[16]后在2015年进行了相似的研究,发现银屑病患者的NAFLD患病率为47%,对其中的52例银屑病患者进行肝脏组织活检后发现22%患有NASH。vander Voort等[17]在2014年开展一项纳入2292名参与者的前瞻性队列研究,其中118例为银屑病患者,他们中的46.2%患有NAFLD,而非银屑病患者的NAFLD患病率为33.3%,提出银屑病是NAFLD的重要预测因素。同年,Abedini R等[7]开展一项纳入123例银屑病和123例健康对照的横断面研究发现银屑病患者NAFLD患病率高于对照组(65.6% vs 35%)。有学者提出NAFLD是引起银屑病患者肝细胞损伤的重要原因,如Tula等[12]于2017年开展了一项纳入393名银屑病患者的横断面研究发现引起病理性肝酶升高的原因为药物(57%)和NAFLD(22%)。近两年,探讨两者之间联系的临床研究仍在不断进行,如Awosika(2018)等[18]的研究显示银屑病患者NAFLD发病率为21.2%,高于对照组的7.8%。Magdaleno(2019)等[3]研究显示52%银屑病患者存在肝脏脂肪变性。Ortolan(2019)等[19]的研究显示NAFLD在银屑病人群中发生率很高(65% Vs 35%)。
2.2 合并NAFLD的银屑病患者病情更重 临床研究发现NAFLD可以加重银屑病病情。Gisondi等[14]指出银屑病合并NAFLD患者(PSO-NAFLD)要比单纯银屑病患者有更高的PASI值,循环炎症因子如CRP、IL-6等水平明显升高,而脂联素等抗炎细胞因子则显著降低。Madanagobalane等[20]的研究也发现PSO-NAFLD患者往往具有更长的银屑病病程和更重的病情。Roberts[16]等人的研究也同样支持了合并NAFLD可加重银屑病病情的观点。但有趣的是,我们发现PSO-NAFLD患者更容易患代谢综合征或其组分如肥胖、高血脂、糖尿病或空腹血糖升高、高血压等[3,6,7,14,15,18,20-22],所以到底是代谢综合征加重了银屑病还是NAFLD单独作用还是两者共同作用的结果?这还需要研究去证实和探索。
2.3 银屑病患者患有更严重的肝脏问题 因两种疾病炎症之间的叠加,患有银屑病并发NAFLD患者的肝脏存在比单纯NAFLD患者更严重的问题。Miele等人发现PSO-NAFLD患者与单纯NAFLD患者相比有更高的NAFLD纤维化评分和AST/ALT>1的情况[15]。此外,vander等人通过一项纳入2466人的横断面研究发现银屑病患者的晚期肝脏纤维化风险较正常人高出2.5倍,同时PSO-NAFLD患者较正常人发生晚期肝纤维化风险高出4倍,并认为银屑病可以作为肝脏纤维化严重程度的预测因子[13]。Magdaleno等人发现14%的银屑病患者存在中等严重程度的肝脏纤维化(≥7.6KPa)[3]。Gisondi等人的研究同样支持这样的观点,其研究中银屑病患者的NAFLD纤维化评分高于对照(-1.57±1.4 vs -3.10±1.5),多变量分析显示银屑病独立于年龄、性别、体重指数、高血压和糖尿病,是肝纤维化进展的显著预测因素[22]。以上研究均支持PSO-NAFLD患者要比单纯的NAFLD患者有着更严重的肝脏纤维化风险。
3 银屑病与NAFLD之间共同生物学特征
NAFLD与银屑病之间的潜在联系十分复杂,目前来说还不是十分明朗。已知的是两种疾病常出现代谢异常的重叠,如胰岛素抵抗、肥胖、高脂血症等代谢紊乱问题常出现在这两类人群之中。
3.1 肥胖 在银屑病人群中代谢综合征发病率达31.4%[23],研究发现银屑病合并代谢综合征(Metabolic Syndrome,MS)的几率与银屑病严重程度呈正比。肥胖为MS的首要因素,研究发现重度银屑病患者比轻度银屑病患者往往更容易肥胖,肥胖是银屑病发生、发展的独立危险因素[24]。Budu等人采用孟德尔随机化研究了银屑病发病与体重指数(Body mass index,BMI)的关系,发现BMI每增加1 kg/m2,患银屑病的几率增加4%[25]。Han的研究也发现BMI和腰围的增加与银屑病发病几率的增加密切相关[26]。同时肥胖对NAFLD的影响巨大,实际上肥胖者NAFLD患病率从57%到98%不等[5]。在过去20年里,NAFLD的发病率几乎随着肥胖率的升高呈线性上升趋势。如在日本人群研究中,NAFLD在BMI <23、23~25、25~28和≥28 kg/m2的人群中患病率分别为10.5%、37.9%、58.4%和84.2%[27]。另外,我国的一项为期6年的前瞻性研究显示从2007年至2013年期间,男性肥胖、超重和NAFLD患病率分别从15.8%上升至19.4%、35.9%至41.8%和23.5%至44.3%,女性分别为13.2%上升至18.8%、31.1%至37.5%和17.6%至43.1%[28]。此外,意大利人群中肥胖者NAFLD的患病率为75.8%,正常体重者仅为16.4%,肥胖者患NAFLD的风险较体重正常人相对危险性高出4.6倍。而当我们反向观察时则发现NAFLD和它的炎症形式NASH患者的肥胖患病率分别为51.3%和81.3%。这意味着肥胖可以影响NAFLD,NAFLD也可能通过肝脏IR、脂毒性等机制促进肥胖[29]。肥胖是银屑病和NAFLD合并出现最常见也是最重要的生物学特征。
3.2 胰岛素抵抗 银屑病还与血糖代谢异常相关,如Gonzalez等人通过HOMA-IR模型研究了银屑病患者的IR情况,发现银屑病患者相对于健康者的IR要严重的多(4.62±3.57 Vs 2.67±2.11,P<0.004)[30]。至于II型糖尿病也是如此,美国一项纳入47万例银屑病患者的大样本回顾性真实世界研究发现银屑病患者的II型糖尿病风险为17.45%[31]。另一项纳入38个涉及银屑病和糖尿病研究的荟萃分析显示银屑病和糖尿病之间存在相关性,OR值为1.69(95%可信区间:1.51-1.89;P<0.001)[32]。IR是血糖代谢异常乃至II型糖尿病的关键机制,在银屑病炎症状态及肥胖状态下,过度激活的炎症细胞释放炎症因子如TNF-α、IL-6、IL-17等,以及过度增生的内脏脂肪特别是白色脂肪释放促炎性脂肪因子如瘦素、趋化素、抵抗素等,而抗炎脂肪因子如内脂素等分泌则明显减少,这些炎症因子和脂肪因子的变化一方面可以诱发或加重银屑病,另一方面也可降低胰岛素敏感性[26,33]。胰岛素的磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路中的雷帕霉素复合体1(MTORC1)是银屑病、肥胖、IR相互作用的关键靶点,在肥胖状态下MTORC1活化,一方面可介导IR的产生,另一方面可引起银屑病角质形成细胞增殖活跃[34,35]。
IR同样容易出现在NAFLD患者人群中,与不患有NAFLD的患者相比,患有NAFLD的患者往往有着严重的IR,特别是在脂肪组织水平上。目前已明确肝脏脂肪变性与胰岛素作用受损以及II型糖尿病密切相关,约3/4的糖尿病患者患NAFLD,糖尿病患者NAFLD风险是非糖尿病患者的5倍[36,37]。IR是NAFLD发病的关键环节,Ortolan的研究已证实IR与NAFLD独立相关[19],IR常预示着NAFLD的发生。NAFLD特别是其炎症形式NASH可释放大量促炎症、促凝血、促氧化和促纤维化介质(如C-反应蛋白、IL-6、纤维蛋白原、纤溶酶原激活物抑制物-1、转化生长因子-β)等,这些因子既可加重胰岛素抵抗,还可能在银屑病病理生理过程中发挥重要作用[4]。因此,NAFLD又是代谢紊乱的早期预测因子。
3.3 血脂异常 银屑病患者出现血脂代谢异常的几率较正常人群明显升高,这已在临床研究中得到重视。大多数的研究显示银屑病与血脂代谢异常之间存在显著关联,但也有少数研究表达了相反的观点。有研究表明,银屑病患者血脂升高几率较对照组明显升高(44.1%>26.3%),银屑病患者血清甘油三酯水平显著上升,高密度脂蛋白以及载脂蛋白A1水平显著降低[38]。银屑病和肥胖的系统性炎症可能解释了血脂紊乱发生的原因,细胞因子如IL-1、IL-6和TNF-a等在血清脂质失调中发挥着重要作用,因其可能通过参与抑制脂蛋白脂酶的活性而降低甘油三酯清除率,升高甘油三酯水平[39,40],还可能通过增加脂肪分解和刺激脂肪酸合成而升高血脂[41]。同样,血脂异常在NAFLD患者中更容易出现,其血脂异常的特点通常为是TG和LDL-C水平的升高而HDL-C水平的降低,这可能是NAFLD患者患脑血管疾病(cerebrovascular disease,CVD)风险增加的部分原因[42]。此外,NAFLD还与sd-LDL颗粒增加独立相关,sd-LDL代表了一种新的CVD风险因素,NASH患者的sd-LDL水平可能比NAFLD患者更高。因此可能导致NASH患者的CVD风险高于NAFLD患者[43]。有研究提示NAFLD患者的脂蛋白谱发生改变如ApoA1、ApoB、sd-LDL等,这主要由肝脏脂肪含量增加和IR所驱动的,而与肥胖无关[44]。
4 炎症通路在银屑病和NAFLD中的作用
TNF-α、IL-17A等是银屑病发病中最重要的炎症因子,它们通过促进趋化因子的产生以诱导中性粒细胞等炎症细胞向表皮迁移,可直接影响角质形成细胞的增殖和活化,与银屑病皮损形成密切相关。在过去几年里,针对这些炎症因子已实现从基础研究到开发治疗银屑病高效、快速药物的转化。炎症通路也参与了NAFLD的发病过程,因肝脏脂肪沉积和炎症的产生受IR的影响,外周IR主要由扩张的内脏脂肪产生脂肪因子促进TNF-α、IL-6和IL-17等促炎细胞因子产生所介导,而肝内IR是因为脂肪组织释放过多FFAs诱导肝脏二酰甘油积累和炎症通路激活进而抑制胰岛素信号传导所致[45](如图3)。有研究发现在IL-17A和FFAs共同存在的条件下会显著降低胰岛素诱导的HepG2细胞(一种肝癌细胞)中胰岛素受体底物1(IRS-1)和蛋白激酶B(AKT)磷酸化从而钝化胰岛素信号通路[46]。在IR和肝内FFAs持续大量存在下肝脏内脂肪持续堆积,超过肝细胞承受能力出现肝细胞的炎症破坏产生NASH,IL-17A等炎症因子参与了这一过程。

图3: 脂肪组织功能紊乱产生过多的FFA进入血液循环,促使肝内脂肪沉积。同时脂肪组织还会释放过多的瘦素、IL-6、IL-17、TNF等促炎症因子,与FFA一起可促进全身胰岛素抵抗的形成,进而再次加剧肝脏脂肪沉积,同时也会加重银屑病皮损。银屑病局部所产生的TNF-α、IL-17等炎症因子进入血液循环,一方面会加重全身IR,另一方面会协同脂肪组织释放的促炎细胞因子和脂肪因子共同参与肝脏内IR的形成,最终产生或加重NAFLD。VAT:内脏脂肪;IR:胰岛素抵抗;FFA:游离脂肪酸;leptin:瘦素;adiponectin:脂联素。
临床和基础实验已证实在肥胖、脂肪肝、高脂饮食状态下,机体炎症因子及炎症细胞水平会明显上升,如Rolla[47]等人以MCD(蛋氨酸胆碱缺乏)饮食喂养C57BL/6小鼠重现了人类NASH,其肝脏中的Th17细胞较正常小鼠高出4.7倍,IL-6、TNF-α、TGF-β以及IL-17水平都出现了明显的增加。同样,Tang等人[46]使用高脂饮食喂养 C57BL/6小鼠8周诱导NAFLD模型发现,高脂饮食组小鼠与正常饮食组小鼠相比,其肝脏中Th17细胞数量及IL-17水平明显更高。人类临床研究也同样发现了NAFLD患者肝脏内的Th17 细胞亚群存在明显升高的现象[48]。IL-17A受体表达于多种肝脏细胞上包括肝细胞、星状细胞、Kupffer、内皮细胞等[49]。IL-17A与肝脏细胞上的受体结合后,通过NF-κB和丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,刺激IL-8等趋化因子的分泌,诱导Kupffer、肝星状细胞等炎症细胞的浸润,加剧肝组织炎症、促进纤维化[2,50]。同时IL-17A还通过刺激IL-6产生进一步增强Th17分化成熟,分泌更多的IL-17A,促进NAFLD疾病持续进展[51]。使用药物中和IL-17A或基因敲除IL-17A基因后实验对象的肝脏便没有或很少受到炎症的影响[47,52]。
炎症通路在银屑病和NAFLD两者之间起着桥梁的作用。肝脏和皮肤炎症之间互相影响。IL-17A、TNF-α与其他炎症因子共同促进银屑病患者肝脏细胞中IL-17A基因及其相关转录因子基因RORc的表达增强,促进分泌IL-17A的Th17细胞、Kupffer细胞等肝脏炎症细胞增多。肝脏中Kupffer细胞浸润活化分泌TGF-β、IL-6、TNF-a、IL-23等细胞因子,与脂肪组织分泌的促炎脂肪因子、游离脂肪酸等共同促进Th17等炎症细胞的分化成熟,参与炎症级联反应[53]。处于NASH阶段的肝脏也会释放大量促炎、促凝血、促氧化和促纤维化介质如CRP、IL-6、IL-17、纤维蛋白原、纤溶酶原激活物抑制物、TGF-β等,这些促炎细胞因子通过循环到达皮肤促进角质形成细胞增殖、增加炎症以及上调各种趋化因子而加重银屑病[4]。Vasseur等人证实了这一观点,他们通过喂养小鼠高脂饮食、背部涂抹咪喹莫特的方法重现了NASH合并银屑病的模型,结果发现NASH小鼠的皮肤红斑、鳞屑、表皮增殖现象较正常饮食小鼠更为严重,皮损中IL-17A和IL-22的表达水平比正常饮食小鼠高出近7倍。肝脏中TNF-α和IL-6转录表达增强,肝星状细胞活化标志物α-SMA和TGF-β等均存在过度表达现象[54]。
5 结论
目前关于银屑病和NAFLD之间的联系还没有受到临床医生的普遍重视,我们的综述重点讨论了银屑病和NAFLD之间的相关流行病学证据、共有的生物学特征以及炎症通路在银屑病伴发NAFLD中的作用。虽然目前研究有限,临床研究少之又少,但银屑病和NAFLD之间的紧密联系可见一斑,两者之间互相影响的程度可能会超出我们的想象,当然这需要更多的研究去证实。若在临床防治中,在治疗银屑病清除其皮损的同时,还能改善肝脏脂肪沉积与肝脏炎症,防止其向肝纤维化、肝硬化、肝细胞肝癌等不良结局转变,这对延长银屑病患者寿命,改善患者生命质量都具有重要临床意义,同时也为探索治疗NAFLD药物新靶点奠定了基础。
