蔬菜农药残留模型样品制备研究
2022-05-28尹丽颖曹劲宏
尹丽颖 曹劲宏 宋 洋 马 静 吴 迪
(1.北京市怀柔区农产品质量安全综合质检站,北京 101400;2.北京市植物保护站,北京 100029)
在农产品质量安全检测体系中,农药残留模型样品对整个检测质量控制体系起到核心作用,被广泛应用于仪器性能验证、实验室质量控制、实验室间比对、检测技能竞赛、农药残留研究等方面。蔬菜农药残留模型样品制备一般有两种方法,分别是自然机体污染法和空白基质加标法。前者是将药物直接喷施于蔬菜上,得到含有药物的阳性样品,后者是将药物标准溶液添加至空白样品中。两种方法得到的样品存在很大差别,前者目标检测物是与整个蔬菜相结合,符合现实蔬菜生产中喷施农药实际情况,后者是目标检测物仅在匀质后的蔬菜糜中。蔬菜中农药残留检测的实施按流程可分为样品制备、提取、净化、测定、数据分析与结果报告等环节[1]。其中,样品制备是检测的关键环节之一,该环节采用空白基质加标法制备质控样品,虽然具有制备操作过程简单、可以任意设计样品的加标浓度、可制备多种浓度的农药残留模型等优点[2],但从检测环节上不能做到对样品制备环节的质量控制,且容易出现样品不均匀的问题。另外,其他一些对样品处理、制备等环节需要有所质控的实验研究,如研究不同清洗方法、不同储存时间对蔬菜农药残留的影响等,均需要采用自然机体污染法制备蔬菜农药残留模型样品。
蔬菜基质复杂,研制以实物为基质、均匀性与稳定性好的农药残留模型样品对农药残留检测具有重要意义[3],同时样品中目标物的残留浓度对实验质量控制和研究也有重要影响,目标物残留浓度太高或者太低都达不到质控和研究的目的。有研究表明,采取浸泡方式获取的农药残留模型样品要优于喷施方式,可以满足重复性、均匀性的需要[4]。但是在浸泡的过程中,最佳浸泡时间为多少,浸泡浓度与目标药物残留浓度水平的关系如何,如何实现农药残留模型样品需要的药物残留浓度等却鲜有报道。本研究分别选择有机磷类、有机氯类、拟除虫菊酯和氨基甲酸酯类农药中常见的毒死蜱、腐霉利、高效氯氟氰菊酯和克百威作为残留对象,以樱桃番茄和菠菜为基质,以浸泡方式制取这2种蔬菜中4种农药的蔬菜农药残留模型样品,采用气相色谱法、高效液相色谱法测定蔬菜中农药残留量[1],分析比较不同浸泡时间下2种蔬菜中的农药残留量,研究不同浸泡浓度与目标药物残留浓度水平之间的关系,为实现制备所需目标浓度的蔬菜农药残留模型样品提供指导依据。
一、材料与方法
(一)主要仪器与试剂
1.主要仪器。GC-2010 Plus气相色谱仪(配FPD检测器,日本岛津公司);Nexis GC-2030气相色谱仪(配ECD检测器,日本岛津公司);LC-20AD高效液相色谱仪(配柱后衍生系统和荧光检测器,日本岛津公司);YP502N电子分析天平(上海菁海仪器有限公司);EP3010组织捣碎机(德国博朗公司);T18高速组织分散器(德国IKA公司);ASE-24固相萃取装置(天津奥特赛恩斯仪器有限公司);MTN-2800W-24氮吹仪(天津奥特赛恩斯仪器有限公司);Vortex3000涡漩式混合器(德国普迈公司);RE52-99旋转蒸发仪(上海亚荣生化仪器厂)。
2.主要试剂与耗材。农药标准品[毒死蜱1 000 μg/mL、腐霉利1 000μg/mL、高效氯氟氰菊酯1 000 μg/mL、克百威1 000μg/mL,农业农村部环境质量测试中心(天津)];乙腈、丙酮、甲醇、正己烷(均为色谱纯,美国霍尼韦尔公司);氯化钠(分析纯,140℃烘烤4 h,国药集团化学试剂上海有限公司);滤膜(0.22μm,有机溶剂膜,日本岛津公司);固相萃取柱(弗罗里矽柱1 000 mg/6 mL、氨基柱500 mg/6mL,日本岛津公司);0.05 mol/L氢氧化钠溶液(英国Pickering公司);OPA稀释溶液(英国Pickering公司);邻苯二甲醛、巯基乙醇(均为色谱纯,英国Pickering公司);腐霉利原药(纯度95.0%)、毒死蜱原药(纯度98.8%)、高效氯氟氰菊酯原药(纯度97.0%)、克百威原药(纯度98.4%),均为东莞市泓信生物科技有限公司生产。
3.样品采集。樱桃番茄、菠菜采样于北京市怀柔区某蔬菜生产基地,生产过程中未喷施过任何农药。
(二)实验方法
1.浸泡时间对蔬菜农药残留的影响。将高效氯氟氰菊酯原药用丙酮溶解后,经自来水(16℃)稀释制成农药浸泡液。将樱桃番茄和菠菜分别分成6份,去除泥土和腐烂部分,同时完全浸泡至上述农药浸泡液中,浸泡时每5 min取出1份,置于通风橱中沥干表面水分。每取出1份蔬菜时,将其余浸泡的蔬菜翻动一次,确保蔬菜完全染毒,浸泡过程中室温保持在20℃左右。全部浸泡结束后,将染毒后沥干表面水分的蔬菜分别用保鲜袋包装密封后放置于4℃冰箱中冷藏24 h,用组织捣碎机打碎,混匀,待测。
2.蔬菜农药残留模型样品制备。将高效氯氟氰菊酯、腐霉利、毒死蜱、克百威原药用丙酮溶解后,经自来水(16℃)稀释制成不同浓度的混合农药浸泡液。将同样质量(50 g)的菠菜、樱桃番茄去除泥土和腐烂部分,同时完全浸泡至上述混合农药浸泡液中,浸泡20 min,浸泡过程中每5 min翻动一次蔬菜,确保蔬菜完全染毒,室温保持在20℃左右。浸泡结束后,将蔬菜捞出,置于通风橱中沥干表面水分,用保鲜袋包装密封后放置于4℃冰箱中冷藏24 h,用组织捣碎机打碎,混匀,待测。
3.蔬菜农药残留含量与浸泡浓度线性关系的建立。根据测得的樱桃番茄和菠菜中各农药残留含量(y)和已知初始农药浸泡浓度(x),分别建立2种蔬菜中农药残留含量与浸泡浓度的线性关系(y=kx)。
4.样品前处理。分别准确称取对照组(空白)样品和待测样品(浸泡后样品)25.0 g放入匀浆机中,加入50 mL乙腈,高速匀浆2 min后用滤纸过滤,滤液收集到装有5~7 g氯化钠的100 mL具塞量筒中,收集滤液40~50 mL,盖上盖子,剧烈振荡1 min,在室温下静置30 min。
从具塞量筒中分别吸取3份10 mL上层处理液,分别放入150 mL茄形瓶中,在旋转蒸发仪45℃水浴加热,蒸发至近干,1份加入2mL丙酮,备用;1份加入2 mL正己烷,待净化;1份加入2 mL甲醇-二氯甲烷(1∶99,V∶V)溶解残渣,待净化。
将上述加入丙酮的备用液用约3 mL丙酮分3次冲洗,每次丙酮用量约1 mL,完全转移至5 mL容量瓶内定容,在涡旋混合器上混匀后过0.22μm滤膜,滤液供气相色谱仪(FPD检测器)测定。将上述加入正己烷的备用液过活化后的弗罗里矽柱,用5 mL丙酮-正己烷(10∶90,V∶V)冲洗后过柱2次,收集洗脱液在水浴温度50℃条件下氮吹蒸发至<5 mL,用正己烷定容至5.0 mL,在涡旋混合器上混匀,滤液供气相色谱仪(ECD检测器)测定。将上述加入甲醇-二氯甲烷的备用液过活化后的氨基柱,用2 mL甲醇-二氯甲烷(1∶99,V∶V)冲洗后过柱2次,收集洗脱液在水浴50℃条件下氮吹蒸发至近干,用甲醇定容至2.5 mL,在涡旋混合器上混匀后过0.22μm滤膜,滤液供高效液相色谱仪测定。
5.仪器检测条件。 (1)气相色谱(配FPD检测器)检测条件。柱升温程序:150℃保持2 min,以30℃/min升至200℃保持5 min,以5℃/min升至240℃(不保持,达到温度后立即执行新的升温程序继续升温),以50℃/min升至280℃保持3.53 min。进样口温度为280℃;检测器温度为300℃;色谱柱流量为10 mL/min;色谱柱为Intertcap 17(1.0μm×0.53 mm×30 m)。(2)气相色谱(配ECD检测器)检测条件。柱升温程序:150℃保持2 min,以6℃/min升至270℃保持18 min。进样口温度为250℃;检测器温度为300℃;色谱柱流量为1.40 mL/min;色谱柱为Intertcap 1(0.25μm×0.25 mm×30 m)。(3)高效液相色谱检测条件。流动相:A相为甲醇;B相为纯水;C相为OPA稀释溶液(含0.1 g邻苯二甲醛、2 g巯基乙醇);D相为0.05 mol/L氢氧化钠溶液。柱温箱温度为50℃;水解温度为100℃;激发波长为330 nm;发射波长为465 nm。
6.数据处理。实验采用外标法定量,用Excel进行数据处理。参照NY/T 761-2008《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》标准方法[1],将上述处理过的样品经过测定,得到峰面积,计算样品中被测农药残留量(w,单位以mg/kg表示),计算方法见公式(1)。
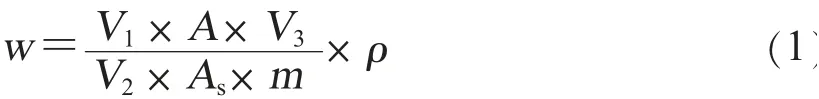
公式(1)中,ρ为标准溶液中农药的质量浓度(mg/L);A为样品溶液中被测农药的峰面积;As为农药标准溶液中被测农药的峰面积;V1为提取溶剂总体积(mL);V2为吸取出用于检测的提取溶液的体积(mL);V3为样品溶液定容体积(mL);m为试样的质量(g)。
7.质量控制。质量控制采取计算加标回收率的方法得出。称取25.0 g樱桃番茄和菠菜的匀质空白样品(精确至0.1 g)于200 mL烧杯中,分别添加3个浓度梯度的4种农药标准工作液250μL,工作液浓度分别为10.0、50.0、100.0 mg/L,对应添加浓度分别为0.1、0.5、1.0 mg/kg。在重复性条件下,对低中高水平加标的樱桃番茄和菠菜样品进行测定,按照上文“4.样品前处理”的方法对样品进行前处理。加标回收率计算方法见公式(2)。
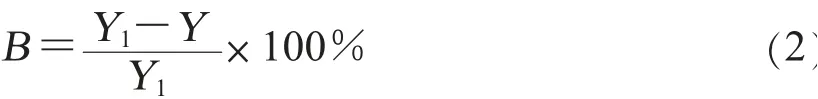
公式(2)中,B为加标回收率(%);Y为空白试样中被测组分的含量(mg/kg);Y1为加标试样中被测组分的含量(mg/kg)。
二、结果与分析
(一)方法检出限按照上述仪器条件建立的气相色谱和液相色谱方法,以3倍信噪比所对应的浓度值确定4种农药的检出限,结果显示,高效氯氟氰菊酯的检出限为0.000 26 mg/kg,腐霉利的检出限为0.000 30 mg/kg,毒死蜱的检出限为0.004 70 mg/kg,克百威的检出限为0.000 94 mg/kg。
(二)质量控制结果通过3次平行加标实验,4种农药在樱桃番茄中的平均回收率为86.46%~104.47%,RSD均≤5%(见表1);4种农药在菠菜中的平均回收率为83.82%~109.11%,RSD均≤5%(见表2)。该分析方法的准确性符合GB/T 27404-2008《实验室质量控制规范 食品理化检测》[5]的要求,实验检测结果可信。

表1 樱桃番茄中4种农药的加标回收率 (n=3)

表2 菠菜中4种农药的加标回收率 (n=3)
(三)不同浸泡时间对蔬菜农药残留含量的影响将上文“一、材料与方法”中“1.浸泡时间对蔬菜农药残留的影响”的待测样品按照上述前处理方法及仪器条件进行测定,实验结果见表3。由表3可以看出,随着农药浸泡时间的增大,樱桃番茄和菠菜中农药残留含量的变化趋势基本一致,前15 min内,农药残留含量不稳定,20 min后农药残留含量变化相对平缓,考虑到尽量减少浸泡时间和实验结果的稳定性,选择20 min为最佳浸泡时间。

表3 浸泡时间对蔬菜农药残留含量的影响
(四)蔬菜农药残留含量与浸泡浓度之间的线性关系将上文“一、材料与方法”中“2.蔬菜农药残留模型样品制备”的待测样品按照上述前处理方法及仪器条件进行测定,实验结果见表4。

表4 两种蔬菜在不同浓度农药浸泡处理后的农药残留含量
分别根据不同农药浸泡浓度对应的樱桃番茄和菠菜中农药残留含量,以浸泡浓度为横坐标,农药残留含量为纵坐标,绘制农药残留含量与浸泡浓度之间的趋势图(见图1)。如图1所示,随着农药浸泡浓度的增大,樱桃番茄和菠菜中农药残留含量均增大,且与农药种类无关,增大趋势呈线性关系,其中菠菜基质对应的线性方程为y=1.375x;樱桃番茄基质对应的线性方程为y=0.035x;相关系数R2均>0.99,线性关系良好。
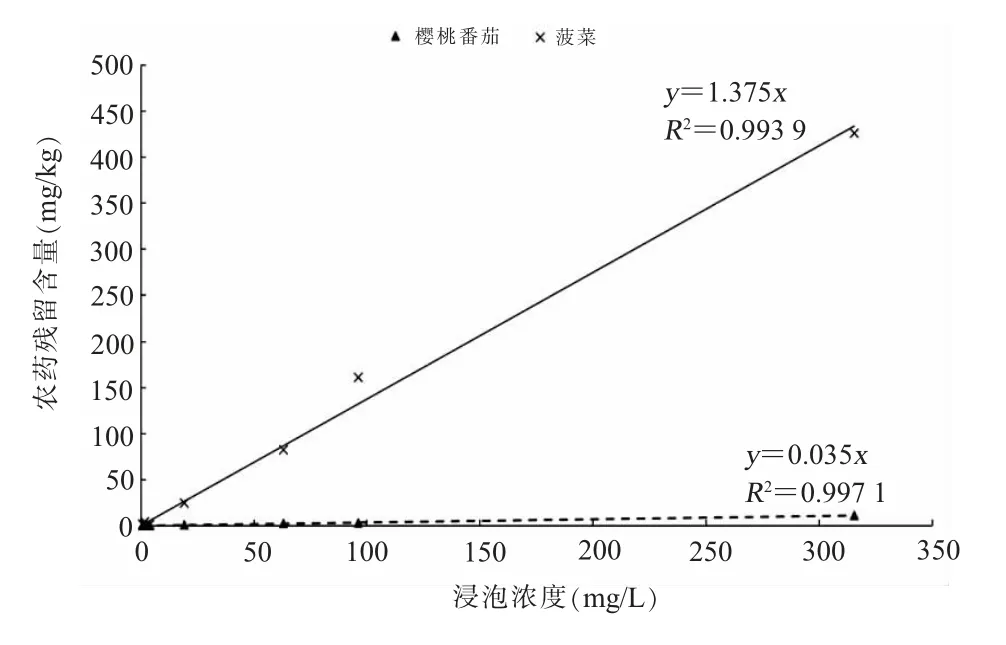
图1 在不同浸泡浓度下菠菜和樱桃番茄中农药残留量的变化趋势
三、结论
本研究分别选择有机磷类、有机氯类、拟除虫菊酯类和氨基甲酸酯类农药中常见的毒死蜱、腐霉利、高效氯氟氰菊酯和克百威作为农药残留对象,以樱桃番茄和菠菜为基质,以浸泡方式制取以上2种蔬菜中4种农药的蔬菜农药残留模型样品,采用气相色谱法、高效液相色谱法测定蔬菜中农药残留量,得出最佳农药浸泡时间为20 min;在浸泡时间为20 min的条件下,目标农药残留含量与浸泡浓度之间呈线性关系,线性方程分别为y=1.375x(菠菜)、y=0.035x(樱桃番茄)。以浸泡方式制取农药残留模型样品,在浸泡、翻动、晾干表面水分等环节有很大的主观性,该方法适合大批量制取大致浓度的农药残留样品,以用于快速检测技能竞赛、农药残留研究实验等,若将其应用于能力验证、质量控制等,还需要对样品进行定值,并进行均一性和稳定性实验。
