过表达miR-9对黄鳝受精卵中基因转录组水平的影响
2022-05-27薛凌展毕保良孔令富李大鹏
薛凌展 袁 茵 毕保良 孔令富 严 晖 李大鹏 高 宇
(1. 云南农业大学高原渔业资源保护与可持续利用重点实验室, 昆明 650201; 2. 福建省淡水水产研究所, 福州 350002; 3. 云南农业大学动物科学技术学院, 昆明 650201; 4. 华中农业大学水产学院, 武汉 430070)
MicroRNA(简称miRNA)长度为22 nt左右, 是一类高度保守的小分子非编码RNA, 具有调控基因表达的功能[1]。miRNA作为表观变化的关键调节因子, 在硬骨鱼类生长发育、组织器官分化、配子形成, 受精卵发育、性腺发育及内分泌调控等方面发挥作用[2]。
目前研究发现, 生殖细胞中的miRNA和相关靶基因的调控关系网络共同影响脊椎动物性别分化的过程[3,4], 性别分化的关键点是原始性腺转化为精巢或卵巢[5]。因此, 对性别决定与性别分化特异miRNA及其靶基因的鉴定, 及miRNA调控网络的研究, 能更好地解释miRNA在精巢和卵巢发育过程中的重要性[1]。
miRNA在鱼类性别分化方面的研究, 大多数是利用高通量测序技术对表观差异进行描述, 并结合miRNA靶基因的预测与功能鉴定, 进而分析特定miRNA可能的功能。如大西洋庸鲽(Hippoglossus hippoglossu)和施氏鲟(Acipenser schrenckii)中具有性别表达差异的miRNA, 其靶基因大多与生殖配子形成相关[6,7]。在模式动物的研究中, 一些与鱼类生殖发育过程密切相关的miRNA及其作用机制被解析出来, 如miR-726在减数分裂的过程中调控青鳉(Oryzias latipes)联会复合体蛋白3(SYCP3), 从而影响精子的发生[8]; miR-430调控斑马鱼(Danio rerio)生殖相关的靶基因(TDRD7、nanos1、vasa和C1q-like因子等), 促进配子的减数分裂和细胞分化,从而影响原始生殖细胞(PGCs)的发育和迁徙等过程[9—11]; miR-19a和miR-19b共同调控黄鳝(Monopterus albus)精巢分化过程的关键基因Dmrt1等[12]。
黄鳝在发育的过程中具有先雌后雄天然性逆转的特征[13], 近几年随着生物技术的快速发展, 黄鳝性腺各个发育阶段的转录组信息[14,15], 非编码RNA调控网络[12,16]和基因组[17]等高通量测序数据呈爆发性增长。通过构建的黄鳝基因编辑技术, 鉴定出了一些可能与黄鳝性腺发育和性别分化相关的基因或蛋白(Dmrt1、Cyp19a1a和Foxl2等)[18], 黄鳝正逐渐成为研究脊椎动物性腺发育的模式物种[19]。我们前期研究发现, miR-430b与miR-9分别调控黄鳝转录因子Foxl2和Foxl3[16,20]。因此, 本研究通过在黄鳝受精卵中过表达miR-9的生物学研究, 探讨miR-9对内分泌系统相关基因的调控通路, 为阐明黄鳝性别分化的分子机制提供理论依据。
1 材料与方法
1.1 实验动物
黄鳝人工繁育试验在中国水产科学研究院长江水产研究所基地开展, 催产方法参考胡炜等[21]的研究, 雌鳝每1 kg体重注射30 mg PG+100 μg LHRH-A2+5000 IU HCG; 采用一针注射法, 雌鳝注射24h后, 雄鳝按50 μg/1kg体重注射LHRH-A2。雌鳝效应期约40h后, 人工获取卵子和精子, 半干法人工授精, 得到黄鳝I细胞期的受精卵。
1.2 黄鳝miR-9前体序列的克隆与分析
以其他物种的miR-9的成熟序列在黄鳝参考基因组(AssemblyM.albus1.0)[17]中进行比对, 发现1处可能的miR-9前体序列, 通过Primer3Plus软件分别在成熟序列上下游400 bp左右的位置设计一对引物(表 1), 引物由天一辉远生物科技有限公司合成。
根据组织DNA提取试剂盒(Omega Bio-Tek)说明书要求提取黄鳝卵巢基因组DNA, 以黄鳝DNA为模板, 采用PremixTaq酶(TaKaRaTaqTMVersion 2.0)扩增目的基因, 扩增完成后, 按照DNA凝胶回收试剂盒(Omega Bio-Tek)说明书要求进行目的基因的回收与纯化, 将目的基因与pMD19-T载体(TaKaRa)连接后的产物, 转化至大肠杆菌DH5α, 在含有氨苄青霉素Amp(100 μg/mL)的LB平板上进行筛选。经PCR鉴定后, 将阳性克隆送往天一辉远生物科技有限公司测序, 用双脱氧链终止法测序。
检查测序峰图后, 用miRBase BLASTN[22]对所测miR-9前体序列进行分析; Clustal W方法[23]比较不同物种之间miR-9前体序列的相似度; RNAfold Server[24]根据最小自由能和碱基对概率预测miR-9前体的二级结构。
1.3 受精卵的显微注射
黄鳝miR-9模拟物(agomiR-9)及相应的阴性对照(agomiR-NC)由吉玛基因股份有限公司合成, 模拟物以及阴性对照按说明书要求溶解于DEPC水中备用。
黄鳝miR-9模拟物 agomiR-9: sense: 5′-UCUU UGGUUAUCUAGCUGUAU-3′
阴性对照agomiR-NC: sense: 5′-UUCUCCG AACGUGUCACGUTT-3′
将受精卵置于培养皿中, 在体式显微镜(Nikon)下调整黄鳝胚胎动物极朝上, 用氮气加压的定量显微注射系统(Warner PLI-100A)逐枚注射到黄鳝I细胞期受精卵中, 每个受精卵分别注射2 nL 的agomiR-9(2 μmol/L)、阴性对照agomiR-NC(2 μmol/L)和DEPC处理水。注射部位为受精卵动物极。显微注射后的受精卵放在与对照组温度、光照等条件相同的孵化盆中孵化。曝气水中28℃下分别孵育24h、48h和72h, 每组取10个受精卵混合, 3次生物学重复,分别标记为agomiR-9、agomiR-NC和Control后, 立即转入液氮中保存, 用于提取总 RNA、进行转录组测序等后续实验。
1.4 总RNA的提取与目的基因的克隆
按照Trizol Reagent(Invitrogen)说明书的要求提取6个受精卵样品的总RNA, 每个RNA样品中加入2 U的RNase-free DNase, 37℃孵育30min, 随后加入2 μL EDTA终止反应, 去除基因组DNA的污染。RNA浓度分别用微量核酸检测仪Nanodrop 2000c(Thermo scientific)和1.5%的琼脂糖凝胶电泳检测,然后在Agilent 2100生物分析仪(Agilent Technolo-gies)上评估RNA质量。按照反转录试剂盒RevertAidFirst Stand cDNA Synthesis(Thermo scientific K1622)说明书要求反转录为cDNA, 目的基因克隆的方法同前。
1.5 黄鳝受精卵miR-9和foxl3的表达量分析
反转录体系中分别加入miR-9特异茎环反转录引物和u6的下游引物(表 1), cDNA于-20℃保存。荧光定量反应体系均为20 μL, 2×Master qPCR Mix(北京擎科生物科技有限公司)10 μL, 上游引物(20 μmol/L)1 μL, 下游引物(20 μmol/L)1 μL, 5倍稀释的cDNA模板2.0 μL, RNase/DNase free H2O补足20 μL。
Real-time PCR反应在Bio-Rad CFX Connect Real-Time PCR仪中进行。反应条件为: 95℃ 1min;然后进行40个循环, 其条件为95℃ 10s, 60℃ 20s,72℃ 20s; 72℃延伸时采集荧光信号。阴性对照以无RNase的H2O代替 cDNA模板, 每个样品及阴性对照均设3个重复。根据溶解曲线判断引物的特异性。选取黄鳝u6 snRNA作为miRNA real-time PCR的内参基因[25], 结果采用2-ΔΔCt法[26]对miRNA进行相对表达量分析。将含有目的基因的质粒作为标准品, 并用微量核酸检测仪Nanodrop 2000c测定质粒浓度, 计算出标准品的拷贝数, 将标准品10倍梯度稀释, 构建标准曲线。阴性对照以无RNase的H2O代替 cDNA模板, 每个样品及阴性对照均设3个重复。根据标准曲线计算目的基因在受精卵中的拷贝数(copies/μL)。
半定量PCR反应在Bio-Rad T100 PCR仪中进行。PCR反应体系均为50 μL, PCR mix(北京擎科生物科技有限公司)46 μL, 上游引物(20 μmol/L)1 μL,下游引物(20 μmol/L)1 μL, cDNA模板2.0 μL。反应条件为: 98℃ 2min; 然后进行30个循环, 其条件为98℃ 10s, 60℃ 30s, 72℃ 30s; 最后72℃ 1min结束反应。扩增完成后, 取PCR产物5 μL, 1.2%琼脂糖凝胶电泳观察结果。
1.6 黄鳝受精卵的转录组测序
对总RNA质量进行完整的测量并检测合格之后, 用带有oligo(dT)的磁珠富集mRNA, 使用fragmentation buffer将富集的mRNA随机打断成短片段。以mRNA为模板, 使用随机引物逆转录合成第一链cDNA, 再通过DNA聚合酶I, RNase H和dNTP合成第二链cDNA。按照QIAquick PCR纯化试剂盒说明书要求进行末端修复纯化双链cDNA,并添加poly(A)连接至测序接头。琼脂糖凝胶电泳选择不同大小的连接产物, 通过PCR扩增构建出不同大小的cDNA文库, 对文库使用Illumina HiSeq 2500进行测序(广州基迪奥生物科技有限公司)。
1.7 差异基因的筛选
测序之后, 首先对初始数据Raw Reads进行质量检测和过滤, Raw Reads经过去接头、去除低质量Reads后得到Clean Reads, 后续的分析均以Clean Reads为标准。
使用HISAT2 v2.05软件[27], 将Clean Reads与黄鳝参照基因组(AssemblyM. albus1.0)[17]进行比对,计算每个基因FPKM(Fragments Per Kilobase of exon model per Million mapped fragments)在不同样本中的表达量。DESeq2 v1.61软件[28]比较两个组合之间的差异表达, 使用错误发现率(False Discovery Rate,FDR)来调整所得的P值的阈值, 将差异倍数(Fold Change, FC)|log2FC|≥ 1.5且FDR<0.05 作为差异表达基因的筛选标准。
1.8 差异表达基因的GO功能注释和KEGG通路富集分析
通过clusterPofiler v3.4.4软件[29]实现差异表达基因的 GO 富集分析和KEGG 通路富集分析。将筛选获得的差异基因, 通过Omicshare云平台(https://www.omicshare.com/), 对差异表达基因进行GO 功能注释和 KEGG 通路富集分析可视化。
1.9 候选基因在黄鳝性腺转录组中的表达分析
从NCBI Sequence Read Archive数据库中获取黄鳝性腺转录组高通量测序数据, 黄鳝卵巢、卵睾体和精巢的登录号分别为SRR1993742、SRR1993743和SRR1993744。Raw Reads经过去接头、去除低质量Reads后, 得到的Clean Reads进行分析。每个数据集的Reads数通过edgeR程序包进行归一化, 不同样本的数据以RPKM/FPKM标准化(每千个碱基的转录每百万映射读取的reads/fragments)进行差异基因表达分析。使用错误发现率(False Discovery Rate,FDR)来调整所得的P值的阈值, 将FDR<0.01作为差异表达基因的筛选标准。
1.10 统计与分析
实验数据均采用以平均值±标准差(mean±SD)表示, 用SPSS v22.0软件(IBM SPSS Statistics for Windows)进行统计与分析。检测实验数据正态分布和方差齐性后, 采用单因素方差分析(One-way ANOVA)Tukey’sHSD检验,P<0.01认为在统计学具有显著性差异。
2 结果
2.1 黄鳝miR-9前体序列的克隆与分析
根据miRBase数据库中哺乳类、鱼类、两栖类和无脊椎动物等物种miR-9前体序列的信息, miR-9成熟序列在不同分类阶元的物种中保守程度较高。黄鳝miR-9前体序列与袋獾(Sarcophilus harrisii)、中国仓鼠(Cricetulus griseus)和小鼠(Mus musculus)相似性较高, 为94.7%; 与囊舌虫(Saccoglossus kowalevskii)、赤拟谷盗(Tribolium castaneum)和紫色球海胆(Strongylocentrotus purpuratus)相似性较低, 为74.7%。通过克隆测序确定黄鳝miR-9的成熟序列为mal-miR-9: 5′-TCTTTGGTTATCTAG CTGTAT-3′。RNA二级结构预测中, 黄鳝miR-9前体序列构成茎环结构, 预测的最佳二级结构最小自由能(MFE)为-27.90 kcal/mol, 热力学总体自由能为-29.35 kcal/mol。
2.2 注射miR-9模拟物后黄鳝受精卵中miR-9的表达量
受精后24h、48h和72h, miR-9的表达量在各时间点之间均无显著性差异,foxl3无明显表达(图 1A)。
显微注射模拟物后, DEPC处理水试剂对照组(Control-DEPC)、miRNA模拟物对照组(agomiRNC)与空白对照组(Control)相比, miR-9的表达量在注射后24h和48h内无明显变化(P>0.01)。受精后24h和48h, miR-9的拷贝数均为4×106copies/μL左右(图 1C)。注射miR-9模拟物48h后, 黄鳝受精卵中miR-9的表达量与对照组相比升高30000倍以上(图 1B,P<0.01)。
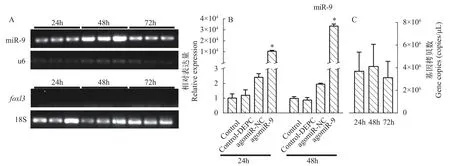
图1 受精后不同时间和显微注射后miR-9在黄鳝受精卵中的表达量Fig. 1 Expression of miR-9 in fertilized eggs of rice field eel after fertilization and injection
2.3 黄鳝受精卵转录组测序质量评估
黄鳝受精卵转录组测序结果显示, 总共获得Raw bases 为43399558800, Clean bases为42976103056。测序质量统计结果表明, 测序的质量值 20(Q20)百分比均超过 98%, 质量值 30(Q30)百分比均超过94%, GC 含量所占比例为 49.66%—50.56%(表 2)。测序质量总体较好, 可进行后续分析。
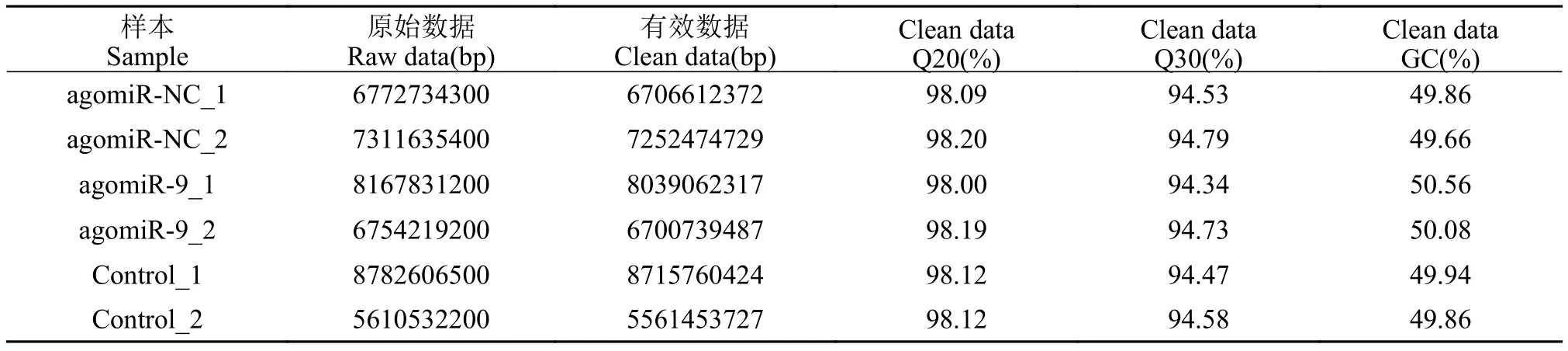
表2 黄鳝受精卵转录组测序数据统计Tab. 2 Summary statistics of rice field eel fertilized egg transcriptome sequencing data
2.4 miR-9注射黄鳝受精卵转录组分析
将转录组数据与黄鳝参考基因组进行比对, 所有6个测序样本中均有92%以上的reads可以比对到黄鳝参考基因组。根据全部可定位到基因组上的reads(Total Mapped reads)比对结果, 大部分reads在参考基因组中的分布位置为外显子区域。黄鳝受精卵注射miRNA模拟物48h后, 与对照组(Control)相比, 493个基因表达量上调, 228个基因表达量下调; 与阴性对照组(agomiR-NC)相比, 526个基因表达量上调, 435个基因表达量下调; Control与agomiR-NC之间, 16173个基因表达量差异不显著。分别将3个处理组之间进行两两比较, 选择agomiR-9与对照组之间(Controlvs. agomiR-9和agomiR-NCvs. agomiR-9表达量差异显著的基因,对照组与阴性对照组之间(Controlvs. agomiR-NC)表达量差异不显著的基因, 并求三者的交集, 最终筛选得到157个基因(图 2)。

图2 不同处理组之间两两比较的Venn图Fig. 2 Venn diagram of pairwise comparison between different treatment groups
2.5 差异表达基因的GO功能注释
筛选出来的157个候选基因 GO 功能富集涉及生物过程(Biological processes)、细胞组分(Cellular components)和分子功能(Molecular functions)中33个小类(图 3), 其中生物过程15个, 包括单组织过程、细胞过程、新陈代谢过程、生物调控过程、发育过程和负调控过程等; 细胞组分13个, 包括细胞、细胞组分和膜组分等; 分子功能5个, 包括催化活性、转运活性和信号转导活性等。生长(GO:0040007,Pvalue=0.002304)、肌肉器官形态发生(GO:0048644,Pvalue=0.003119)、肌肉组织形态发生(GO:0060415,Pvalue=0.003119)为显著性GO富集条目。
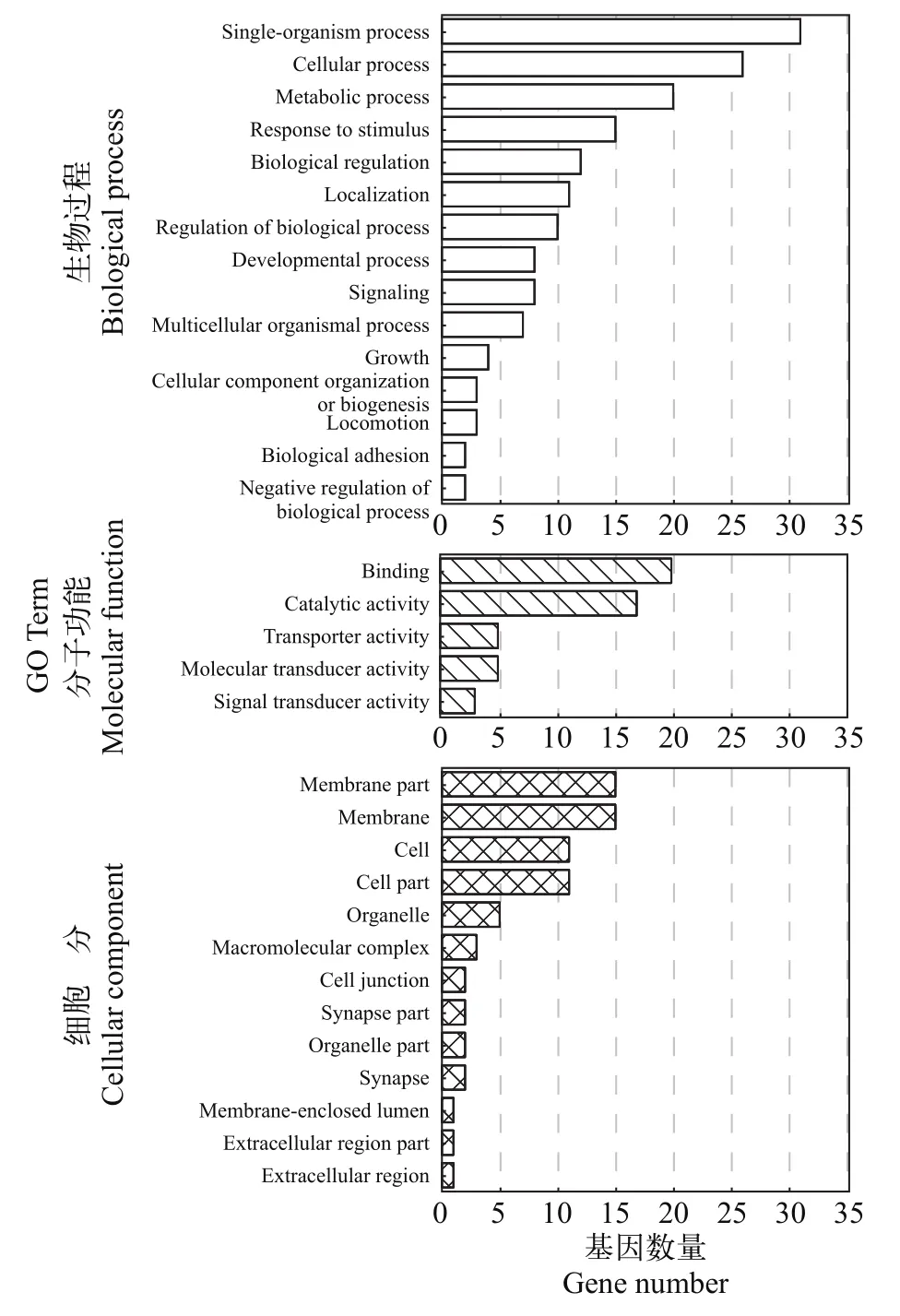
图3 差异表达基因的GO功能注释Fig. 3 GO function annotation of differentially expressed genes
2.6 差异表达基因的KEGG功能富集分析
筛选出来的157个候选基因进一步通过 KEGG系统分析差异基因涉及的代谢途径, 去除人类疾病后, 涉及有机体系统、新陈代谢、细胞生理过程、遗传信息处理过程、环境信息处理过程5大类, 其中有机体系统包括消化系统、内分泌系统、免疫系统、循环系统和神经系统等10个小类代谢通路(图 4A)。蛋白质消化吸收(ko04974,FDR=0.032175)、细胞外基质(ECM)受体相互作用(ko04512,FDR=0.04193)、松弛素信号通路(ko04926,FDR=0.047354)为显著性KEGG富集条目(图 4B)。
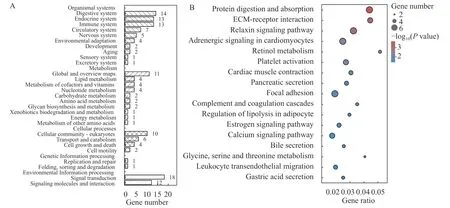
图4 差异表达基因的KEGG功能富集Fig. 4 KEGG functional enrichment of differentially expressed gene
2.7 miR-9模拟物注射黄鳝受精卵中差异表达基因的筛选
基于miR-9模拟物和对照组受精卵中基因FKPM 值变化倍数, 筛选到 28个差异表达基因(表 3)。tektin 4基因(tekt4)、环腺苷酸环化酶合成酶2a(adcy2a)、Ⅰ型细胞骨架角蛋白13(k1c13)、视黄醇脱氢酶5(rdh5)、lefty1基因(lft1)和胶原蛋白2(coll2)等基因的表达量在注射miR-9模拟物后出现不同程度的升高。成纤维细胞生长因子13b(fgf13b)、促甲状腺激素释放激素受体2(trhr2)、Claspin基因(clspn)、胶原蛋白XXI型α1(col21a1)、副肿瘤抗原Ma1(pnma1)、氯离子通道蛋白a3(slc26a3)和甜菜碱-同型半胱氨酸S-甲基转移酶(bhmt)的表达量在注射miR-9模拟物后出现不同程度的降低。
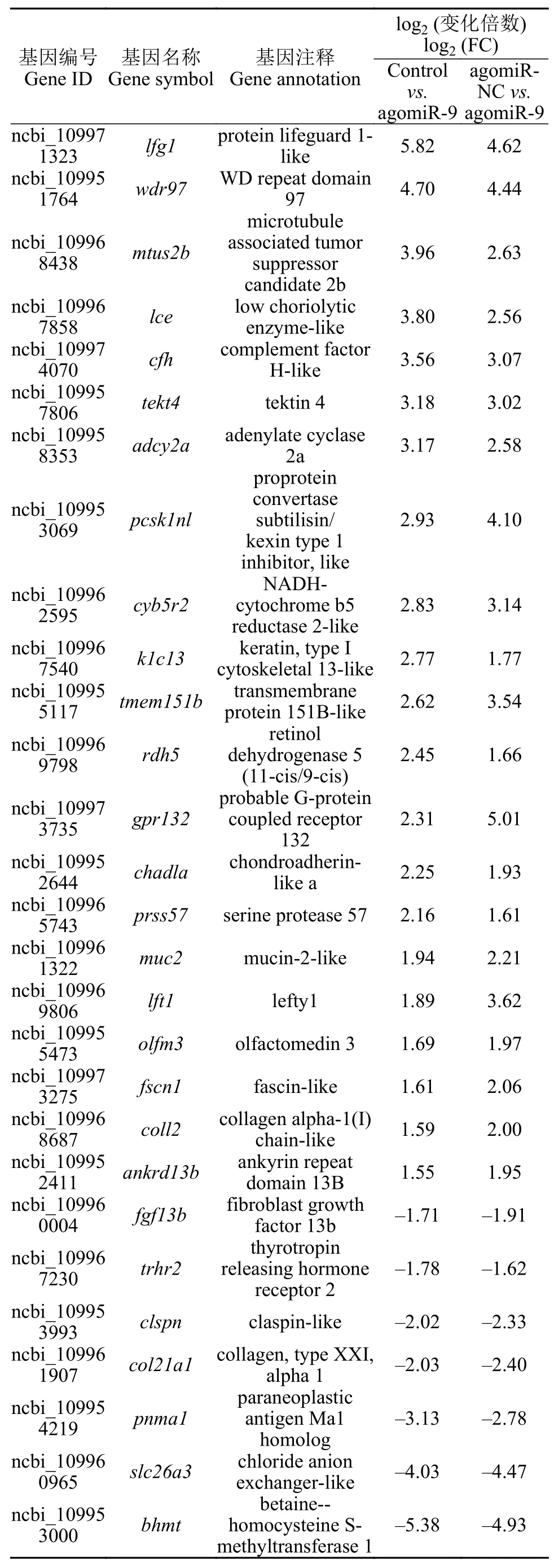
表3 筛选差异表达的基因Tab. 3 Filter differentially expressed genes
2.8 候选基因在黄鳝性腺转录组中的表达分析
分析筛选到的28个候选基因在黄鳝性腺转录组的表达量, 23个候选基因在黄鳝卵巢、卵睾体和精巢中无显著表达差异(FDR>0.01), 5个候选基因表达差异显著(图 5,FDR<0.01)。即精巢中lft1和coll2基因的表达量显著高于卵巢中(FDR<0.01); 精巢中lfg1基因的表达量显著高于卵睾体中, 而精巢中clspn基因的表达量显著低于卵睾体中(FDR<0.01);精巢中pnma1基因的表达量显著高于卵巢和卵睾体中(FDR<0.01)。
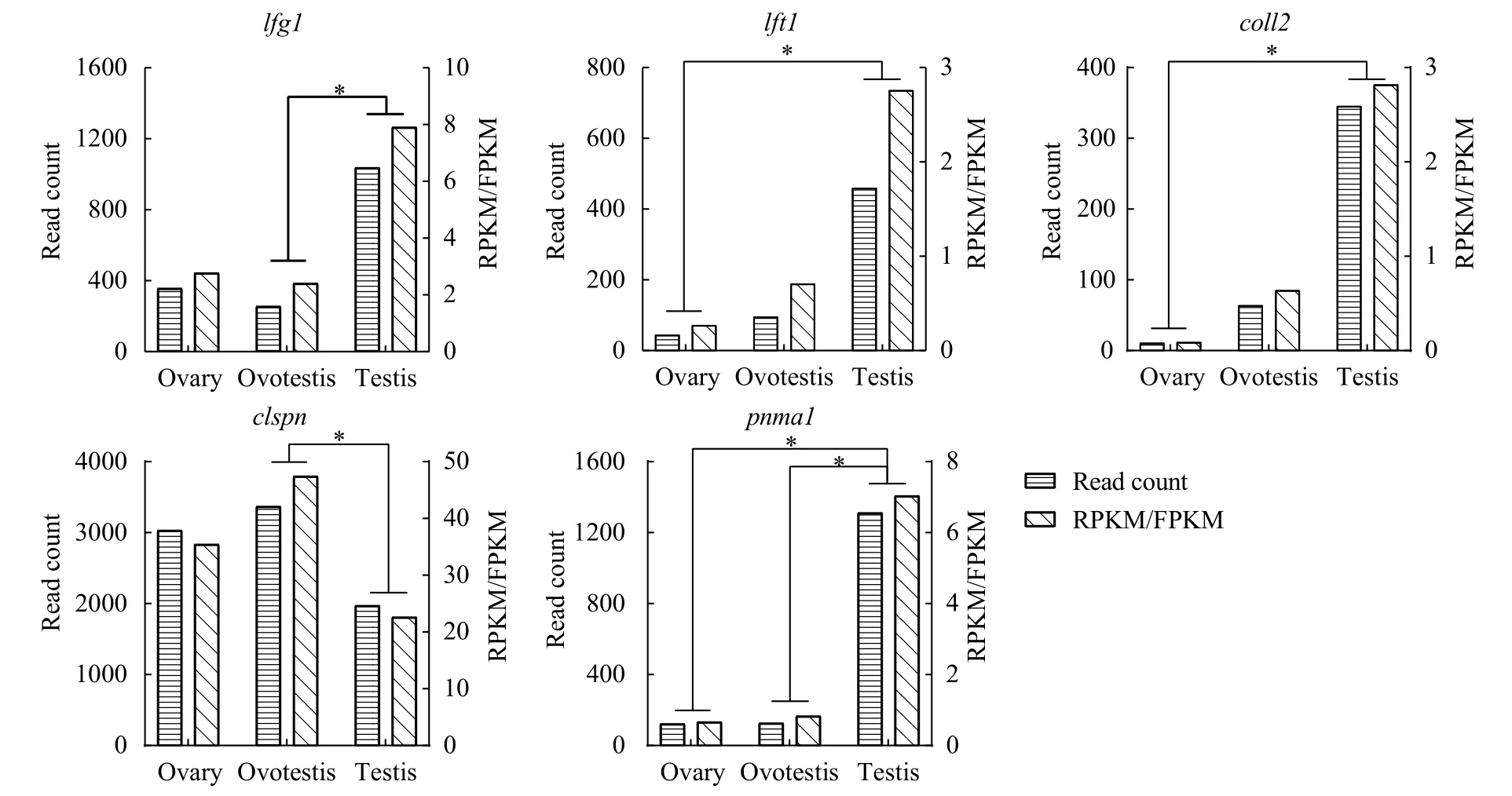
图5 候选基因在黄鳝性腺转录组中的表达差异Fig. 5 Differential expression of candidate genes in gonadal transcriptome of rice field eels
2.9 视黄醇脱氢酶基因(rdh5)及松弛素家族基因(rln)的组织表达分布
以目的基因在肝脏中的表达量为对照, 对其他器官中的表达量进行均一化(图 6)。rdh5在黄鳝眼睛中具有最高的表达水平(P<0.01), 而在脑、血液、精巢和卵巢中几乎没有表达(P<0.01)。rln3a和rln3b在黄鳝成鱼中的组织表达模式类似, 均在脑中和精巢中具有较高的表达水平, 但rln3a在眼睛中的表达量显著高于肝脏中的表达量(P<0.01)。rln3a和rln3b在脑中的表达水平分别比肝脏中高600倍和35倍左右(P<0.01), 在精巢中的表达水平分别比肝脏中高150倍和5倍左右(P<0.01)。

图6 rdh5、rln3a和rln3b基因在黄鳝成鱼不同组织中的表达Fig. 6 Tissues distribution of candidate genes rdh5, rln3a and rln3b in rice field eels
3 讨论
miR-9广泛存在于不同物种中, 并参与调控个体生长发育、细胞更新和细胞多向分化等生理过程[30]。近年来miR-9的研究大多集中于胚胎干细胞的发育与分化, miR-9通过下调HDAC5激活MEF2CGPM6A通路[31], 促进胚胎干细胞向神经元祖细胞分化[32]。另外, miR-9表达于小鼠和斑马鱼的眼睛组织中, 推测可能与眼睛的发育或视觉功能的维持相关[33,34]。Rdh5作为视觉周期中的一种关键酶, 可以引发一系列酶促反应产生视色素从而实现光电信号转换, 并参与视黄酸的形成[35]。本研究在miR-9过表达的受精卵中筛选到rdh5基因, 并且在黄鳝眼睛中高表达, 推测miR-9可能通过对rdh5基因的调控从而影响视觉功能的发育或维持。
我们之前研究发现miR-9等8个miRNA共同调控靶基因foxl3的表达[20], Foxl3的主要功能是抑制雌性生殖细胞中精子的发生, 同时Foxl3的敲除并不影响卵母细胞的发育[36]。在本研究中,foxl3在受精后24h、48h和72h内几乎没有表达; 显微注射miR-9模拟物后,foxl3在Control、agomiR-NC和agomiR-9组中的平均reads(FPKM)数分别为15(0.59)、19.5(0.87)和23(0.93), 均没有显著性差异。因此,foxl3在受精后72h之内未表达可能是过表达miR-9并没有导致foxl3表达变化的原因。每个特定的靶基因可以同时被多个miRNA所调控, 同时每个miRNA可以调控多个(甚至上百个)靶基因[1],此外过表达miRNA对内源蛋白的抑制率一般小于50%[37]。因此, miRNA对靶基因的调控作用比较温和, 单一miRNA的过表达可能无法导致单一靶基因转录和蛋白水平的过度波动。黄鳝受精卵中过表达miR-9后, 筛选出的候选基因中仅有5个基因(lfg1,lft1, coll2, clspn和pnma1)在成熟性腺中具有显著差异表达, 且与性腺发育无关。研究表明Foxl3通过2条通路启动卵子的发生, 即一条通路涉及雌性特异性的减数分裂, 另一条通路涉及促进卵泡的发育和抑制精子的发生[38]。在受精后1.3d(1.3 days post fertilization, dpf), 达到50%外包期时黄鳝原始生殖细胞(PGC)主要位于背部躯干两侧, 逐渐延伸到躯干中部和未来的泄殖腔孔之间, 直到8 dpf完全观察不到PGC[39]。推测受精后72h之内的受精卵中存在PGC的迁移, 但并无减数分裂和卵泡发育等相关过程的发生, 可能是受精卵中foxl3基因几乎不表达的原因。
miRNA作为转录后调控表观变化的关键因子,在基因调控网络中发挥协作作用[40]。因此, 对miRNA单一靶基因的鉴定, 很难解释特定miRNA的生物学功能; 而对单一miRNA所有起响应靶基因的研究, 则更有利于阐述miRNA的生物学功能。miR-9在多种鱼类的雌雄性腺中呈现出显著的表达差异, 如黄颡鱼(Pelteobagrus fulvidraco)、牙鲆(Paralichthys olivaceus)和尼罗罗非鱼(Oreochromis niloticus)等[41—43]。在其他鱼类中, miR-9调控的靶基因包括类固醇代谢通路中的关键代谢酶, 如芳香化酶(Cyp19a)、类固醇合成快速调节蛋白(StAR)和StAR相关的脂质转移域(STARD5)等[44]。本研究在miR-9过表达的黄鳝受精卵中, 筛选到的松弛素信号通路和雌激素信号通路与生殖细胞的发育直接相关。rln3a和rln3b在日本鳗鲡(Anguilla japonica)脑中后区域高表达[45], 与本研究结果类似。另外,在斑马鱼幼鱼的甲状腺和胰腺区域也检测到松弛素基因的表达, 从而证明了松弛素作为旁分泌和内分泌激素的作用[46]。rln3a基因的突变影响罗非鱼精子发生的启动和精原细胞的增殖, 使之不能正常受精。精子活力相关参数显著低于对照组[47]; 松弛素可能通过调节精原细胞的自我更新和促进细胞接触来影响精子发生[48]。本研究中rln3a和rln3b呈性腺二态性表达, 推测可能与黄鳝精巢的发育过程相关。
鱼类性腺的发育及成熟主要由下丘脑-垂体-性腺(HPG)轴为主的神经内分泌途径进行调控[49]。本研究筛选到的adcy2a基因与内分泌系统直接相关,涉及雌激素信号通路、卵巢类固醇生物合成、皮质醇的合成和分泌等。雌激素可以促进adcy2a的表达, 从而促进间充质干细胞中环腺苷酸(cAMP)的产生[50], cAMP是参与生殖系统发育的主要调节途径(如Sonic Hedgehog信号)中的关键第二信使[51]。Tekt4特异性表达于小鼠精巢中, 敲除tekt4基因的雄性小鼠精子运动能力严重下降, 可能是小鼠弱精症和雄性不育的主要原因[52]。目前, 关于adcy2a和tekt4基因在鱼类中的研究还比较有限, 在黄鳝性腺中均无特异性表达差异, 因此miR-9与adcy2a和tekt4基因调控关系以及对鱼类性腺发育的影响需要进一步研究。我们前期研究发现miR-9在黄鳝性腺发育过程中表达量逐渐降低, 在卵睾体中具有最高的表达量, 而后在精巢中表达量降低[16]; 而miR-9在猪精巢成熟过程中的表达量呈现升高的趋势[53]。黄鳝卵睾体阶段处于性腺由卵巢到精巢的转换期,该阶段过程中卵巢逐渐退化, 同时精巢形成, 精子产生。根据miR-9在黄鳝和哺乳动物性腺中的表达规律, miR-9可能对精巢的发育和精子生成具有重要的调控作用。综上, 我们推测miR-9可能通过松弛素信号通路调控精子功能的相关蛋白, 进而影响黄鳝精巢的发育过程。
