饲料中添加苜蓿草粉对草鱼生长、肌肉品质和血清抗氧化指标的影响
2022-05-27童方乐魏泽宏刘少军
童方乐 唐 涛 魏泽宏 胡 毅 刘少军
(1. 湖南师范大学生命科学学院, 省部共建淡水鱼类发育生物学国家重点实验室, 长沙 410081;2. 湖南农业大学动物科技学院, 长沙 410125)
苜蓿(Medicago sativaL.)是一种多年生豆科植物, 具有产草量高、适应性广、营养丰富等特点。其资源丰富, 素有“牧草之王”之称, 我国每年苜蓿总产量8×109kg[1,2]。苜蓿粗蛋白含量较高, 为12.3%—26.1%, 符合饲料蛋白质要求[3]。苜蓿草粉包含20多种氨基酸, 其氨基酸组成均衡, 包括人和动物全部必需氨基酸及稀有氨基酸, 如瓜氨酸和刀豆氨酸等[4]。苜蓿草粉还含有各种维生素, 如叶酸、维生素K和维生素E等[3], 可满足动物生长的营养需求。此外, 苜蓿中含有的类胡萝卜素、皂苷、黄酮类和苜蓿素等生物活性成分具有抗氧化作用[1,5]。Yin等[6]研究了发酵苜蓿草粉替代豆粕对鹅血清抗氧化酶活力的影响, 发现鹅血清抗氧化酶活性随苜蓿草粉添加量的提高而升高。在资源紧缺的当下,苜蓿作为一种营养丰富、产量富足的植物资源, 可考虑作为水产动物饲料原料使用。然而目前关于苜蓿在鱼类饲料中使用的报道并不多, 且多集中在苜蓿对鱼类生长性能的影响这一方面, 如马晶晶等[7]研究了紫花苜蓿浓缩叶蛋白替代鱼粉对星斑川鲽幼鱼(Platichthys stellatus, Pallas, 1788)生长的影响,发现紫花苜蓿浓缩叶蛋白替代鱼粉的比例为19.0%时, 星斑川鲽幼鱼获得最佳生长。宋坚等[8]研究了苜蓿草粉对刺参幼参(Apostichopus japonicus)生长的影响, 结果表明当苜蓿草粉的添加比例为10%时,刺参有最高的特定生长率和最低的饵料系数。关于苜蓿对鱼类肌肉品质的研究较少。鱼类肌肉品质评价内容主要包括营养成分、感官特征和质构特性等方面[9]。胡喜峰等[10]研究了不同水平苜蓿草粉对团头鲂(Megalobrama amblycephala)生长性能及肉品质的影响, 主要集中在形体指标和肌肉营养成分方面, 没有对肌肉的质构特性等进行报道。
草鱼(Ctenopharyngodon idella)是我国淡水养殖规模最大和养殖区域最广的鱼类品种[11], 由于生长速度快, 肉味鲜美, 受到广大消费者的喜爱, 其饲料在全球水产饲料使用量中占据着较高的地位[12]。作为一种典型的草食性鱼类, 草鱼在自然生长过程中会以水草和一些植物性饵料为食, 因此在草鱼饲料中添加苜蓿具有较大的研究价值。随着社会生活水平的提高及水产业的发展, 人们对水产食品的安全性以及鱼肉品质的关注度越来越高。因此, 本试验选取草食性鱼类草鱼作为研究对象, 在研究苜蓿对其生长和血清抗氧化指标影响的同时, 检测其肌肉品质变化, 为苜蓿在草鱼饲料中的应用提供理论基础。
1 材料与方法
1.1 饲料配方
本试验以豆粕、鱼粉和菜粕为主要蛋白源, 以豆油为主要脂肪源, 在基础饲料(对照组)中分别添加5%、10%、15%和20%的苜蓿粉, 配制成5种等氮等脂的饲料。试验所用苜蓿来自中国农业大学涿州实验站(中国河北)。饲料配方如表 1所示。各原料粉碎后过40目筛, 逐级混合后, 与大豆油混合,加水, 经实验室挤压机制成直径2 mm的沉性颗粒饲料。所有的饲料置于60℃环境下烘干5 h后, 于塑料袋中密封保存, 并放置在-20℃冰箱中保存直至使用。
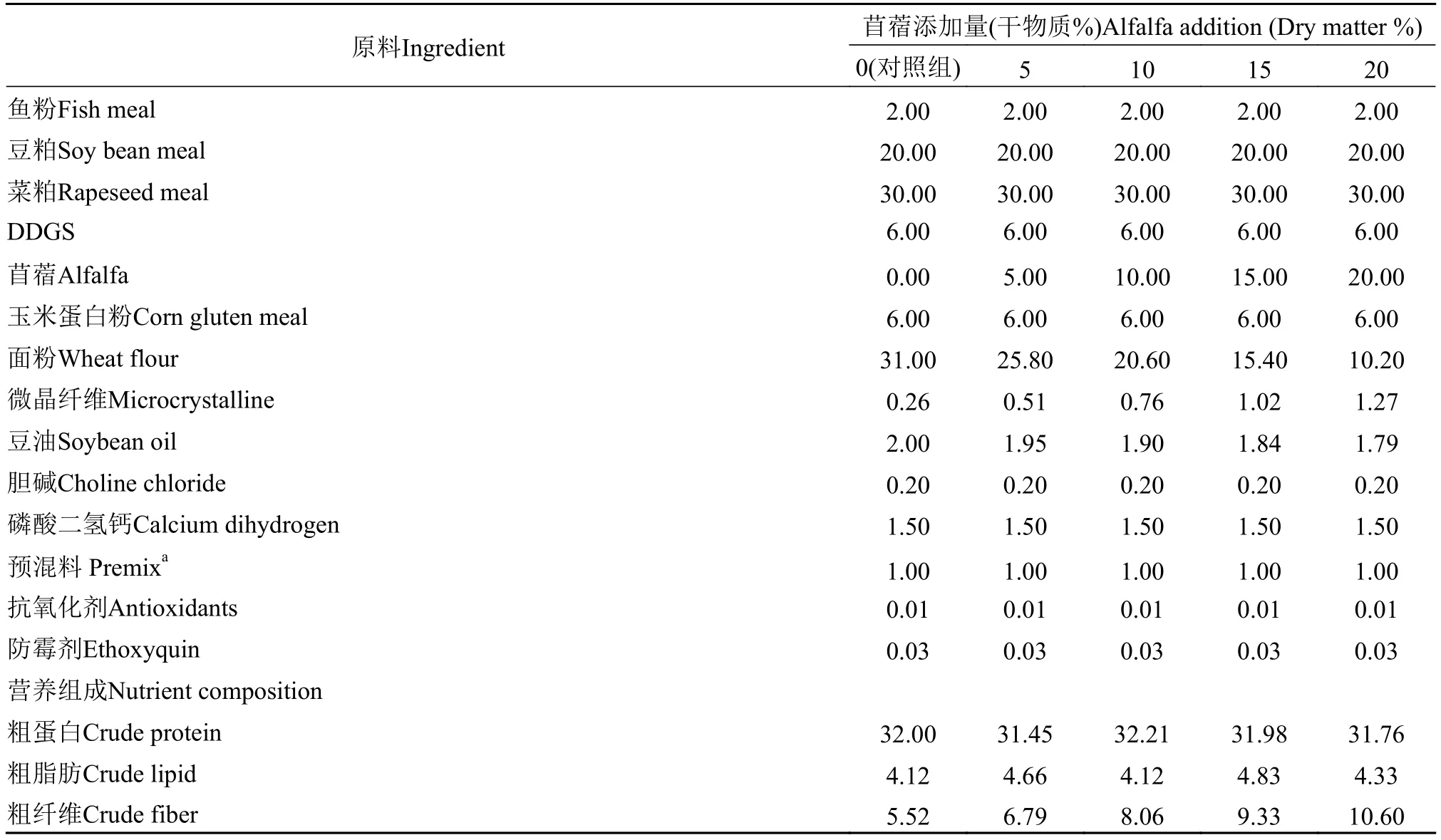
表1 饲料配方与基本营养成分分析Tab. 1 Formulation and proximate analysis of experimental diets
1.2 饲养管理
试验在湖南省车田江水库(湖南省娄底市)进行。从湖南省岳阳市湘阴县引进草鱼, 使用对照组饲料驯化1周后, 禁食24 h, 将初始体重(50.04±0.04) g的600尾草鱼按照每个网箱40尾, 随机分为15个网箱(1.5 m×1.5 m×2.0 m), 每个处理3个网箱。每天投喂3次(8: 00、12: 30和16: 00), 饱食投喂, 投喂周期为61d。试验期间水质指标数据为: 水温(26.0±3.3)℃、pH 7.3±0.5、溶解氧 (7.0±0.5) mg/L。
1.3 样品采集
在试验结束后, 草鱼禁食24h, 用MS-222(间氨基苯甲酸乙酯甲磺酸盐, Sigma, St. Louis, MO,USA)对草鱼进行麻醉后计数并称重。每个网箱随机取3尾鱼, 在测定体质量后, 用1 mL注射器从尾静脉取血, 4℃过夜后用离心机(4℃, 3500 r/min)离心15 min, 收集上层血清, 用于测定血清生化指标; 取血后的草鱼于冰盘上解剖, 取出内脏, 准确称量肝胰脏和内脏团的重量。采集一侧背鳍下方侧线上方肌肉1 cm×0.5 cm×0.5 cm放置在冰上进行肌肉质地分析。采集另一侧肌肉放入液氮罐中速冻后, 带回实验室储存在-80℃的冰箱中用于肌肉营养成分分析和肌肉酶活分析。
1.4 测定指标及方法
生长指标测定根据测定的数据计算试验鱼的特定生长率(Specific growth rate,SGR)、饲料系数(Feed conversion ratio,FCR)、摄食率(Feeding rate,FR)、肝体比(Hepatosomatic index,HSI) 、脏体比(Viscerosomatic index,VSI)、肥满度(Condition factor,CF), 根据统计的试验鱼存活情况计算成活率(Survival rate,SR), 计算公式如下:
特定生长率(SGR, %/d)=100%×[ln(实验鱼终末均重)-ln(实验鱼初始均重)]/天数
饲料系数(FCR)=总投饲量/实验鱼总增重量
摄食率(FR, %)=100%×总投饲量/(实验鱼初始总重+实验鱼终末总重)/2/投喂天数
肝体比(HSI)=100×(肝脏重/鱼体质量)
脏体比(VSI)=100×(内脏重/鱼体质量)
肥满度(CF, g/cm3)=100×鱼体质量/体长3
成活率(SR, %)=100%×(实验末鱼数量/实验初鱼数量)
肌肉和饲料基本营养成分分析按标准方法(AOAC, 2005)分析肌肉和饲料的营养成分。将肌肉样品放置在105℃电热恒温干燥箱(DHG-9240A, 上海齐欣)中烘干至恒重以测定水分。粗蛋白含量通过凯氏定氮法(Kjeltec 2300, FOSS,Sweden)测定。脂肪测定采用索氏抽提法(Soxtec 2050, FOSS, Sweden)。采用过滤法(国标GB/T 6434-2006)测定饲料中粗纤维含量。
肌肉持水力和pH测定采用重量法[13]测失水率(Water loss rate)和失脂率(Lipid loss rate)。取1 g左右的去皮肌肉称重(S), 用滤纸包裹(V1), 放入离心管中, 室温下4000×g离心10min。将离心后的湿滤纸称重(V2), 在烘箱中烘干至恒重(V3)。计算公式为: 失水率(%)=100%×(V2-V3)/S, 失脂率(%)=100%×(V3-V1)/S。
肌肉pH由pH计(Testo-205, testo AG, 德国)在室温下根据已报道的研究[14]描述方法进行测定。
肌肉TBARS测定将已报道的研究方法[15]稍做修改后测定肌肉硫代巴比妥酸值(Thiobarbituric acid value)。将肌肉样品(10 g)混合于20 mL三氯乙酸溶液[1∶5(W/V) ]中。在3500×g、4℃离心15min后, 取上清液。将5 mL上清液与5 mL 2-硫代巴比妥酸(TBA)溶液混合。同时以5 mL三氯乙酸和5 mL TBA混合液为空白溶液。样品溶液和空白溶液均在沸水浴中加热15min, 用自来水冷却后, 在530 nm处测定样品溶液(As)和空白溶液(Ab)的吸光度。TBA值(mg/100 g)为:TBA=50×(As-Ab)/200。
肌肉质地测定在已报道的研究基础上[16]适当修改后进行肌肉质地测定, 使用TMS-PRO TPA装置(Food Technology Corporation, USA), 该装置配备有平底圆柱形探头(直径: 8 cm)和250 N的称重传感器。对肌肉样品进行质地剖面分析(TPA)测量, 压缩比为60%的双重压缩试验。在试验过程中探头的运动速度为1 mm/s, 两次压缩间隔时间为2s。通过TPA模式检测肌肉硬度、黏附性、内聚性、弹性、胶黏性和咀嚼性等质地特征。
血清和肌肉酶活测定使用南京建成生物工程研究所生产的试剂盒检测血清过氧化氢酶(CAT; A007-1-1)、超氧化物歧化酶(SOD; A001-3-2)、谷胱甘肽过氧化物酶(GSH-PX; A005-1-2)和丙二醛(MDA; A003-1-2)含量。
使用南京建成生物工程研究所生产的试剂盒检测肌肉乳酸(A019-2-1)、羟脯氨酸(A030-2-1)、肌钙蛋白T(H149-3)和糖原含量(A043-1-1)含量。称取1 g左右肌肉样品, 将其放入15 mL离心管中,在离心管中按质量体积比1∶9加入已经预冷的生理盐水进行匀浆。在4℃ 3000×g下离心10min后取上清, 按试剂盒操作手册进行检测。
1.5 数据处理与分析
采用SPSS 18.0软件进行统计分析。所有数据均以均数±标准误表示, 并用单因素方差分析和Tukey’s检验不同投饲处理之间的差异。P<0.05作为判断差异显著性标准。
2 结果
2.1 饲料中添加苜蓿草粉对草鱼生长的影响
如表 2所示, 在饲料中添加苜蓿草粉后, 对草鱼的存活率没有显著性影响(P>0.05)。与对照组相比, 15%苜蓿组的摄食率和饲料系数显著高于对照组(P<0.05), 当饲料中苜蓿草粉添加量达到20%时,草鱼的特定生长率显著降低(P<0.05)。
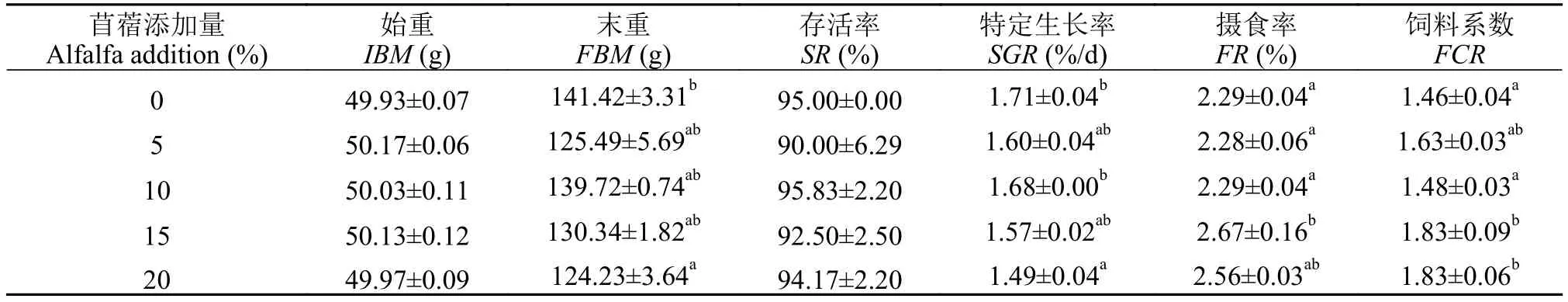
表2 饲料中添加苜蓿草粉对草鱼生长的影响Tab. 2 The effect of dietary alfalfa on the growth performance of grass carp
2.2 饲料中添加苜蓿草粉对草鱼形体指标的影响
如表 3所示, 苜蓿对草鱼的肝体比没有显著性影响(P>0.05)。除10%苜蓿组外, 添加不同含量苜蓿草粉显著降低了草鱼脏体比(P<0.05)。草鱼肥满度随着苜蓿草粉添加水平升高而降低, 当添加量超过5%时, 出现显著差异(P<0.05)。

表3 饲料中添加苜蓿草粉对草鱼形体指标的影响Tab. 3 The effect of dietary alfalfa on body index of grass carp
2.3 饲料中添加苜蓿草粉对草鱼肌肉常规养分组成的影响
如表 4所示, 在饲料中添加苜蓿草粉对草鱼肌肉水分、粗蛋白、粗脂肪均无显著影响(P>0.05)。
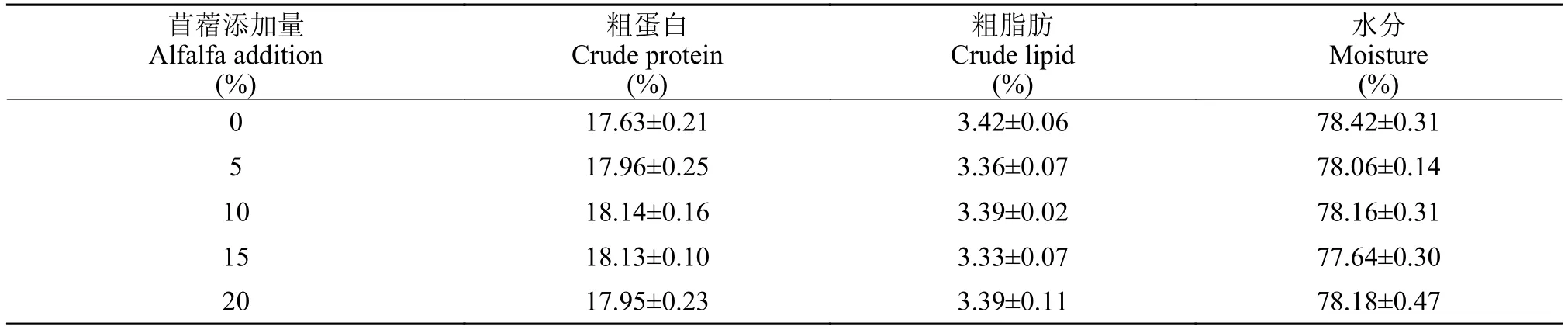
表4 饲料中添加苜蓿草粉对草鱼肌肉常规养分组成的影响(%湿重)Tab. 4 The effect of dietary alfalfa on muscle nutrient composition of grass carp (% wet weight)
2.4 饲料中添加苜蓿草粉对草鱼肌肉质构特性的影响
由表 5所示, 在饲料中添加苜蓿草粉对草鱼肌肉内聚性、弹性、胶黏性和咀嚼性无显著影响(P>0.05), 对草鱼肌肉硬度和黏附性有显著影响(P<0.05)。10%苜蓿组草鱼肌肉硬度显著高于对照组(P<0.05), 其余苜蓿添加组与对照组相比无显著性差异(P>0.05)。除20%苜蓿组外, 其余苜蓿添加组肌肉黏附性显著高于对照组(P<0.05), 20%苜蓿组肌肉黏附性与对照组相比无显著性差异(P>0.05)。
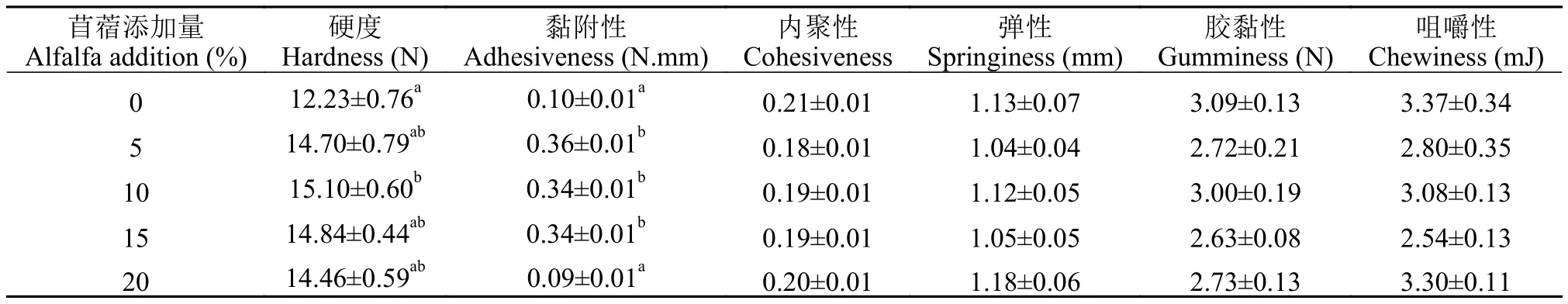
表5 饲料中添加苜蓿草粉对草鱼肌肉质构特性的影响Tab. 5 The effect of dietary alfalfa on muscle texture properties of grass carp
2.5 饲料中添加苜蓿草粉对草鱼持水力和pH的影响
如表 6所示, 苜蓿对草鱼的失脂率和pH均无显著性影响(P>0.05)。在饲料中添加苜蓿草粉后显著增加了草鱼肌肉的失水率(P<0.05)。

表6 饲料中添加苜蓿草粉对草鱼肌肉持水力和pH的影响Tab. 6 The effects of dietary alfalfa on water holding capacity and pH of grass carp muscle
2.6 饲料中添加苜蓿草粉对草鱼肌肉硫代巴比妥酸值的影响
如表 7所示, 随着苜蓿草粉添加量的提高, 草鱼肌肉硫代巴比妥酸值呈显著下降趋势(P<0.05)。
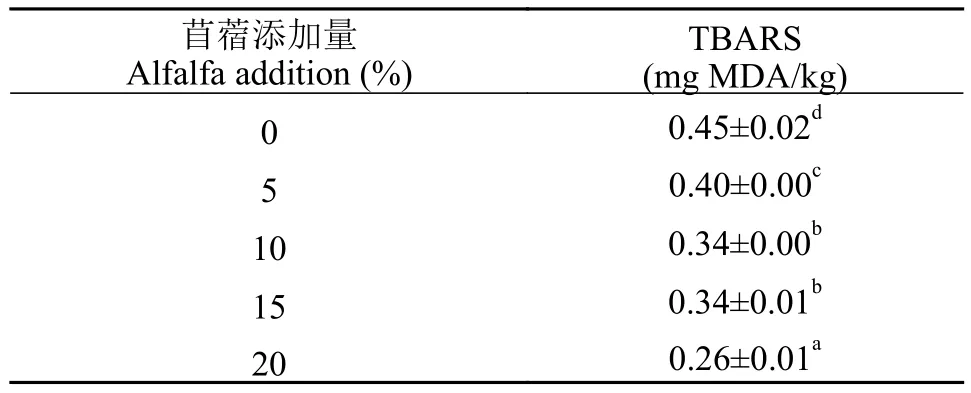
表7 饲料中添加苜蓿草粉对草鱼肌肉TBARS含量的影响Tab. 7 The effect of dietary alfalfa on TBARS contents in muscle of grass carp
2.7 饲料中添加苜蓿草粉对草鱼肌肉酶活的影响
如表 8所示, 在饲料中添加苜蓿草粉后, 肌肉羟脯氨酸值有所上升, 10%和15%苜蓿组肌肉羟脯氨酸含量显著高于对照组(P<0.05), 其余苜蓿添加组与对照组相比无显著性差异(P>0.05)。在饲料中添加苜蓿草粉对肌肉糖原、肌钙蛋白T含量无显著性影响(P>0.05), 然而, 对肌肉乳酸含量有显著性影响, 在饲料中添加苜蓿草粉后, 显著降低了肌肉乳酸含量(P<0.05)。
2.8 饲料中添加苜蓿草粉对草鱼血清抗氧化的影响
如表 9所示, 20%苜蓿组血清CAT活力显著高于对照组(P<0.05), 其余苜蓿添加组的血清CAT与对照组相比没有显著性差异(P>0.05)。15%和
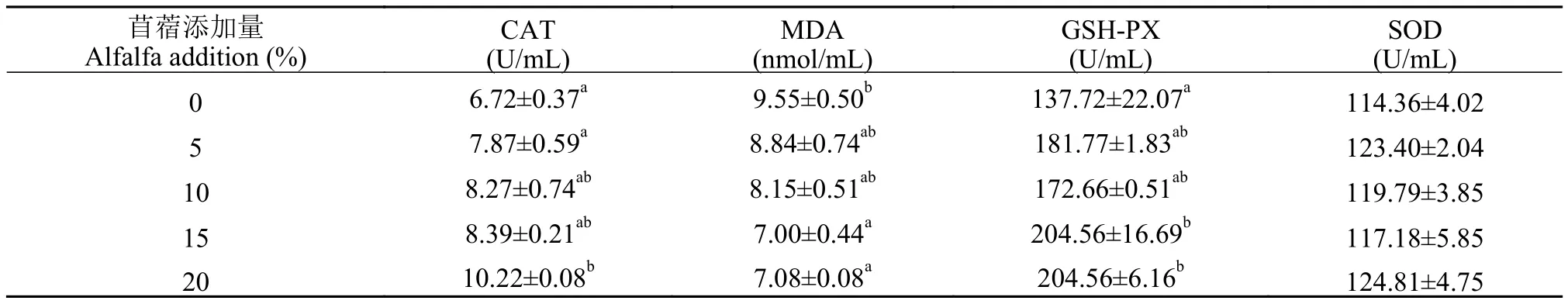
表9 饲料中添加苜蓿草粉对草鱼血清抗氧化的影响Tab. 9 The effect of dietary alfalfa on serum antioxidation of grass carp
20%苜蓿组血清MDA含量显著低于对照组(P<0.05),5%和10%苜蓿组血清MDA含量与对照组相比无显著性差异(P>0.05)。15%和20%苜蓿组血清GSHPX活力显著高于对照组(P<0.05)。血清SOD活力在各组之间没有显著性差异(P>0.05)。
3 讨论
3.1 苜蓿草粉对草鱼生长性能的影响
苜蓿粗蛋白含量较高, 维生素种类丰富, 矿物质含量高, 含有多种未知的生长因子及特殊的免疫活性蛋白——叶蛋白、皂苷、黄酮、多糖和膳食纤维等特殊营养功能成分[3]。紫花苜蓿适口性好,研究表明, 草鱼离体内脏酶酶解紫花苜蓿的消化率为37.42%, 与胰蛋白酶对紫花苜蓿的消化结果相近, 并且研究发现在相同加酶量的情况下, 紫花苜蓿的消化率指数位于豆粕和玉米蛋白饲料之间, 说明紫花苜蓿具有良好的可消化性, 可用作水产饲料原料[17]。近年来, 关于苜蓿用于水产动物饲料的研究不多, 且试验结果也不完全一致。Ali等[18]以尼罗罗非鱼[Oreochromis niloticus, (12.38±0.39) g]为研究对象, 发现饲料中添加5%以上的苜蓿草粉后降低了鱼体的生长性能。何云等[19]的研究表明, 在对照组饲料中添加5%和10%的苜蓿草粉后, 黄河鲤[Cyprinus carpio haematopterusTemminck et Schlegel, (248.70±1.31) g]的特定生长率和饵料系数均有所改善。张春梅等[20]以团头鲂(59.90 ±0.84) g为研究对象, 发现饲粮中添加16%紫花苜蓿草粉后可显著改善其生长性能。在本试验中, 添加15%苜蓿草粉后, 草鱼饲料系数和摄食率显著升高, 在添加20%苜蓿草粉后, 草鱼特定生长率显著降低。出现这一现象的原因可能有以下几个方面。其一, 苜蓿的粗纤维含量较高。研究表明, 紫花苜蓿的粗纤维含量高达33.62%[17], 适量的纤维素在一定程度上能够刺激消化道的蠕动和消化酶的分泌, 有利于食物的消化。然而, 当纤维素含量过高时将会导致肠道蠕动速度过快, 食物在还没有被消化完全的情况下被排出体外, 食物消化率降低[21]。此外, 研究发现,草鱼虽然是草食性鱼类, 但缺乏与纤维素酶合成相关的基因[22]。高春生等[23]发现在草鱼饲料中添加纤维素酶后可促进草鱼生长, 降低饲料系数。本试验添加较高水平的苜蓿草粉后草鱼生长性能下降可能与苜蓿中含有较高的纤维素有关。其二, 苜蓿中含有抗营养因子, 如蛋白酶抑制剂、皂苷、单宁、抗维生素和植物雌激素等[24]。鱼类摄取含蛋白酶抑制剂的饲料后可能降低鱼类对饲料中蛋白质和氨基酸等营养物质的消化率, 使其日增重下降,饲料转化率降低[25]。Krogdahl等[26]在虹鳟(Oncorhynchus mykiss)基础饲料中添加不同水平的大豆蛋白酶抑制剂, 结果表明高剂量的大豆蛋白酶抑制剂显著降低了虹鳟的肠道蛋白酶活性和蛋白质消化率。高剂量的皂苷对动物生长有抑制作用,Couto等[27]在金头鲷(Sparus aurata)饲料中添加12 g/kg的大豆皂苷, 结果表明, 大豆皂苷在一定程度上抑制了金头鲷的生长。单宁的抗营养性表现在其易与蛋白质等结合[28], 进而影响饲料中蛋白质等的消化吸收。Hay等[29]在小羚羊基础饲料中添加单宁酸, 发现单宁酸组饲料蛋白质、粗纤维的消化率和能量利用率均比基础饲料组低7%以上。
在饲料中添加苜蓿草粉后, 草鱼的脏体比和肥满度有所下降, 这与马晶晶等[7]对星斑川鲽幼鱼(Platichthys stellatus, Pallas, 1788)的研究结果一致,其研究表明, 紫花苜蓿浓缩叶蛋白替代鱼粉的比例越高, 其肥满度下降越明显。
3.2 苜蓿草粉对草鱼肌肉品质的影响
肌肉的质构特性是评价肌肉品质的重要指标之一。TPA主要通过模拟人体口腔的咀嚼运动, 获得一系列参数, 以此来表示硬度、黏性、弹性、黏聚性、胶着性和咀嚼性等。本研究表明, 当饲料中苜蓿草粉添加量为10%时, 显著提高了草鱼肌肉硬度, 当苜蓿草粉添加量为5%—15%时, 显著提高了草鱼肌肉黏附性。研究表明, 肌肉的硬度等越大,肌肉的感官脆度也越大, 具有更好的口感[30]。本试验中草鱼肌肉硬度增大可能与肌肉中胶原蛋白含量增大有关。胶原蛋白含量对肌肉质地有显著影响, 胶原蛋白含量越高, 硬度越高[6]。羟脯氨酸是胶原蛋白的特征性氨基酸, 通常将羟脯氨酸含量乘以8来评估胶原蛋白的含量[31]。在本试验中, 10%和15%苜蓿组的肌肉羟脯氨酸含量显著高于对照组,这可能是导致肌肉硬度、黏附性增大的原因之一。此外, 有研究表明, 鱼体肌肉胶原蛋白含量越高则肌肉越坚实, 机械强度越高[32]。
在鱼体死亡后, 糖原通过糖酵解途径生成乳酸和ATP, 同时产生H+, 鱼体pH降低, 导致鱼肉蛋白质变性, 从而影响鱼肉的品质[33]。本研究添加苜蓿草粉后草鱼乳酸含量显著性下降, 说明饲料中添加苜蓿后肌肉糖酵解过程减弱。这可能是因为苜蓿能够抑制糖酵解过程相关酶的活性, 减弱糖酵解途径, 进而延缓肌肉蛋白质变性。
持水力是评估鱼肉品质的重要参数之一, 持水力的高低通常用失水率、汁液流失率等指标来评价[34]。在本研究中, 饲料中添加苜蓿草粉后, 草鱼肌肉失水率显著上升, 说明苜蓿能够影响草鱼肌肉的持水力, 使其持水力下降。研究表明, 持水力高的肌肉较鲜嫩; 持水力低, 肌肉中的水分蒸发, 营养物质被带走, 肌肉就会表现为干硬, 肉质也有所下降[35]。研究表明[36]肌细胞外空隙、胞外总空隙 (包括肌束间空隙) 和液体流失有较好的相关性。Lawson等[37]报道钙激活酶(Calpain)与流失通道的形成有一定的关系, 本研究添加苜蓿草粉后肌肉持水力下降可能与苜蓿草粉增加了钙激活酶活性有关, 导致肌肉细胞间隙增大, 持水力下降, 但有待进一步研究。关于苜蓿对肌肉品质的影响, 在水产行业研究得较少, 在其他畜禽行业可见一些研究, 赵静等[38]在猪饲料中分别添加5%、10%、15%和20%水平的苜蓿草粉, 结果表明各添加水平的苜蓿草粉均未对猪肉的pH和持水力产生显著影响。陈文雪等[39]在羊的基础饲料中分别用0、10%、20%、30%和40%的苜蓿草粉等量替代花生秧, 结果显示, 各试验组的pH与对照组接近, 但肌肉滴水损失下降, 嫩度提高。本试验的试验结果与其他试验相比, 在pH方面的影响是一致的, 在肌肉持水力方面的影响不一致, 可能与试验品种和试验品种对苜蓿的消化有关。
硫代巴比妥酸值由脂肪的二级氧化产物丙二醛的量反映, 硫代巴比妥酸值越高, 说明脂肪氧化程度越高, 肌肉品质下降越严重[40]。草鱼肌肉硫代巴比妥酸值随饲料中苜蓿草粉添加量的增高呈显著下降趋势, 说明苜蓿能够减缓脂质氧化速度, 进而延长肌肉储存时间。这可能与苜蓿中含有苜蓿多糖、黄酮、维生素C和维生素E等抗氧化剂有关。研究证明, 多糖类和黄酮类能够在一定程度上抑制肉糜制品中脂肪氧化, 使其硫代巴比妥酸值降低, 具有改善肉糜品质的作用[41]。廖婵等[42]为研究维生素E对脂质抗氧化的作用, 将维生素E喷淋于干腌火腿切块表面, 结果表明, 4个月后, 火腿的硫代巴比妥酸值下降了36%。张健凯等[43]的研究表明,维生素C能够使猪肉腌制过程中的硫代巴比妥酸值降低。
3.3 苜蓿草粉对血清抗氧化的影响
CAT、SOD和GSH-PX都是机体重要的抗氧化酶类, SOD在生物体内广泛存在, 它能够平衡体内的氧自由基[44], 并生成H2O2; CAT主要存在于微粒中, 它能够将SOD与超氧阴离子反应生成的H2O2分解为H2O和O2, 防止机体过氧化[45]; GSH-PX的主要作用是清除脂类氢过氧化物, 防止机体发生氧化损伤[46]; MDA是多不饱和脂肪酸过氧化的主要分解产物, 其含量多少可以间接反映出脂质过氧化程度[47]。在本试验中, 苜蓿草粉的添加提高了血清GSHPX和SOD的活力, 降低了血清MDA含量, 这与王成章等[48]的研究一致, 其研究表明苜蓿草粉的添加使黄河鲤血清SOD和GSH-PX活力提高, MDA含量下降。本试验添加苜蓿草粉后, 草鱼血清过氧化能力提高可能与苜蓿草粉中含有类胡萝卜素、黄酮、皂苷及多种维生素(如维生素C、维生素E等)有关[1]。类胡萝卜素通过清除氧自由基, 保护细胞免受氧化损伤[49]。研究表明, 苜蓿叶总黄酮在一定的质量浓度范围内具有较强的抗氧化活性, 并且其抗氧化活性随其质量浓度的增加而增加[50]。苜蓿皂苷通过减少自由基合成的原料, 增加分解自由基的酶类物质进而提高机体的抗氧化能力[51]。维生素C的抗氧化作用依靠可逆的脱氢反应来完成, 其可以与HOO-及OH-反应生成半脱氢抗坏血酸[52]。维生素E通过向脂氧自由基或脂过氧自由基提供氢离子,使脂质过氧化链式反应中断[53]。此外, 研究证明,膳食纤维也具有抗氧化作用, 膳食纤维可能是通过减少体内脂肪储存, 进而减少脂质过氧化反应[54]。
4 结论
综上所述, 当饲料中苜蓿草粉的添加量不超过15%时, 对草鱼生长性能没有显著性影响, 且能提高草鱼肌肉品质和血清抗氧化能力。因此, 草鱼饲料中苜蓿草粉的适宜添加量不应超过15%。
