低氧-复氧胁迫对鲢抗氧化酶活性及Cu/Zn-SOD和Mn-SOD基因表达的影响
2022-05-27张美东罗相忠邹桂伟梁宏伟
张美东 凌 晨 沙 航 陈 梦 王 丹 罗相忠 邹桂伟 梁宏伟
(1. 中国水产科学研究院长江水产研究所, 武汉 430223; 2. 华中农业大学水产学院, 武汉 430000)
水体溶解氧是鱼类正常生活所必需的重要因子之一, 直接影响着鱼类的生长、发育和繁殖[1], 其主要受到天气变化、水体富营养化和水体污染等因素的影响。近年来, 由于水环境的污染, 水中低氧的严重程度、发生频率和持续时间不断增加, 对鱼类的生存造成巨大的影响[2], 使其无法维持正常的能量代谢平衡、免疫力下降和代谢紊乱等, 甚至导致其个体死亡[3]。
在通常情况下, 细胞中活性氧自由基(Reactive oxidative species, ROS)的形成和清除是平衡的, 细胞需要生成少量的ROS用于调节细胞活动和基因表达。但当鱼类遭受低氧胁迫时, 体内会产生氧化应激反应, 生成大量的ROS[4,5], 而大量活性氧自由基会打破抗氧化防御系统的平衡[6], 引起细胞和组织的生理和病理反应, 使细胞的功能丧失、凋亡或坏死[7]。因而, 为了减少大量活性氧自由基造成的破坏, 鱼类机体内启动超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(Catalases, CAT)和谷胱甘肽过氧化物酶(Glutathione peroxidase, GSHPX)等组成的抗氧化酶防御系统, 从而清除超氧化阴离子自由基和过氧化氢来维持体内动态平衡[8]。超氧化物歧化酶作为清除活性氧自由基的抗氧化酶[9], 是生物体抗氧化防御的第一道屏障。过氧化氢酶是一种结合酶, 与SOD共同组成一套活性氧清除酶系统[10]。谷胱甘肽过氧化物酶则是生物体内抗氧化防御体系中一种重要的抗氧化剂[11]。在西伯利亚鲟(Acipenser baerii)[12]、大口黑鲈(Micropterus salmoides)[13]、青田鲤(Cyprinus carpio varqingtianensis)[14]及黄颡鱼(Pelteobagrus fulvidraco)[15]等鱼类的低氧胁迫中均发现抗氧化酶能起到积极的响应。
鲢在我国分布广泛, 是我国重要的淡水养殖“四大家鱼”之一[16]。由于鲢生性活泼, 在遭到应激刺激时易跃出水面, 且耐低氧能力差, 在养殖过程中易出现因缺氧而引发的浮头、泛塘甚至大规模死亡等现象, 给养殖户带来巨大经济损失。目前,关于鱼类低氧胁迫及复氧的研究, 大多数集中在抗氧化酶活性的变化[12—15]或相关基因的克隆和表达[17]。本研究旨在探究低氧胁迫及复氧后鲢血清、心脏和肝脏中抗氧化酶活性的变化, 及SODs mRNA动态表达特征, 以期为鲢在低氧胁迫下氧化应激的响应机制的研究提供基础。
1 材料与方法
1.1 实验用鱼
实验鲢来自中国水产科学研究院长江水产研究所窑湾试验场。实验前选取体重(100±10) g的鲢暂养在10 m3的养殖桶中, 7d后用于正式实验。
1.2 实验方法
急性低氧、持续低氧及复氧实验随机从实验鱼中选取健康且活泼的个体用于实验。在水温(27.0±0.5)℃下, 向水中充入空气和氮气来维持水中溶解氧的浓度, 同时用水质分析仪(HQ30D, Hach)测定水中溶解氧的浓度。急性低氧实验时向水中充入氮气和空气, 使水中溶氧分别降至2.5 mg/L(Acute Hypoxia-2.5, AH-2.5)、1.5 mg/L(AH-1.5)、0.5 mg/L(AH-0.5)和0.25 mg/L(AH-0.25)时, 将鱼放入水中低氧胁迫0.5h。持续低氧实验是在水体中充入氮气和空气使其水中溶氧维持在2.5 mg/L时, 将鱼放入水中分别持续低氧胁迫3h(Continuous Hypoxia-3, CH-3)、6h(CH-6)、12h(CH-12)和24h(CH-24)。复氧实验则是在溶解氧为2.5 mg/L下持续低氧24h后, 将正常游动的鱼转至(6.5±0.3) mg/L的常氧中, 分别复氧处理3h(Reoxygenation-3, R-3)、6h(R-6)、12h(R-12)和24h(R-24)。在低氧胁迫前,随机取5条作为常氧对照组(CK)。
样品采集与处理样品采集前用150 mg/L的MS-222麻醉实验鱼以降低应激反应。在急性低氧、持续低氧、复氧和常氧对照组中, 随机取5尾用一次性灭菌注射器在尾椎静脉采血, 血液放入冰箱4℃静置2h后, 3500 r/min离心10min, 吸取上清液制备血清, 所得血清为无色或是淡黄色, 将血清放于-20℃冰箱保存备用。采血后迅速解剖鱼体, 取出肝脏和心脏组织置于干净无菌的冻存管中, 液氮速冻后置于-80℃冰箱保存备用。
酶活力测定按照试剂盒(南京建成生物工程有限公司)使用说明进行血清、肝脏和心脏组织中抗氧化指标, 主要包括总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)和过氧化氢酶(CAT)的测定。
总RNA提取及cDNA合成鲢心脏及肝脏组织根据Trizol试剂说明书提取总RNA, 用超微量分光光度计(NP80, IMPLEN)检测提取的RNA浓度并用1.5%琼脂糖凝胶电泳检测RNA的完整性。使用HiScript®Ⅲ 1stStrand cDNA Synthesis Kit(+gDNA wiper)合成cDNA, -20℃保存。
荧光定量PCR对鲢心脏及肝脏进行Cu/Zn-SOD和Mn-SOD的动态表达特征分析引物采用本实验室已发表引物[17]。其中Cu/Zn-SOD基因上游引物为5′-CCAACCGATAGTGAAAGACACGT-3′, 下游引物为5′-CTCATTGCCTCCCTTCCCCAAGT-3′;Mn-SOD基因上游引物为5′-TGTGACGACCCA AGTCTCCCTT-3′, 下游引物为5′-CTGTGGCTCTCC TCCACCATTC-3′; 内参基因β-actin上游引物为5′-GAACCCCAAAGCCAACAG-3′, 下游引物为5′-CAGAGTCCATCACGATACCAG-3′。利用ABI 7500荧光定量PCR仪进行检测, 每个样品重复3次。PCR反应体系为20 μL: 2×ChamQ Universal SYBR qPCR Master Mix 10 μL, 上下游引物各0.4 μL,Template cDNA 1 μL, ddH2O 8.2 μL。扩增程序为:95℃预变性30s; 95℃变性10s, 60℃退火30s, 共40个循环, 95℃15s, 60℃退火60s, 95℃15s。数据采用2-ΔΔCt方法进行分析。
1.3 数据分析
使用SPSS Statistics V24.0对数据进行单因子方差分析及Duncan’s多重比较,P<0.05为差异显著。
2 结果
2.1 鲢血清中抗氧化酶活性
在急性低氧胁迫后, 鲢血清中T-AOC和GSHPX酶活性在溶解氧浓度0.25 mg/L时升高, 较常氧水平分别升高了35%和6%, 而SOD的活性在氧浓度0.25 mg/L时较常氧水平降低了9%(P>0.05), CAT的活性随着溶解氧的降低持续升高, 在氧浓度2.5 mg/L时显著升高(P<0.05), 高于常氧水平20%(图 1)。在持续低氧胁迫后, 鲢血清中T-AOC、CAT和GSHPX的活性在持续低氧胁迫12h时达到最高(P<0.05),较常氧水平分别升高了62%、58%和25%, 而SOD的活性在低氧胁迫3h时达到最高(P>0.05)。在低氧胁迫24h时, T-AOC、CAT和GSH-PX的活性仍高于常氧水平, 但SOD的活性低于常氧水平15%(P>0.05)。在复氧后, 鲢血清中CAT和GSH-PX的活性在复氧3h时显著高于常氧水平(P<0.05), 复氧24h时,SOD、CAT和GSH-PX的活性与常氧水平无显著差异(P>0.05)。而T-AOC酶活性随复氧时间的增加持续下降(P<0.05), 在复氧6h时恢复至常氧水平(P>0.05; 图 2)。
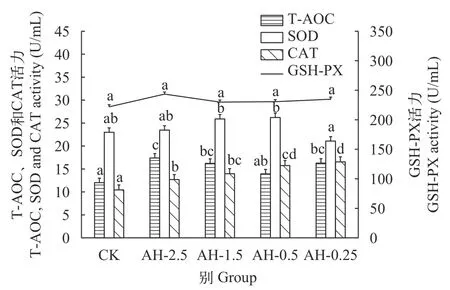
图1 急性低氧胁迫对鲢血清中抗氧化酶活性的影响Fig. 1 Effects of acute hypoxic stress on antioxidant enzyme activity in serum of H. molitrix
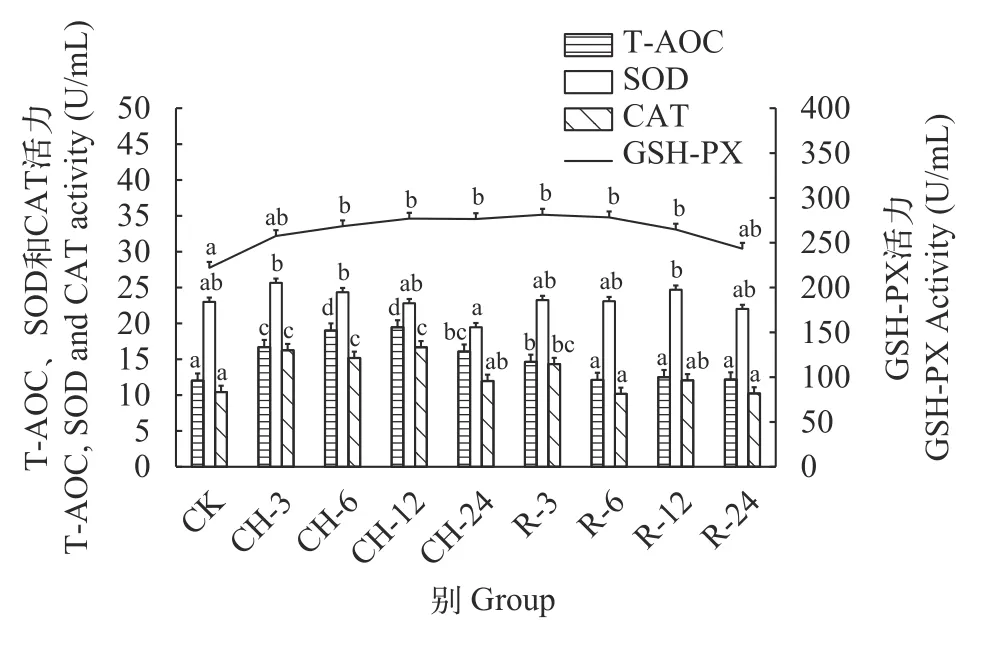
图2 持续低氧胁迫及复氧对鲢血清中抗氧化酶活性的影响Fig. 2 Effects of continuous hypoxic stress and reoxygenation on antioxidant enzyme activity in serum of H. molitrix
2.2 鲢心脏组织中抗氧化酶活性
随着溶解氧的降低, 鲢心脏中T-AOC和CAT活性呈下降趋势, T-AOC在氧浓度2.5 mg/L时显著低于常氧水平21%(P<0.05), 而CAT在溶解氧浓度1.5 mg/L时显著低于常氧水平37%(P<0.05)。SOD和GSHPX酶活性在氧浓度0.25 mg/L时分别高于常氧水平13%和26%(图 3)。在持续低氧胁迫后, 鲢心脏中TAOC和CAT的活性随着低氧时间增加呈下降趋势,在持续低氧3h时显著低于常氧水平35%和16%(P<0.05)。SOD的活性随着低氧胁迫时间增加呈上升趋势, 在低氧3h时显著高于常氧水平22%(P<0.05)。GSH-PX的活性在低氧胁迫3h时达到最高(P<0.05),随后开始下降, 但是在持续低氧24h时仍高于常氧水平22%。在复氧后, 鲢心脏中T-AOC、SOD和GSH-PX的活性在复氧3h时迅速恢复至常氧水平(P>0.05), 而SOD和GSH-PX的活性在复氧6h时又显著升高(P<0.05), 之后随复氧时间的增加逐渐恢复至常氧水平(P>0.05)。CAT酶活性随复氧时间的增加呈上升趋势, 在复氧12h时恢复常氧水平(P>0.05;图 4)。
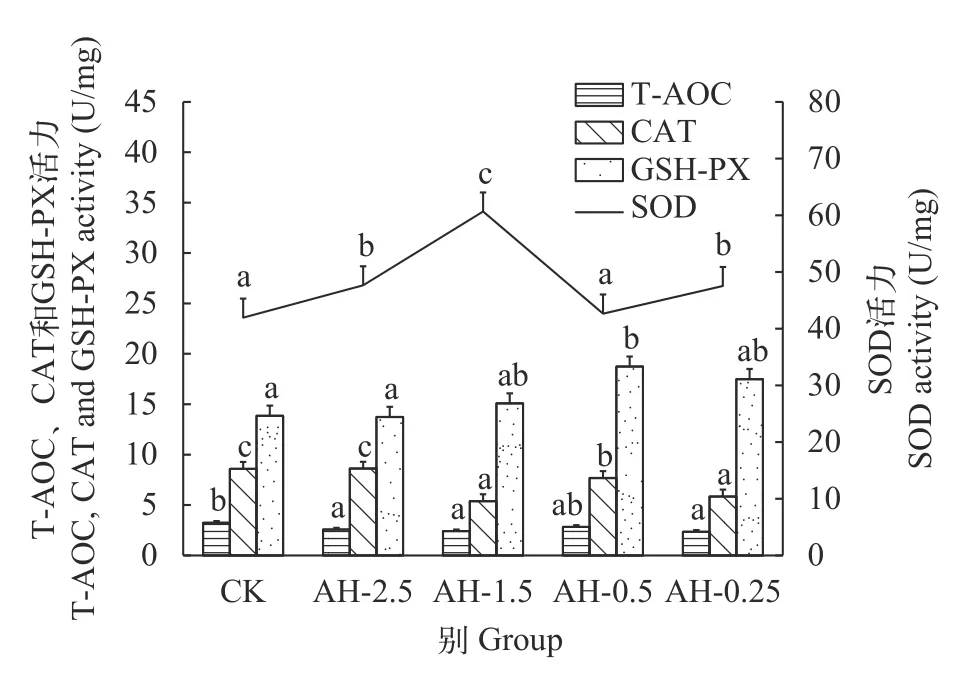
图3 急性低氧胁迫对鲢心脏组织中抗氧化酶活性的影响Fig. 3 Effects of acute hypoxic stress on antioxidant enzyme activity in the heart tissue of H. molitrix
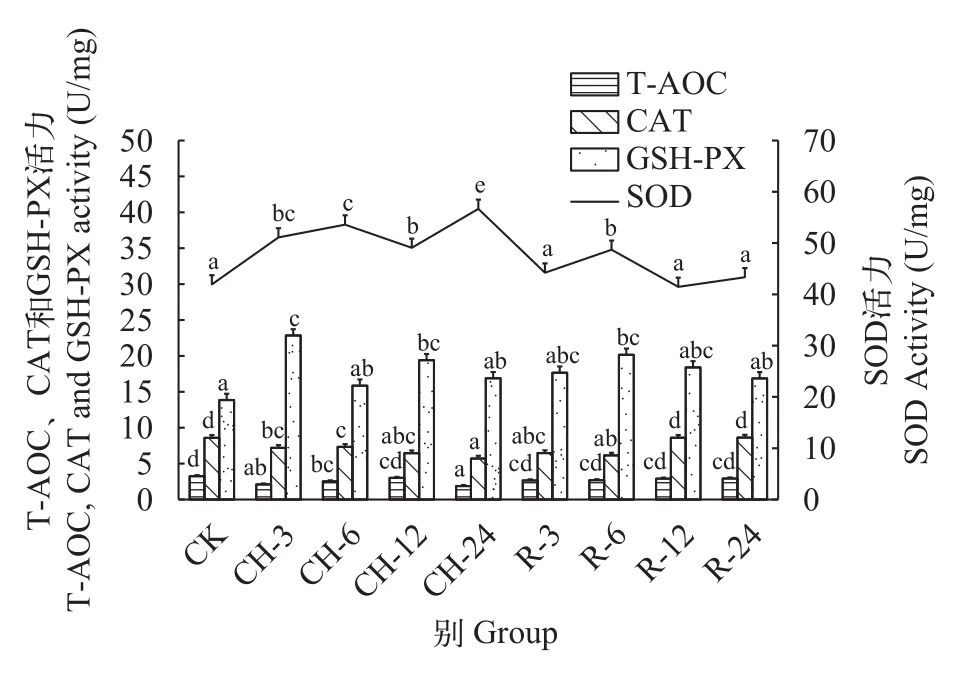
图4 持续低氧胁迫及复氧对鲢心脏组织中抗氧化酶活性的影响Fig. 4 Effects of continuous hypoxic stress and reoxygenation on antioxidant enzyme activity in the heart tissue of H. molitrix
2.3 鲢肝脏组织中抗氧化酶活性
随着溶解氧的降低, 鲢肝脏中T-AOC和GSHPX酶活性持续下降, 在溶解氧浓度0.25 mg/L时较常氧水平分别下降27%和21%(P<0.05)。SOD和CAT酶活性在氧浓度2.5 mg/L时显著升高, 且SOD酶活性达到最高, 较常氧水平升高41%(P<0.05)。之后随着氧浓度的下降, SOD酶活性明显下降, 但在氧浓度0.25 mg/L时仍显著高于常氧水平(P<0.05;图 5)。在持续低氧胁迫后, 鲢肝脏中T-AOC、SOD和GSH-PX酶活性在低氧胁迫6h时均降到最低(P<0.05), 随后开始升高, 但T-AOC和GSH-PX酶活性在低氧胁迫24h时仍低于常氧水平(P>0.05), 而SOD酶活性在低氧胁迫24h时显著高于常氧水平32%(P<0.05)。CAT酶活性随着低氧胁迫时间增加呈上升趋势, 在低氧胁迫3h时相比常氧水平显著升高(P<0.05)。在复氧后, 鲢肝脏中T-AOC活性在复氧3h时显著降低(P<0.05), 在复氧6h时恢复常氧水平(P>0.05), 而SOD酶活性在复氧3h恢复至常氧水平。CAT酶活性随复氧时间的增加显著下降(P<0.05), 在复氧12h时恢复常氧水平(P>0.05; 图 6)。
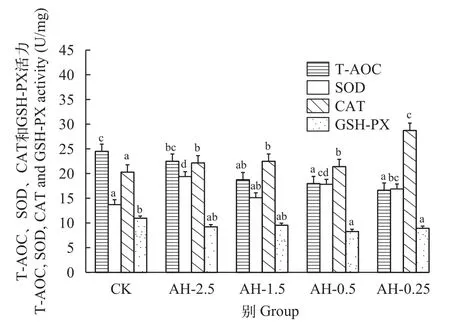
图5 急性低氧胁迫对鲢肝脏组织中抗氧化酶活性的影响Fig. 5 Effects of acute hypoxic stress on antioxidant enzyme activity in liver tissue of H. molitrix
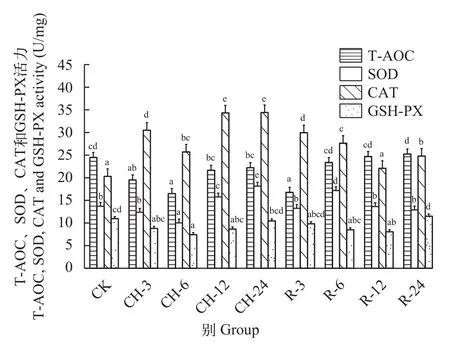
图6 持续低氧胁迫及复氧对鲢肝脏组织中抗氧化酶活性的影响Fig. 6 Effects of continuous hypoxic stress and reoxygenation on antioxidant enzyme activity in the liver tissue of H. molitrix
2.4 鲢心脏和肝脏组织中Cu/Zn-SOD及Mn-SOD基因表达特征
Cu/Zn-SOD和Mn-SOD基因在鲢低氧胁迫及复氧下的心脏和肝脏中的表达分析显示, 在心脏组织中, 随着溶解氧浓度的降低,Cu/Zn-SOD基因在氧浓度2.5 mg/L时达到最高(P<0.05),Mn-SOD基因在氧浓度0.5 mg/L时达到最高, 分别是常氧水平的1.8倍和4.7倍(P<0.05), 而在氧浓度0.25 mg/L时Cu/Zn-SOD和Mn-SOD基因的表达水平则与常氧相比无显著差异(P>0.05)。在持续低氧胁迫后,Cu/Zn-SOD在低氧3h时显著下降(P<0.05),Mn-SOD基因则显著升高; 而在低氧6h时Cu/Zn-SOD和Mn-SOD基因的表达水平最高(P<0.05), 之后随低氧胁迫时间的增加而下降, 24h时显著低于常氧水平(P<0.05)。在复氧后,Cu/Zn-SOD和Mn-SOD基因表达呈上升趋势, 在复氧24h时恢复至常氧水平(P>0.05; 图 7)。在肝脏组织中, 随着溶解氧浓度的降低,Cu/Zn-SOD在氧浓度1.5 mg/L表达水平达到最高(P<0.05), 是常氧水平的14.7倍;Mn-SOD基因表达呈持续上升的趋势, 在氧浓度2.5 mg/L时就已显著上调2.2倍(P<0.05)。随着低氧时间的增加,Cu/Zn-SOD和Mn-SOD表达呈上升趋势, 在持续低氧3h时已显著高于常氧水平(P<0.05)。在复氧后,Cu/Zn-SOD和Mn-SOD基因在复氧3h时的表达显著降低(P<0.05), 到复氧24h时恢复至常氧水平(P>0.05; 图 8)。
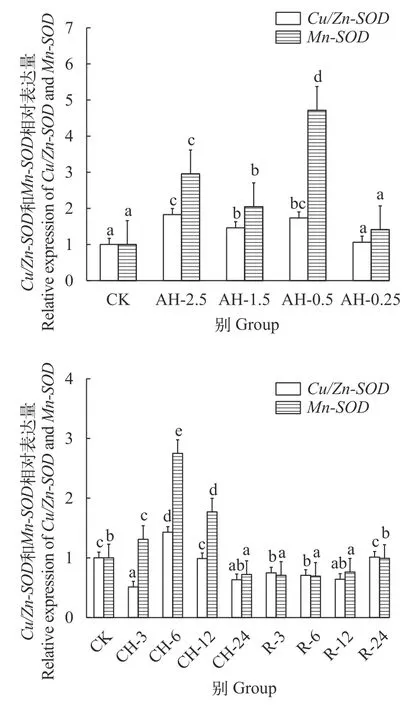
图7 急性低氧胁迫、持续低氧胁迫及复氧对鲢心脏组织中Cu/Zn-SOD及Mn-SOD基因表达量的影响Fig. 7 Effects of acute hypoxic stress, continuous hypoxic stress and reoxygenation on Cu/Zn-SOD and Mn-SOD gene expression in the heart tissue of H. molitrix
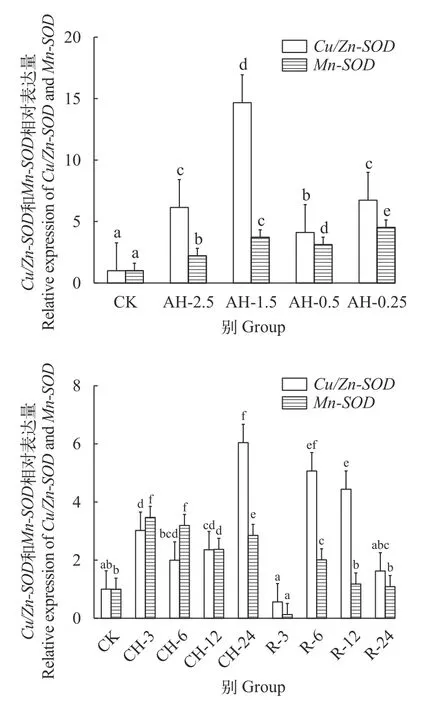
图8 急性低氧胁迫、持续低氧胁迫及复氧对鲢肝脏组织中Cu/Zn-SOD及Mn-SOD基因表达量的影响Fig. 8 Effects of acute hypoxic stress, continuous hypoxic stress and reoxygenation on Cu/Zn-SOD and Mn-SOD gene expression in the liver tissue of H. molitrix
3 讨论
3.1 低氧胁迫对鲢抗氧化酶活力的影响
当机体受到低氧胁迫时, 会产生氧化应激反应,即产生大量活性氧自由基, 造成机体细胞和组织的氧化损伤[6]。此时, 机体通过抗氧化酶和抗氧化剂来调控体内ROS来降低氧化应激造成的损伤。清除体内ROS的抗氧化酶和抗氧化剂主要包括SOD、CAT、GSH-PX。SOD作为机体抗氧化防御系统的第一道屏障, 通过歧化反应将对机体有害的超氧自由基(O2-)转化为H2O2和O2, 从而降低机体内超氧自由基的含量[18]。CAT则可以催化H2O2转化为O2和H2O。同时, GSH-PX可以通过催化还原型G-SH将细胞内产生的ROS和H2O2还原[19]。
在低氧胁迫开始阶段, 低氧造成鲢体内ROS含量上升, 激活了体内抗氧化酶系统。此时鲢血清、心脏和肝脏中超氧化物歧化酶活性迅速升高,SOD作为消除ROS的第一道防线, 在机体面临氧化应激时率先被激活, 将对机体有害的超氧自由基(O2-)转化为H2O2和O2[20]。同时, 鲢血清和肝脏中CAT活力显著升高, 且血清和心脏中GSH-PX活力显著升高, CAT与GSH-PX同时发挥作用, 减少氧化应激对鲢机体造成的损害。在卵形鲳鲹(Trachinotus ovatus)[21]、刺参(Apostichopus japonicus)[22]和南美白对虾(Litopenaeus Vannamei)[23]的研究中也有类似发现。鲢在低氧胁迫下体内进行无氧呼吸, 产生大量ROS急剧消耗抗氧化酶, 导致SOD活性下降。之后随着低氧胁迫的进一步加剧, 鲢体内SOD活力快速升高, 以消除ROS, 避免对机体造成严重损伤,这与在中华乌塘鳢[24](Bostrychus sinensis)中的研究结果一致。而此时鲢体内SOD酶产生的H2O2, 超过了CAT和GSH-PX的承受范围, 导致鲢心脏中CAT和GSH-PX酶活力受到抑制。这与日本沼虾(Macrobrachium nipponense)[25]、大黄鱼(Larimichthys crocea)[26]及鲤(Cyprinus carpio)[27]的研究结果一致。在复氧3h后, 鲢肝脏中SOD酶活力迅速恢复至常氧水平, 可能是肝脏作为硬骨鱼类机体新陈代谢的主要场所, 在物质代谢、解毒、凝血和防御等生命活动过程中起着至关重要的作用[28,29]。而在复氧3h血清中CAT和GSH-PX酶活力显著高于常氧水平, 此时机体仍属于氧化应激状态, CAT和GSHPX酶发挥作用来消除机体内过量的H2O2, 与葛氏鲈塘鳢(Perccottus glenii)中[30]的研究相符, 随着复氧时间的增加, 鲢血清、心脏和肝脏中CAT和GSH-PX酶活力在24h内均恢复常氧水平, 表明机体内抗氧化酶清除了氧化应激产生的有害物质, 使机体逐渐恢复正常。
总抗氧化能力是用于衡量机体抗氧化系统功能状况的综合性指标, T-AOC的大小反映机体抗氧化酶系统和非酶促系统对外来刺激的代偿能力以及机体自由基代谢的状态[31]。张倩等[32]发现低氧胁迫下鲫(Carassius auratus)血清、肌肉和鳃中总抗氧化能力持续上调, 复氧后恢复至正常水平。而在本研究中, 低氧胁迫后鲢血清中T-AOC显著上升, 心脏和肝脏组织中T-AOC的活性显著下降, 与团头鲂[33](Megalobrama amblycephala)在低氧胁迫中, 随着溶解氧浓度的降低, T-AOC的活性在血清中逐渐增加, 在肝脏中逐渐降低的结果一致, 表明低氧胁迫大量消耗心脏和肝脏组织中的抗氧化物质, 使心脏和肝脏组织中的T-AOC活性明显下降。在复氧后, 鲢血清和心脏中T-AOC逐渐恢复至正常水平, 鲢可以迅速对血清和心脏内氧自由基进行清除, 以应对低氧胁迫对机体造成的损伤。而肝脏中T-AOC先显著下降后恢复至正常水平, 与管越强等[34]在持续低氧胁迫及复氧后的日本沼虾肝胰腺和肌肉组织中T-AOC先显著下降后恢复至正常水平的结果相似。
3.2 低氧胁迫对鲢Cu/Zn-SOD及Mn-SOD基因表达量的影响
超氧化物歧化酶(SOD)作为机体内重要的抗氧化酶, 其表达变化常用于反映机体氧化应激水平[35]。目前鱼类中仅发现两种超氧化物歧化酶, 即Cu/Zn-SOD和Mn-SOD[36]。其中,Cu/Zn-SOD包括胞质Cu/Zn-SOD和细胞外Cu/Zn-SOD, 而Mn-SOD则是一种线粒体内SOD酶[37]。当发生氧化应激时, 机体可以通过激活SODs基因合成超氧化物歧化酶[38]。细胞内SODs基因表达水平的提高, 可以减少ROS对机体的损伤[39]。
在低氧胁迫早期SODs系统会被激活, 通过增加Cu/Zn-SOD及Mn-SOD基因表达量来消除机体内因氧化应激产生的过量的ROS, 因此鲢心脏和肝脏中Cu/Zn-SOD及Mn-SOD基因表达量在低氧胁迫前期显著上升。而在低氧胁迫后期, 鲢心脏中Cu/Zn-SOD及Mn-SOD基因表达显著下降, 这与瓦氏黄颡鱼(Pelteobagrus vachelli)[40]的研究结果相似。SODs基因被抑制可能是由于低氧胁迫后期鲢心脏中有氧呼吸减弱, 影响细胞内ATP的生成、RNA的转录、蛋白质的翻译等[41]。然而心脏中SOD酶活性并没有因Cu/Zn-SOD及Mn-SOD基因表达量显著下降而下降, 反而显著上升。可能是鱼类在低氧胁迫后, 为保护心脏和脑等对机体生存起重要作用的组织, 血液会重新分配抗氧化酶以确保其组织可以在低氧胁迫下维持正常的生理机能。因而鲢肝脏中Cu/Zn-SOD及Mn-SOD基因表达量在低氧胁迫后均显著上升, 而肝脏和血液中SOD酶活力却显著下降。在复氧3h后, 鲢心脏及肝脏中Cu/Zn-SOD及Mn-SOD基因表达量显著低于正常水平。复氧作为一种氧化应激, 也会导致Cu/Zn-SOD及Mn-SOD基因表达被抑制。随着复氧时间的增加,Cu/Zn-SOD及Mn-SOD基因表达也恢复至常氧水平, 与瓦氏黄颡鱼[42]研究结果相一致, 在复氧条件下, 瓦氏黄颡鱼的肝脏和脑中Cu/Zn-SOD及Mn-SOD基因表达量可以迅速恢复至常氧水平。
4 结论
低氧胁迫会使鲢产生氧化应激反应, 而应激后对其进行复氧也会使鲢产生应激反应, 激活体内的抗氧化酶防御系统。在低氧胁迫开始时, 鲢血清、心脏和肝脏中抗氧化酶会发生显著性变化来应对机体内的氧化应激。而随着低氧胁迫的进一步加剧, 氧化应激会对机体造成损伤, 使得机体内抗氧化酶活力下降。在复氧后, 机体也会产生氧化应激,导致机体内抗氧化酶活力显著上升, 而随着复氧时间的增加, 机体内抗氧化酶活力会逐渐恢复至正常水平。本研究为更好地解析鲢在低氧胁迫下抗氧化应激机制提供了基础数据。
