慢性肾脏病3~5期患者血清血管生成素样蛋白8水平与动脉硬化的关系▲
2022-05-25周彬刘楠
周 彬 刘 楠
(中国人民解放军空军第986医院1 中医科,2 神经内科,陕西省西安市 710054,电子邮箱:l234712@126.com)
近年来,我国慢性肾脏病的患病率已高达8.81%,且患病率呈逐年升高的趋势,已成为威胁国民健康的重要疾病之一[1]。除引起机体水钠代谢障碍、尿蛋白量异常外,慢性肾脏病所引起的一系列并发症也是导致患者生活质量降低的重要因素[2]。其中动脉硬化是慢性肾脏病较常见的并发症之一,慢性肾脏病3~5期患者发生动脉硬化的风险尤其高[3]。
临床上诊断动脉硬化主要依靠超声检查,但超声检查不能覆盖机体全部血管,也不能反映动脉硬化的病变过程。血清学指标的检测具有操作简便、可重复性强、可以反映机体整体变化等优点,被广泛应用于临床研究。血管生成素样蛋白(angiopoietin-like protein,ANGPTL)家族是近年来新发现的一类糖蛋白家族,具有调控机体脂肪代谢和胰岛素敏感性的重要功能[4]。ANGPTL8水平是该家族的重要成员,研究表明,ANGPTL8与血清胆固醇、三酰甘油水平等密切相关[5]。本研究探讨慢性肾脏病3~5期患者血清ANGPTL8水平与动脉硬化的关系。
1 资料与方法
1.1 临床资料 选取2018年1月至2020年12月我院收治的153例慢性肾脏病3~5期患者作为研究对象。纳入标准:(1)符合慢性肾脏病3~5期的诊断标准[6];(2)均进行颈动脉彩色超声多普勒检查;(3)病历资料完整;(4)初次到我院就诊治疗的患者。排除标准:(1)合并心力衰竭、肿瘤、脑卒中者;(2)既往有肾移植、血液透析史的患者;(3)紫癜性肾炎、乙型肝炎病毒相关性肾炎、狼疮肾炎者。其中男性88例,女性65例;年龄38~69(57.72±8.23)岁;体质指数18~28(24.56±2.18)kg/m2;原发疾病:高血压肾病54例,糖尿病肾病34例,慢性肾小球肾炎65例;慢性肾脏病3期46例,4期68例,5期39例。根据患者颈动脉彩色多普勒超声检查结果将其分为动脉硬化组[存在颈动脉斑块或颈动脉内膜中层厚度(intima-media thickness,IMT)≥1.0 mm[7]]86例和对照组(颈动脉IMT<1.0 mm)67例。本研究经我院医学伦理委员会审批同意,且患者及其家属均对本研究知情同意。
1.2 观察指标
1.2.1 血压的测量:入院后,于治疗前使用电子血压计(厂家:中国欧姆龙自动化有限公司;型号:TM-2656VP)测量患者安静状态下的上臂肱动脉血压,计算平均动脉压(mean arterial pressure,MAP),MAP=舒张压+1/3脉压差。
1.2.2 血生化指标及血清ANGPTL8水平的检测:所有患者于入院次日,在未经过药物治疗的情况下采集外周静脉血10 mL,用两个试管分装。其中1份标本在800 r/min下离心10 min,分离血清,应用全自动生化分析仪(厂家:Roche Diagnostics GmbH;型号:Cobas 8000)测定总胆固醇、三酰甘油、LDL-C、HDL-C、空腹血糖、血肌酐、血尿素氮、血尿酸、白蛋白水平。另一份标本在3 500 r/min下离心10 min,分离血清,应用酶联免疫吸附法测定血清ANGPTL8水平,严格按照ANGPTL8检测试剂盒(厂家:上海武昊生物科技有限公司;货号:SEW803Mu-96T;生产批号:20190112)说明书进行操作。
1.2.3 颈动脉彩色多普勒超声检查:入院后,于治疗前应用东芝SSA-770A彩色多普勒超声诊断仪检查患者颈动脉,探头频率为5.0 MHz~10.0 MHz。患者取仰卧位,在颈后部垫枕,使患者头部后仰偏向检查对侧,充分暴露颈动脉,依次检查颈总动脉、颈动脉分叉处血管长轴和短轴,测量颈动脉IMT,取两侧的平均值计算。
1.3 统计学分析 采用SPSS 25.0软件进行统计学分析。计数资料以例数或百分率表示,比较采用χ2检验;计量资料以(x±s)表示,组间比较采用t检验;采用Pearson检验进行相关性分析;采用多因素Logistic回归模型分析慢性肾脏病3~5期患者发生动脉硬化的危险因素;采用受试者工作特征(receiver operating characteristic,ROC)曲线评估血生化指标和血清ANGPTL8水平诊断慢性肾脏病3~5期患者发生动脉硬化的价值,并采用DeLong检验比较曲线下面积。以P<0.05表示差异有统计学意义。
2 结 果
2.1 两组患者临床资料和血清学指标的比较 动脉硬化组患者的MAP、总胆固醇、三酰甘油、LDL-C、空腹血糖、血清ANGPTL8水平均高于对照组(均P<0.05),见表1。

表1 两组患者临床资料和血清学指标的比较
2.2 慢性肾脏病3~5期患者血清ANGPTL8水平与MAP、总胆固醇、三酰甘油、LDL-C、空腹血糖、颈动脉IMT的相关性 Pearson相关分析结果显示,慢性肾脏病3~5期患者血清ANGPTL8水平与MAP、总胆固醇、三酰甘油、LDL-C、空腹血糖、颈动脉IMT均呈正相关(r=0.434、0.507、0.487、0.512、0.443、0.532,P=0.014、<0.001、=0.004、<0.001、=0.012、=0.003)。
2.3 慢性肾脏病3~5期患者发生动脉硬化的影响因素 以慢性肾脏病3~5期患者是否合并动脉硬化为因变量(是=1,否=0),以表1中有统计学意义的指标为自变量,赋值如下(均以153例患者的平均水平作为分界值):MAP(≥104.81 mmHg=1,<104.81 mmHg=0)、总胆固醇(≥5.06 mmol/L =1,<5.06 mmol/L=0)、三酰甘油(≥2.10 mmol/L=1,<2.10 mmol/L=0)、LDL-C(≥3.36 mmol/L=1,<3.36 mmol/L=0)、空腹血糖(≥5.53 mmol/L=1,<5.53 mmol/L=0)、血清ANGPTL8(≥25.60 ng/mL=1,<25.60 ng/mL=0),纳入多因素Logistic回归模型中进行分析。结果显示,总胆固醇水平≥5.06 mmol/L、LDL-C水平≥3.36 mmol/L、血清ANGPTL8水平≥25.60 ng/mL是慢性肾脏病3~5期患者发生动脉硬化的危险因素(均P<0.05),见表2。
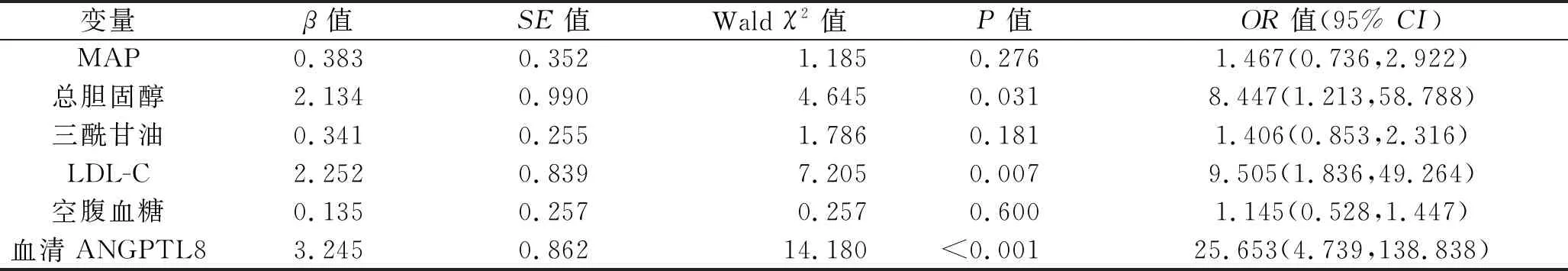
表2 慢性肾脏病3~5期患者发生动脉硬化的多因素Logistic回归分析
2.4 血清ANGPTL8水平、总胆固醇水平、LDL-C水平对慢性肾脏病3~5期患者发生动脉硬化的诊断价值 ROC曲线分析结果显示,血清ANGPTL8水平、总胆固醇水平、LDL-C水平诊断慢性肾脏病3~5期患者发生动脉硬化的曲线下面积分别为0.832、0.672、0.578(均P<0.05),灵敏度分别为90.25%、74.98%、64.37%,特异度分别为85.76%、71.37%、58.76%。血清ANGPTL8水平诊断慢性肾脏病3~5期患者的曲线下面积大于总胆固醇水平、LDL-C水平诊断的曲线下面积(z=2.321,P=0.005;z=2.542,P=0.002)。见表3和图1。
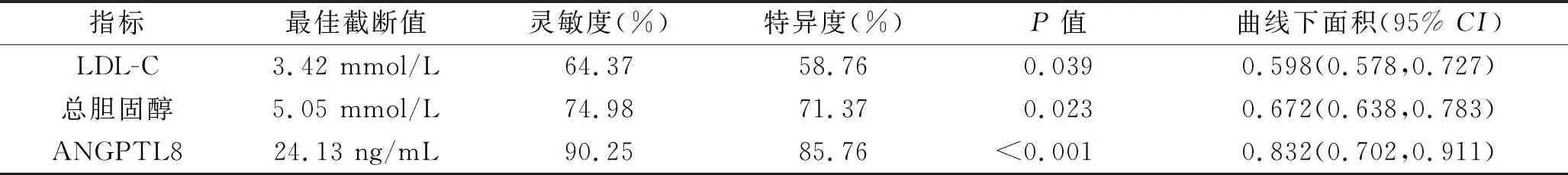
表3 血清ANGPTL8、总胆固醇、LDL-C水平对慢性肾脏病3~5期患者发生动脉硬化的诊断价值

图1 血清ANGPTL8水平、总胆固醇水平、LDL-C水平诊断慢性肾脏病3~5期患者发生动脉硬化的ROC曲线
3 讨 论
当病情进展至3期后,慢性肾脏病患者的肾小球滤过率明显降低,乏力、食欲不振、夜尿增多、恶心呕吐、水肿等临床症状和体征明显,严重时甚至出现水电解质紊乱、肾性骨病、贫血、动脉硬化及其他心血管疾病等并发症[8]。其中动脉硬化是慢性肾脏病的主要并发症之一,其所引起的心血管疾病是造成慢性肾脏病患者死亡的首要原因[9]。目前认为慢性肾脏病患者发生动脉硬化的主要机制有:(1)慢性肾脏病患者脂质代谢异常,血液中的脂质浸润动脉内膜,引起动脉内膜粥样硬化[10];(2)慢性肾脏病患者机体的微炎症状态刺激动脉内皮细胞释放炎症介质和黏附分子,导致动脉硬化[11];(3)慢性肾脏病尤其是慢性肾脏病3~5期患者存在钙磷代谢失调,高磷血症可以导致动脉内皮细胞出现氧化应激损伤,引发动脉硬化[12];(4)糖尿病肾病所致的慢性肾脏病3~5期患者血糖水平异常,这导致动脉内皮细胞玻璃样变,引发动脉硬化[13]。
ANGPTL8是近年来新发现的一种分泌性糖蛋白,其编码基因位于人类第19号染色体开放阅读框80对应的内含子[14]。研究表明,ANGPTL8主要在皮下脂肪、肾脏、小肠、心脏与性腺周围组织中高度表达,是参与葡萄糖代谢和脂质代谢的重要分子[15]。Zhang等[16]报告,ANGPTL8在敲除血管生成素基因小鼠高脂肪饮食饲养后的脂质代谢和激素调节中发挥重要作用。本研究结果显示,动脉硬化组血清ANGPTL8水平高于对照组,且血清ANGPTL8水平与颈动脉IMT呈正相关(P<0.05),提示血清ANGPTL8水平可能与慢性肾脏病3~5期患者发生动脉硬化密切相关,这与申晓平等[17]和武悦等[18]的研究结果相符。此外,动脉硬化组MAP、总胆固醇、三酰甘油、LDL-C、空腹血糖水平均高于对照组(均P<0.05)。MAP是机体一个心动周期中动脉血压的平均值,与血管舒缩功能密切相关,可以反映动脉硬化情况,因此动脉硬化组MAP水平较高。而总胆固醇、三酰甘油、LDL-C水平异常升高是动脉粥样硬化发生的危险因素[19],故慢性肾脏病3~5期动脉硬化患者的总胆固醇、三酰甘油、LDL-C水平升高。高血糖可通过促进氧化、产生氧自由基、抑制人体内皮细胞DNA合成等多种机制引起血管壁的损害,进而造成血管内皮细胞的抗血小板聚集能力受损,并可促进血管内皮细胞、单核-巨噬细胞分泌炎症因子,最终促进并加重斑块形成而引发动脉硬化[20],因此动脉硬化患者的空腹血糖水平更高。
研究表明,ANGPTL8过表达小鼠的脂蛋白脂肪酶活性降低,三酰甘油水平升高,而ANGPTL8基因敲除小鼠的脂蛋白脂肪酶活性增强,三酰甘油水平降低,说明ANGPTL8可以通过抑制脂蛋白脂肪酶的活性,降低三酰甘油的清除速度,从而引起血脂代谢紊乱[16]。ANGPTL8还可以与胰岛B细胞结合,并通过上调胰岛素介导的蛋白激酶B信号通路相关蛋白磷酸化并调控糖原合成过程来影响机体糖代谢,导致动脉内皮细胞玻璃样变[21]。ANGPTL8还可以促进同家族成员ANGPTL3的切割,并与ANGPTL3形成复合物,协同抑制脂蛋白脂肪酶活性,导致机体三酰甘油、LDL-C水平增高[22]。本研究结果显示,慢性肾脏病3~5期患者血清ANGPTL8水平与MAP、总胆固醇、三酰甘油、LDL-C、空腹血糖水平均呈正相关(均P<0.05),原因可能与上述分析有关。本研究还分析了慢性肾脏病3~5期患者发生动脉硬化的危险因素,结果显示,总胆固醇水平≥5.06 mmol/L、LDL-C水平≥3.36 mmol/L、血清ANGPTL8水平≥25.60 ng/mL是慢性肾脏病3~5期患者发生动脉硬化的危险因素(均P<0.05)。目前已有研究表明总胆固醇、LDL-C水平异常升高会增加动脉硬化的发生风险,而ANGPTL8则可以通过影响机体糖脂代谢增加动脉硬化的发生风险[23]。
ROC曲线分析结果显示,血清ANGPTL8水平诊断慢性肾脏病3~5期患者发生动脉硬化的灵敏度与特异度均高于85%,曲线下面积大于0.8,且大于总胆固醇、LDL-C水平诊断的曲线下面积(均P<0.05),提示血清ANGPTL8水平可以较为敏感、准确地诊断慢性肾脏病3~5期动脉硬化的发生情况。在临床诊断中仅依靠超声检查难以覆盖机体全部血管,也不能反映动脉硬化的病变过程,且存在一定主观性。而血清ANGPTL8水平的检测具有操作方便、可反复进行、可动态观察的优点,具有很好的应用前景。但本研究的病例数较少,未进行ANGPTL8分子生物学机制研究,有待于今后进一步深入研究。
综上所述,发生动脉硬化的慢性肾脏病3~5期患者血清ANGPTL8水平高于无动脉硬化者;血清ANGPTL8水平升高是慢性肾脏病3~5期患者出现动脉硬化的危险因素,该指标对慢性肾脏病3~5期患者发生动脉硬化具有一定的诊断价值。
