甲醛溶液浸泡的人类组织样本基因组DNA的提取方法与质量鉴定
2022-05-24杨博宇孙鲁宁栾泽东庞文艳吴秀山范雄伟江志钢
杨博宇,蔡 毅,孙鲁宁,栾泽东,庞文艳,吴秀山,范雄伟,江志钢*
(1. 湖南师范大学心脏发育研究中心,长沙 410081;2. 莱州市妇幼保健院,烟台 261400)
福尔马林(4%甲醛)浸泡是一种常见的保存组织样本的方式,其固定的人类组织样本通常是分子遗传学研究的一种极其宝贵的资源[1-2],通常是可供个体基因测序的唯一样本。福尔马林可固定保留组织和细胞的形态以供解剖病理学家评估,它还使固定的组织能够在常温条件下储存。然而,使用福尔马林浸泡的组织其DNA在进行分子检测时通常存在问题。由于序列的随机断裂,从福尔马林保存的组织中提取的基因组DNA被高度降解,导致可用于PCR扩增的可扩增模板的数量显著减少[3-4]。由于DNA降解,这种类型的组织中只能扩增出短序列,通常少于100个碱基。过去经常使用非缓冲甲醛溶液保存样本,在保存了20年以上的组织中经常发现更广泛的核酸降解。没有缓冲的甲醛溶液会被氧化成甲酸,而酸性环境是DNA降解的主要原因。DNA在轻度酸性溶液中相对稳定,但在pH值为4左右时,嘌呤碱基中的β糖苷键被水解,最终导致DNA片段的断裂[5]。除此之外,甲醛浸泡的组织样本通常存在DNA与蛋白质交联的复合物,可阻碍蛋白酶对组织的消化, 从而影响DNA的提取。同时,在PCR扩增时,复合物也会阻碍引物与模板的结合以及DNA双链的延伸[6]。然而,为临床诊断、基因测序、分子试验研究准备足量的高质量DNA是非常重要的[7-8]。本文拟从DNA提取的质量浓度、纯度以及体外扩增效果三方面来探究甲醛浸泡组织的基因组DNA提取方法的实用性。
1 材料与方法
1.1 试验材料
试验所需的组织样本为2019年6月、2019年10月、2021年1月和2021年7月使用福尔马林浸泡的1号、2号、3号和4号引产人类胎儿的部分皮肤和肌肉组织,并于常温储存至今。试验开展时,其分别已在福尔马林中固定约30、24、11、5个月。经湖南师范大学生物医学研究伦理委员会审查,该研究的试验设计和方案充分考虑了安全性和公平性原则,试验材料获取方式正规、合法。研究内容和研究结果不存在利益冲突。
1.2 引物
本研究使用的引物为擎科生物(Tsingke)公司合成的通用引物。其序列为目的片段长为175 bp的GATA4基因组引物(F:TGGAGACTTTGCAGTCGCTT;R: CTCAGATCCCGCTGCGTTTA)、目的片段长为327 bp的GAPDH基因组引物(F:GGCTCTTAAAAAGTGCAGGGTC;R:ATGGTACATGACAAGGTGCGG)、目的片段长为674 bp的LRRC10基因组引物(F:CCTGGCTTTTCTAGGGTCGG;R:CGCTGGACAAGATGGTGGAT)。
1.3 试剂盒
FastPure FFPE DNA Isolation Kit(Vazyme DC105)、Universal Genomic DNA Kit(康为世纪 CW2298S)用于基因组DNA提取。2×Taq plus Master Mix(Biosharp,BL547B)用于PCR反应。
1.4 方法
1.4.1 基于常规柱式DNA提取试剂盒的提取方法(提取方法一)
使用清洗消毒后的镊子将甲醛中的组织块取出,用眼科剪将约40 mg的组织尽量剪碎,放于吸水纸上吸干,并收集组织碎片放入灭菌EP管中。使用磷酸盐缓冲液(phosphate buffer solution,PBS)浸泡2 h以洗去组织表面残留的甲醛。将样品以12000 r/min的速度离心5 min,吸弃上清液,加入Universal Genomic DNA Kit中的Buffer GTL(180 μL)和Proteinase K(20 μL),56℃水浴3 h。接下来的处理完全按照Universal Genomic DNA Kit的说明书操作。
1.4.2 经改良的专门用于甲醛溶液浸泡组织的提取方法(提取方法二)
通过与1.4.1中相同的操作得到40 mg的组织碎片,放入灭菌EP管中。根据张红玲等[9]的方法,使用核酸提取缓冲液(1.21 g/L Tris,5.84 g/L NaCl,0.37 g/L EDTA)和100%乙醇分别浸泡样品,每次2 h,之后用核酸提取缓冲液冲洗2次。将样品以12000 r/min的速度离心5 min,吸弃上清液,加入FastPure FFPE DNA Isolation Kit中的Buffer FTL(270 μL)和Proteinase K工作液(30 μL),振荡约30 s。56℃水浴过夜(约12~16 h)。将样品转移至90℃水浴约1.5 h后,10000×g离心3 min,吸上清转移至新EP管中并加入300 μL Buffer FL和300 μL无水乙醇,震荡约30 s。将试剂盒内置DNA吸附柱置于收集管中,转移混合液至吸附柱中,10000×g离心60 s。弃滤液,将吸附柱置于收集管中,加入500 μLBuffer FW1(已加入乙醇)至吸附柱上,10000×g离心60 s。弃滤液,将吸附柱置于收集管中,加入650 μL Buffer FW2(已加入乙醇)至吸附柱上,10000×g离心60 s。弃滤液,将吸附柱置于收集管中,10000×g离心空柱3 min。将吸附柱转移至新的1.5 mL离心管中,放置于37℃恒温箱中5 min以挥发乙醇,分两次共加入40 μL ddH2O至吸附柱膜中央,分别在室温静置1 min后以12000 r/min的速度离心2 min,以得到样本的基因组DNA溶液。
1.4.3 基因组DNA的质量浓度和纯度检测
加入99 μL ddH2O和1 μL DNA样本,使用分光光度计(eppendorf BioPhotometer plus 6132)进行dsDNA检测,并记录5次的质量浓度,计算OD260nm/OD280nm、OD260nm/OD230nm的数值以求平均值。
1.4.4 基因组DNA的PCR扩增
以所提取的甲醛浸泡组织的基因组DNA为模板,使用Thermo Fisher Scientific公司的PCR仪(Applied Biosystems MiniAmp A37028)扩增人类基因序列。将PCR仪设置反应程序为Touch Down降落PCR程序,具体如下:95℃ 预变性3 min,95℃变性30 s,65℃退火30 s,72℃延伸1 min;之后每个循环依次降低退火温度1℃,直到56℃,共10个循环;95℃变性30 s,56℃退火30 s,72℃延伸1 min,23个循环;72℃ 延伸3 min后,置于4℃存放。
1.4.5 琼脂糖凝胶电泳
取适量DNA溶液,使用1.5%的琼脂糖凝胶在150 V电压下进行电泳,在凝胶成像系统下检测拍照。
2 结果与分析
2.1 样本基因组DNA提取及质量浓度与纯度测定
使用上述方法,分别将使用福尔马林固定30个月的1号样本、固定24个月的2号样本、固定11个月的3号样本和固定5个月的4号样本剪碎,并分别提取其基因组DNA。各取1 μL,使用分光光度计测量其双链DNA的质量浓度,并计算OD260nm/OD280nm、OD260nm/OD230nm。表1和表2分别展示出使用提取方法一和提取方法二所得的基因组DNA溶液的检测数值。结果显示,同样的样本,使用改良的提取方法二提取的基因组DNA的质量浓度普遍高于提取方法一,大部分的纯度高于提取方法一。
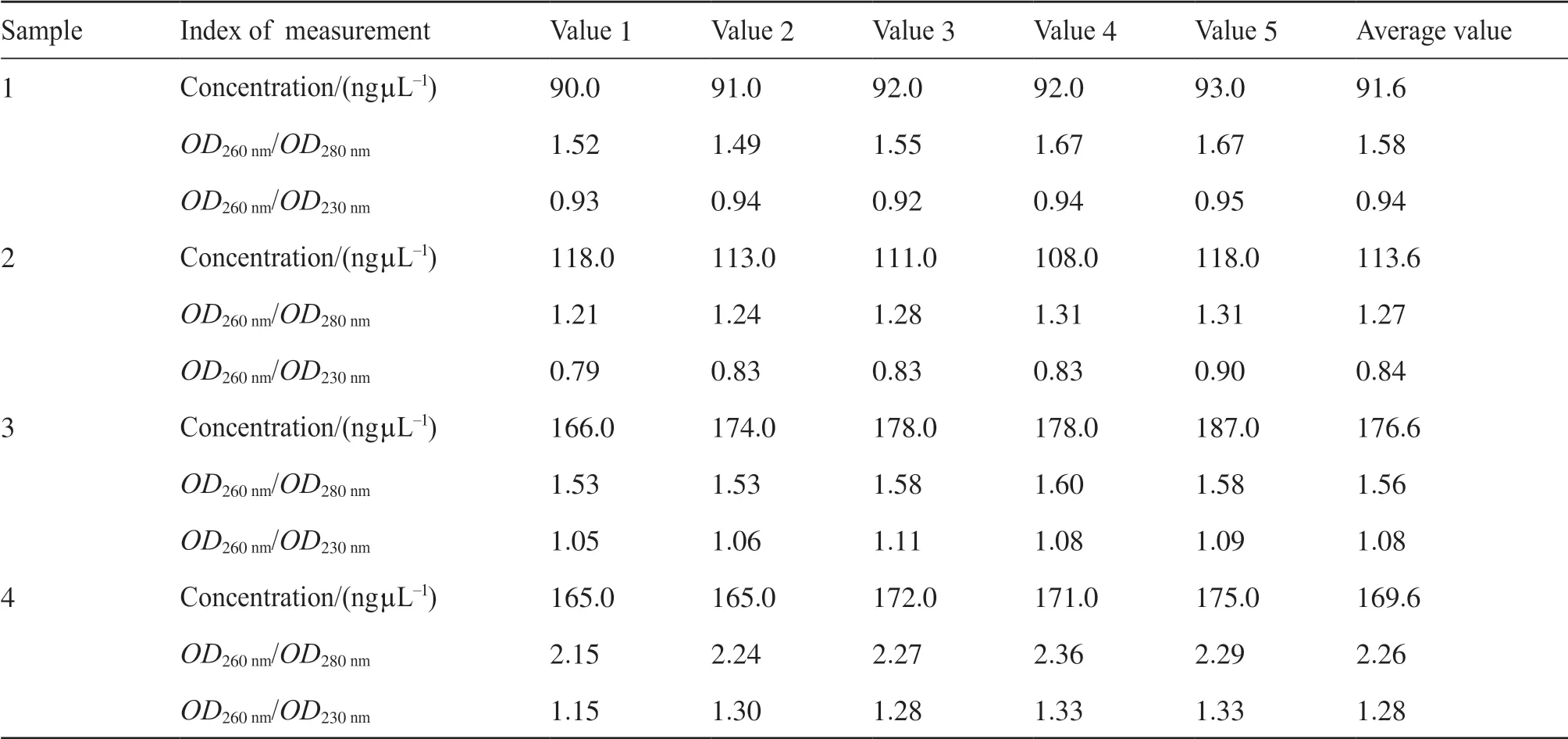
表1 分光光度计测量提取方法一所得基因组的数值Tab. 1 Spectrophotometry was used to measure the value of the genome obtained by extraction method 1

表2 分光光度计测量提取方法二所得基因组的数值Tab. 2 Spectrophotometry was used to measure the value of the genome obtained by extraction method 2
2.2 样本基因组DNA的琼脂糖凝胶电泳
为了直观地了解上述8份基因组DNA的提取效果,我们每份样本取1 μL(方法二提取的4号样本由于质量浓度较高,取0.5 μL),混入适量的DNA Loading Buffer进行琼脂糖凝胶电泳检测。结果显示,所有样本均有因甲醛长期保存导致的降解的Smear DNA带,这预示着基因组DNA提取成功,其中用改良的提取方法二得到的保存时间最短的4号样品的DNA 的亮度最高(图1)。

图1 基因组DNA的琼脂糖凝胶电泳Fig. 1 Agarose gel electrophoresis of genomic DNAMethod 1:使用提取方法一得到的基因组;Method 2:使用提取方法二得到的基因组;M:DNA marker;1:使用固定30个月的1号样本所提取的基因组DNA;2:使用固定24个月的2号样本所提取的基因组DNA;3:使用固定11个月的3号样本所提取的基因组DNA;4:使用固定5个月的4号样本所提取的基因组DNA。Method 1: Genome obtained by extraction method 1; Method 2: Genome obtained by extraction method 2; M: DNA marker; 1: Genomic DNA extracted from No. 1 sample fixed for 30 months; 2: Genomic DNA extracted from No. 2 sample fixed for 24 months; 3: Genomic DNA extracted from No. 3 sample fixed for 11 months; 4: Genomic DNA extracted from No. 4 sample fixed for 5 months.
2.3 PCR扩增产物的琼脂糖凝胶电泳
由于基因组DNA的后续使用大多依赖于PCR体外扩增,我们分别使用上述的8份基因组DNA各0.3 μL为模板,分别对来自人类GATA4、GAPDH、LRRC10三个基因,长度为175、327、674 bp的片段进行PCR扩增,并分别取5 μL PCR产物进行琼脂糖凝胶电泳。结果显示:两种方法所提取的所有DNA模板均能扩增出175 bp的GATA4基因片段;方法一所提取的4号DNA模板可以扩增出327 bp的GAPDH基因片段,而方法二所提取的4号DNA模板可以扩增出327 bp的GAPDH片段和674 bp的LRRC10基因片段,且产物质量浓度较高(图2)。这一结果证明,采用改良的专门用于甲醛溶液浸泡组织的基因组DNA提取方法提取出的基因组DNA的质量要明显优于传统方法。
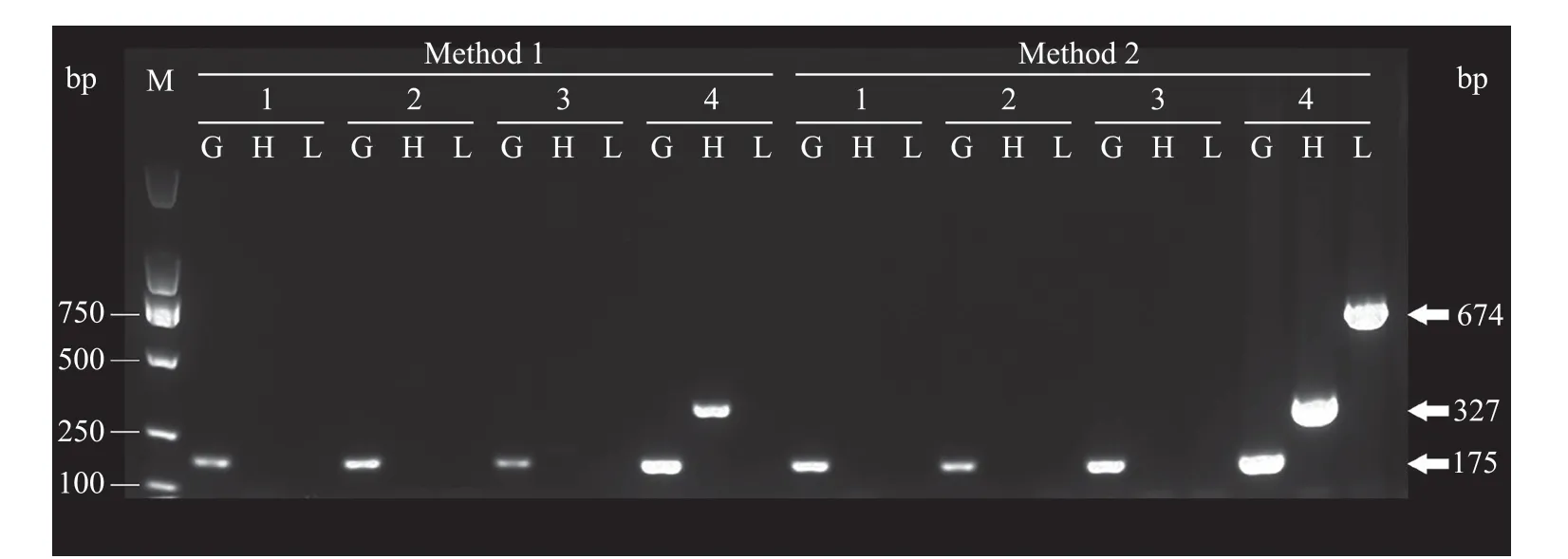
图2 以基因组 DNA 作为模板的PCR产物的琼脂糖凝胶电泳Fig. 2 Agarose gel electrophoresis of PCR products using genomic DNA as template每种PCR产物取5 μL点样。M:DNA Marker;Method 1:以提取方法一得到的基因组为模板的PCR产物;Method 2:以提取方法二得到的基因组为模板的PCR产物;1:1号样本基因组 DNA 为模板的 PCR 产物;2:2号样本基因组DNA为模板的PCR产物;3:3号样本基因组 DNA 为模板的 PCR 产物;4:4号样本基因组DNA为模板的PCR产物;G:目的条带为175 bp的GATA4片段产物;H:目的条带为327 bp的GAPDH片段产物;L:目的条带为674 bp的LRRC10片段产物。白色箭头所指为目的条带。5 μL samples were taken for each PCR product. M: DNA Marker; Method 1: PCR product using the genome obtained by extraction method 1 as template; Method 2: PCR products using the genome obtained by extraction method 2 as template; 1: PCR product of sample No. 1 genomic DNA as template; 2: PCR product of sample No. 2 genomic DNA as template; 3: PCR product of sample No. 3 genomic DNA as template; 4: PCR product of sample No. 4 genomic DNA as template product; G: The product of GATA4 fragment with 175 bp target band; H: The product of GPADH fragment with 327 bp target band; L: The product of LRRC10 fragment with 674 bp target band. The white arrow points to the target strip.
3 讨论
根据前人的研究,固定时间是影响福尔马林固定组织中DNA保存的主要因素[10]。我们的研究表明,随着福尔马林浸泡时间的延长,一定质量的组织中能够提取出的基因组DNA量出现明显的下降,这预示着对于福尔马林固定的样本的基因组DNA的提取和使用要尽早进行。经过尝试,使用核酸提取缓冲液和乙醇冲洗的方法清洗福尔马林浸泡样本中的甲醛,并使用蛋白酶K长时间消化,同时结合FFPE样本基因组提取试剂盒,可有效地从最长固定30个月的组织样本中提取出一定量的基因组DNA,且PCR体外扩增最高可扩增出长达674 bp的基因片段。与之相比,使用通用式的柱式基因组DNA提取试剂盒提取的1号、2号、4号的基因组DNA溶液的质量浓度均要低于改良方法,且2号样品和3号样品的OD260nm/OD280nm的数值明显低于改良方法,更加偏离纯净的基因组DNA的标准值(1.80)。这预示着这种通用提取试剂盒的提取产物存在更严重的蛋白质污染[11-13],而这很可能是甲醛浸泡导致的蛋白质-DNA交联造成的。除此之外,四种样品使用通用式基因组DNA提取试剂盒所得DNA的OD260nm/OD230nm的数值均小于我们的改进方法,而此值明显偏小时表明样品可能被糖类、盐类或有机溶剂污染[14]。以上结果证明,我们改进的基因组提取方法是有效且实用的,其PCR扩增效率明显优于传统方法。这可能是由于较长时间的乙醇浸泡致使样品中的大量甲醛被洗去,蛋白酶K的过夜反应消化掉了与DNA交联的蛋白质,以及裂解后的90℃高温水浴使之进一步解交联,从而使得循环扩增反应更顺利地进行。
然而,我们的方法还有许多可以改进之处,如可使用梯度乙醇洗涤更长时间[15-16]。使用酒精梯度置换法除去甲醛的原理是利用乙醇与甲醛之间反应生成半缩醛或缩醛,通过设置梯度乙醇浓度替换液不断置换出甲醛,从而更加有利于DNA的提取,而之后复水的过程主要是为了保护细胞结构的完整,此外,将90℃水浴处理提至蛋白酶K消化之前可以避免长时间消化对DNA的影响, 且节省蛋白酶K的用量[17]。这种福尔马林浸泡样本中提取的DNA还存在序列伪影[3,18],这给DNA测序后的序列比对设置了难题,导致我们无法判断测序结果与模板的不一致是来源于生物体遗传基因的改变还是甲醛的作用对样本DNA造成的破坏。有文献报导,与普通福尔马林相比,使用10%中性缓冲福尔马林可使组织稳定更长的时间,这种溶液也被用于尸检采样[19-20]。
