回收式自体输血联合白细胞滤器在小儿脑肿瘤切除术中的应用
2022-05-24张娜魏伟许新科陈程谢观土徐颖怡
张娜 魏伟 许新科 陈程 谢观土 徐颖怡
广州医科大学附属广州市妇女儿童医疗中心1麻醉与围术期科,2颅脑外科(广州 510623)
小儿脑肿瘤围术期输血较为普遍,但异体输血存在着诸多风险,如感染、过敏反应、溶血反应、输血相关急性肺损伤等[1],更可能会因削弱机体免疫监视系统反应而导致肿瘤复发率的增加和患者生存率的下降[2]。术中回收式自体输血(intraoperative cell salvage,ICS)是将患者术中出血经回收、过滤、洗涤处理后再回输给患者本人的一项技术。作为血液保护的一种重要方法,ICS 已经广泛地应用于各类儿科手术,可以有效地降低异体血输入量[3],避免输血相关的副作用[4],还具有血液质量好、血细胞比容高的优势[5]。但ICS 可能输入肿瘤细胞污染的血液,在恶性肿瘤中的应用一直存在争议。近年来,随着白细胞滤器(leukocyte depletion filter,LDF)的研发和使用,逐渐打破ICS应用于恶性肿瘤的禁忌。有研究认为ICS 联合LDF 可以清除回收血中的肿瘤细胞[6],但现阶段对于ICS 在恶性肿瘤中的应用研究,仍缺乏前瞻性的高质量临床证据。本研究通过分析脑肿瘤切除术患儿术中回收自体血中循环肿瘤细胞含量及回收式自体输血对预后的影响,初步探讨回收式自体输血联合白细胞滤器在小儿脑肿瘤术中应用的安全性,以期为此类患儿术中自体输血的应用提供新的理论依据。
1 对象与方法
1.1 研究对象 本研究为前瞻性队列研究,已获得广州市妇女儿童医疗中心伦理委员会批准。临床试验注册:中国临床试验注册中心(ChiCTR1900023764)。研究对象为2019年6月至2021年6月广州市妇女儿童医疗中心行脑肿瘤切除手术的患儿。纳入标准:(1)术前经病史及MRI 等明确诊断为肿瘤;(2)预期失血量达到患儿估计的最大血容量的15%以上。排除标准:(1)严重心功能不全或心衰、确诊血液系统疾病、凝血功能障碍者;(2)多发性肿瘤或脑肿瘤复发;(3)严重肾功能不全或需要进行血液透析治疗;(4)合并需要手术的其他颅脑疾病。(5)脓毒血症或败血症。
1.2 研究方法
1.2.1 分组方法 脑肿瘤患儿104 例,根据患儿家属是否同意使用回收式自体输血分为两组:自体输血组和异体输血组。其中异体输血组59 例,自体输血组中2 例因回收血液不够离心血量而未进行回输,最终入组43 例。两组间一般资料差异无统计学意义(P>0.05,表1)。
表1 两组一般资料的比较Tab.1 Comparison of general data between the two groups±s

表1 两组一般资料的比较Tab.1 Comparison of general data between the two groups±s
指标年龄(岁)体质量(kg)男[例(%)]ASA 分级[例(%)]Ⅱ[例(%)]Ⅲ[例(%)]异体输血组(n=59)3.3±1.6 14.4±6.2 32(54.2)22(37.3)37(62.7)自体输血组(n=43)3.2±2.2 13.9±5.5 28(65.1)15(34.9)28(65.1)t∕χ2值0.253 0.422 1.215 0.415 P 值0.400 0.337 0.270 0.678
1.2.2 麻醉方法 所有患儿均采用静吸复合全身麻醉,丙泊酚2 mg∕kg、舒芬太尼3 mg∕kg、顺式阿曲库铵0.2 mg∕kg,面罩吸氧手动辅助呼吸睫毛反射消失后行气管内插管,进行控制性机械通气。维持PCO2在35~45 mmHg 之间,新鲜氧浓度为40%,流量为1.5 L∕min,行桡动脉和颈内静脉穿刺置管。七氟醚2%~3%的浓度和丙泊酚2 mg∕(kg·min)进行麻醉维持,术中间断静注顺式阿曲库铵和舒芬太尼。维持平均动脉压(MBP)在50~60 mmHg。手术由同一组外科医生完成。
1.2.3 输血方法 参照中华医学会麻醉学分会制定的《小儿围术期液体和输血管理指南(2017版)》,通过血红蛋白浓度、失血量、血流动力学状态、尿量和凝血参数判断是否需要输血。异体输血组术中仅输注异体血。自体输血组术中优先输注回收的红细胞,如无法满足需求则考虑输注异体红细胞,同时补充异体血浆、冷沉淀和血小板。
1.2.4 血液回收和LDF 使用方法 使用德国索林XTRA 型自体血液回收分离机,患儿切皮时开始启动,回收打开硬脑膜前及关闭硬脑膜后的术野出血,取瘤期回收的血液不回输(急性大出血情况除外)。在将手术野出血吸引入储血罐的同时,通过双腔吸引管的注入管,将500 mL 盐水中加入15 000 UI 肝素,以20 滴∕min 的速度滴入吸血管道内并与回收的血液混合,产生抗凝作用。当回收血液达到500 mL 时,进行离心,分离,清洗,将浓缩的红细胞泵入血液袋内储存。患儿需要输注时通过LipiGuard SB 白细胞过滤器(美国唯美公司,LipiGuard SB)输入滤过后的回收红细胞,严禁使用加压输注,每滤过400 mL 血液后更换新的LDF。
1.2.5 血液标本检测方法 采集患儿手术前后颈内静脉、储血罐内、白细胞滤器滤过后血液5 mL,EDTA 抗凝管保存,利用循环肿瘤活细胞捕获仪(Nextctc,无锡,纳奥生物)进行循环肿瘤细胞(circulatingtumor cell,CTC)检测。判读标准:核内信号大于等于三倍体,细胞核DAPI染色阳性,CD45染色阴性为异常细胞;核内信号等于二倍体,细胞核DAPI染色阳性,CD45染色阴性为白细胞(图1)。

图1 CTC 检查结果对照图片Fig.1 Picture of CTC inspection results
1.2.6 观察指标 通过电子病历与麻醉信息系统,收集患儿临床资料。包括(1)基本情况:性别、年龄、体质量、ASA 分级、术前颅脑手术史;(2)手术及肿瘤情况:术前血红蛋白浓度、麻醉医师年限、手术时间、麻醉时间、术中出血量及输血量(包括红细胞、血浆、冷沉淀、血小板)、肿瘤部位(幕上或幕下)、最大直径、数量(单发或多发)、侵袭性、肿瘤组织学和肿瘤分级。根据患儿入院后进行的磁共振成像检查结果判断,幕上肿瘤包括大脑半球、第三脑室和侧脑室、鞍区及松果体区肿瘤,幕下肿瘤包括小脑、脑干和第四脑室肿瘤。肿瘤的侵袭性影像学表现为向邻近组织(如颅底、硬脑膜、蛛网膜、脑及脑干组织等)浸润生长。肿瘤分级参照第五版世界卫生组织(WHO)中枢神经系统(CNS)肿瘤分类标准,根据术后肿瘤组织病理检查结果进行WHO 分级。(3)预后情况:所有患儿均直接转入儿科重症监护病房(PICU)。记录术后并发症、机械通气时间、术后住院时间。术后凝血功能障碍定义为血小板计数<100×109∕L,活化部分凝血活酶时间>36 s。所有患儿随访6 个月,记录死亡率和复发率(通过复查MRI 或二次手术病理诊断确诊复发脑肿瘤)。
1.3 统计学方法 运用SPSS 15.0 统计软件,符合正态分布的计量资料使用()表示,组间比较采用t检验。计数资料用例(%)表示,组间比较采用Pearson χ2检验或Fisher 精确概率法。统计检验采用双尾检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组术中情况的比较 两组间术前血红蛋白含量、术前颅脑手术史、麻醉医师年限、肿瘤部位、肿瘤最大直径、肿瘤数量、侵袭性和肿瘤组织学差异无统计学意义(P>0.05,表2)。相较于异体输血组,自体输血组手术及麻醉时间更长,术中出血量更多(P<0.05),但两组术中异体红细胞、血浆和冷沉淀输注量差异无统计学意义(P>0.05,表2),两组患儿都未输注血小板。
表2 两组术前及术中情况的比较Tab.2 Comparison of preoperative and intraoperative conditions between the two groups ±s

表2 两组术前及术中情况的比较Tab.2 Comparison of preoperative and intraoperative conditions between the two groups ±s
注:*与异体输血组相比,*P <0.05
指标年龄(岁)体质量(kg)术前血红蛋白浓度(g∕L)肿瘤最大直径(cm)麻醉时间(min)手术时间(min)术中出血量(mL)输异体红细胞量(u)输异体血浆量(mL)输异体冷沉淀量(u)输自体红细胞量(mL)术前颅脑手术史[例(%)]麻醉医师年限≥5年[例(%)]肿瘤部位位于幕上[例(%)]肿瘤单发[例(%)]肿瘤有侵袭性[例(%)]肿瘤组织学胶质瘤[例(%)]髓母细胞瘤[例(%)]星形细胞肿瘤[例(%))原始神经外胚层肿瘤[例(%)]颅咽管瘤[例(%)]非典型畸胎样∕横纹肌样肿瘤[例(%)]胚胎发育不良性神经上皮瘤[例(%)]室管膜肿瘤[例(%)]WHO 分级[例(%)]Ⅰ级Ⅱ级Ⅲ级Ⅳ级异体输血组(n=59)3.3±1.6 14.4±6.2 115.4±20.0 4.4±1.8 365.7±86.0 261.5±75.5 377.2±614.3 2.8±2.7 247.8±240.2 0.1±0.5 0 6(10.2)43(72.9)39(66.1)47(79.7)8(13.6)12(20.3)7(11.9)6(10.2)8(13.6)5(8.5)4(6.8)6(10.2)11(18.6)18(30.5)15(25.4)6(10.2)20(33.9)自体输血组(n=43)3.2±2.2 13.9±5.5 118.5±15.6 4.9±2.2 398.7±105.2 316.2±106.2 647.2±848.8 3.2±3.0 318.6±320.4 0.2±0.6 60±50 5(11.6)34(79.1)22(51.2)38(88.4)2(4.7)5(11.6)8(18.6)6(14.0)5(11.6)4(9.3)3(7.0)4(9.3)8(18.6)11(25.6)9(20.9)6(14.0)17(39.5)t∕χ2值0.253 0.422 0.846 1.261 1.741 2.887 1.775 0.705 1.221 0.916-0.008 0.515 2.309 1.359 1.338 0.219 1.359 0.901 1.495 0.083 0.043 0.128 0.037<0.001 0.946 P 值0.400 0.337 0.200 0.106 0.043*0.003*0.040*0.241 0.113 0.181-0.929 0.473 0.129 0.244 0.245 0.827 0.244 0.343 0.222 0.773 0.835 0.721 0.848 0.996 0.814
2.2 自体输血组手术前后循环肿瘤细胞含量的比较 CTC检测分析显示,自体输血组血液标本中,术前颈内静脉的CTC数量为(1.5±1.2)个,储血罐内为(1.6±1.1)个,白细胞滤器滤过后为(1.5±1.3)个,术后颈内静脉的CTC 数量为(1.3±1.2)个,与术前颈内静脉血液相比,储血罐内、白细胞滤器滤过后和术后颈内静脉中CTC 数量差异无统计学意义(P>0.05,表3,图2)。
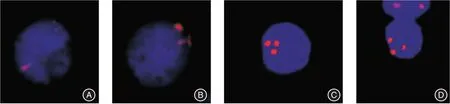
图2 CTC 检查结果图片Fig.2 Figures of CTC inspection results
表3 自体输血组手术前后CTC 数量的比较Tab.3 Comparison of CTC number before and after operation in autotransfusion group ±s,个

表3 自体输血组手术前后CTC 数量的比较Tab.3 Comparison of CTC number before and after operation in autotransfusion group ±s,个
注:*与术前颈内静脉血液相比,*P <0.05
时点术前颈内静脉储血罐内白细胞滤器滤过后术后颈内静脉CTC 个数1.5±1.2 1.6±1.1 1.5±1.3 1.3±1.2 t 值0.403<0.001 0.831 P 值0.344 0.500 0.204
2.3 两组术后恢复及复发情况的比较 两组患儿术后并发症发生率为48.0%(49∕102),其中感染29 例,包括肺部感染16 例,切口感染1 例,颅内感染12 例。其它并发症20 例,包括急性呼吸窘迫综合征1例,伤口延迟愈合等2例,血肿清除术1例,脑脊液引流4 例,昏迷1 例,血流动力学不稳定2 例,非计划性再次气管插管2 例,尿崩症4 例,凝血功能障碍3 例。5 例患儿因严重的术中大出血在术后三天内死亡,2 例因脑疝死亡,1 例术后并发严重肺部感染而无法撤机,家属放弃治疗。7 例MRI检查发现脑肿瘤复发。自体输血组术后并发症发生率与异体输血组无显著差异,而两组患儿在术后机械通气持续时间、术后住院时间、术后6 个月死亡率和复发率方面比较差异也无统计学意义(P>0.05,表4)。

表4 两组术后恢复及复发情况的比较Tab.4 Comparison of postoperative recovery and recurrence between the two groups 例(%)
3 讨论
小儿脑肿瘤手术由于病变位置深和操作难度大,失血量较多,OLIVIA 等[7]报道平均失血量为27.1 mL∕kg,而本研究也显示平均失血量在377.2~647.2 mL,如果能在此类手术中应用ICS,对保障患者的围术期安全,减少异体血的使用具有重要临床意义。然而要应用ICS 技术,就面临着一个关键问题:输入回收处理后的自体血是否会引起肿瘤转移或复发?当前,关于肿瘤复发及转移的机制并未明确,但多数学者认为CTC 在这其中起着关键作用。自发或因手术进入血循环的肿瘤细胞绝大多数在短期内死亡,只有极少数具有高度活力和转移潜能的CTC 在循环中存活下来,并在一定条件下发展为肿瘤病灶。生物标记物依赖的CTC 捕获技术容易导致假阴性结果,本研究采用非抗体依赖的纳米微流控捕获技术,能够最大限度捕获血液中上皮来源、间质来源以及干细胞来源的肿瘤细胞。CTC 检测分析显示,与术前颈内静脉血液相比,自体输血组储血罐内、白细胞滤器滤过后和术后颈内静脉血液中CTC 数量差异无统计学意义。由于大多数肿瘤患者的血液循环中本来就含有一定数量的肿瘤细胞,因此很难区分这些肿瘤细胞是由于手术操作脱落于回收血液中,还是本来就存在于循环中的肿瘤细胞,但此结果提示回输经LDF 滤过的红细胞不会引起CTC 的含量增加。LDF 以膜状滤材为结构基础,由多层编制状紧密堆积的小孔径微纤维网制成,可以物理拦截和电荷吸附清除有核细胞。赵丽云等[8]将含有胃肠肿瘤细胞的血液经LDF 滤过后进行组织培养,未发现有肿瘤细胞生长,KUMAR 等[9]检测经过LDF 滤过的自体血,也未发现存活的肿瘤细胞。还有研究认为,经LDF 滤过的回收血中肿瘤细胞远低于患者自身血液循环中已经存在的肿瘤细胞,且可能已经失去了复制能力[10],因此,LDF的出现使ICS 技术在恶性肿瘤中的应用成为可能。
本研究发现,自体输血组与异体输血组在术后6 个月死亡率和复发率方面比较差异无统计学意义。肿瘤组织病理类型和WHO 分级是影响肿瘤复发的最重要因素,鉴于两组患儿在这两方面都没有差异,表明自体血与LDF 联合应用于小儿脑肿瘤手术不会增加肿瘤复发几率。既往已有回顾性研究发现,在包括肝胆外科肿瘤[11]、泌尿外科肿瘤[12-13]和脊柱转移癌[14]等多种类型的手术中,并没有证据表明肿瘤患者手术使用回收式自体输血会增加肿瘤的转移和复发。SIKORSKI 等[15]认为LDF 联合回收式自体输血可以应用于肿瘤患者,2008年英国国家卫生与临床优化研究所就已批准在前列腺癌根治术及根治性膀胱癌切除术中可以联合使用自体血与LDF 技术。此外,本研究还发现两组患儿术后感染及凝血功能障碍发生率无显著差异。由于回输血中绝大部分为红细胞,几乎没有凝血因子和血小板,既往认为自体输血会影响机体凝血功能,术后凝血功能障碍发生率可能增加,但现在认为这种影响是短暂的,甚至回输血量在一定范围内时对凝血功能并无明显影响[16]。GUO 等[17]还研究证实自体输血与异体输血不同,对肿瘤患者免疫功能无明显抑制作用,因此不会增加术后感染等并发症的发生。其原因可能有以下几个方面:(1)自体血的血液新鲜,不会因低温保存造成细胞损伤而产生免疫抑制[18]。(2)IL-8降低和IL-10 水平增加是异体输血引起免疫抑制的两个重要原因,但自体输血可以减轻这种作用,同时增加TNF-α 的水平,从而加强机体抗肿瘤抗感染免疫能力[19]。(3)长期存储的血制品产生大量生物活性因子,其中的很多物质都会抑制免疫功能,而自体血无需存储,不会导致生长因子的释放而促进肿瘤的生长[20]。
在本研究中,可能由于手术操作难度的原因,相较于异体输血组,自体输血组手术及麻醉时间更长,术中出血量也更多(P<0.05),但两组患儿异体红细胞的输注量差异并无统计学意义(P>0.05),这表明尽管出血量增多,但自体血的输注减少了异体红细胞输注量,因此,既然脑肿瘤切除手术患儿不可避免会输血,那么回收式自体输血对减少异体输血是一个不错的选择。
应用ICS 联合LDF 技术时需注意以下两个方面:首先,由于LDF 在滤过肿瘤细胞和白细胞时存在竞争关系,如果总的有核细胞数超过LDF 的滤除能力,将可能残余肿瘤细胞,因此在使用中要严格遵照说明书的推荐滤过量和滤过速度;其次,自体血经LDF 滤过后回输可能引起低血压性输血反应,在回输过程中要严密监测患者生命体征。
本研究的局限性在于这项研究是单中心的,且术后随访时间较短,后期可进行多中心联合研究,并延长随访时间,以进一步验证相关结论的准确性。
综上所述,通过回收技术及白细胞滤器处理的自体血中CTC 数量不会增加,在小儿脑肿瘤切除术中应用自体血回收联合白细胞滤器技术对术后肿瘤复发率及预后影响不明显,回收式自体输血在此类手术应用的可行性为节约临床用血提供了一种新的思路。
