半夏曲发酵机制及主要优势真菌的发酵功能研究
2022-05-24余金洪
舒 波,余金洪,王 涛*
半夏曲发酵机制及主要优势真菌的发酵功能研究
舒 波1,余金洪2,王 涛2*
1.川北医学院附属医院药剂科,四川南充 637000 2.固态发酵资源利用四川省重点实验室,宜宾学院,四川宜宾 644000
探讨半夏曲的自然固态发酵机制。采用免培养、纯培养相结合的方法研究半夏曲发酵真菌和细菌区系构成及主要代谢功能,针对分离到的主要优势真菌的纯培养菌株,分别采用碘量法及分光光度法检测其产淀粉酶及蛋白酶情况,采用显微镜观察菌株对草酸钙结晶的破坏情况。半夏曲发酵过程中检测到丝衣孢霉、根霉、曲霉、米勒酵母、假单胞菌、芽孢杆菌等属微生物。半夏曲发酵过程中真菌数量大幅增殖,前期及末期的真菌多样性远远高于发酵旺盛期,发酵40~64 h期间的样品与其他样品的真菌区系构成存在极显著差异(<0.01)。丝衣孢霉属是唯一参与了整个半夏曲发酵过程的优势真菌,对米勒酵母、根毛霉、曲霉的生长具有明显抑制作用。细菌的数量及多样性均低于真菌,且其数量在半夏曲发酵过程中没有明显增长。微生物群落功能预测(phylogenetic investigation of communities by reconstruction of unobserved states,PICRUS)分析表明半夏曲发酵过程中的真菌与氨基酸代谢、糖代谢及核苷酸合成代谢密切相关。真菌菌株发酵实验证实,丝衣孢霉属真菌与α-淀粉酶的生成及草酸钙针晶破损有关。细菌不是半夏曲发酵过程中的主要功能微生物,丝衣孢霉是半夏曲发酵过程中的主要优势功能微生物,与半夏曲的淀粉酶活性和与刺激性降低密切相关。
半夏曲;发酵机制;真菌;丝衣孢霉;发酵功能;固态发酵;碘量法;淀粉酶;蛋白酶;草酸钙;根霉;曲霉;米勒酵母;假单胞菌;芽孢杆菌;氨基酸代谢;糖代谢;核苷酸合成代谢
半夏是天南星科半夏属植物半夏(Thunb.) Breit.的干燥块茎,盛产于四川地区,炮制后可用于消肿、燥湿化痰、降逆止呕等,其炮制品半夏曲是多种中成药的原料之一。半夏经发酵后能有效缓和半夏药性,减少舌头刺痛、喉咙肿痛等毒副作用,同时还能增强降逆止呕、镇咳平喘等功效[1]。半夏曲发酵采用六神曲强化接种的自然发酵工艺,参与发酵的微生物主要来自六神曲、半夏原料及发酵环境,半夏曲发酵微生物菌群结构差异,是导致半夏曲质量差异的重要因素[2]。研究表明,半夏曲发酵过程中的细菌主要为芽孢杆菌属、单胞菌属等,真菌主要有宛氏拟青霉、丝衣霉菌、酿酒酵母、浅白隐球酵母等[3],其中宛氏拟青霉及丝衣霉菌具有产黄色素的能力[4],但这些微生物在发酵过程中的主要作用机制仍不清楚,基于此,本研究针对半夏曲发酵过程中的微生物区系,研究其多样性、变化趋势及主要功能,为阐明半夏曲发酵机制提供支撑。
1 仪器与材料
1.1 仪器
UV2800型紫外光分光光度计,北京普析通用仪器有限公司;SJ-2D型超净工作台,苏净安泰空气技术有限公司;LRH-70型真菌培养箱,上海一恒科学仪器有限公司;HH-4型恒温水浴锅,上海力辰邦西仪器科技有限公司;MSDDR701型显微镜,迈时迪科技有限公司;T100型PCR仪,美国BIO-RAD公司;SU8020型电子显微镜,日本日立高新技术公司;FA2004型电子天平,上海舜宇恒平科学仪器有限公司。
1.2 材料
清半夏饮片,四川新荷花中药饮片股份有限公司,批号D2103058,经南充市食品药品检验所雷果平副主任中药师鉴定,为来源于天南星科半夏属植物半夏(Thunb.) Breit.的块茎切片经硫酸铝钾(白矾)溶液浸泡所得的炮制品;白矾,四川新荷花中药饮片股份有限公司,批号2012157;六神曲,四川千方中药股份有限公司,批号22102104;马铃薯琼脂培养基、营养琼脂培养基,青岛海博生物技术有限公司;Fast DNATMSpin Kit for Soil试剂盒,天根生化科技有限公司;福林酚试剂,上海国药化学试剂有限公司,分析纯;-酪氨酸,天津科密欧化学试剂有限公司,质量分数≥98%;葡萄糖,天津致远化学试剂有限公司,分析纯。
2 方法
2.1 样品采集
于四川雅安迅康药业有限公司发酵车间内,按清半夏、生姜汁、白矾、面粉、六神曲以32∶4∶2∶6.4∶1的配比混合均匀后平铺在托盘上,料层厚度3 cm左右,然后入室发酵,发酵温度为35~37℃,湿度为80%~85%,发酵72 h,分别于发酵0、16.5、25、40.5、48、64.5、72 h及干燥后采用无菌取样方法取半夏曲样品(分别编号P0h、P16h、P24h、P40h、P48h、P64h、P72h、Pdry)及辅料六神曲(编号ML)共9个样品,粉碎过100目筛备用。
2.2 细菌、真菌区系组成研究
按照Fast DNATMSpin Kit for Soil试剂盒说明书提供的方法提取样品总DNA,电泳合格后送基因测序公司扩增其ITS1、ITS4[5-6]及16S rDNA[7]序列,过滤尾部质量值20以下的碱基及质控后50 bp以下的序列,再拼接,按最大错配比率0.2筛选不符合序列,对优化后的序列提取非重复序列,利用Usearch(vsesion 7.1)软件平台(http://drive5.com/ uparse/),将相似性在97%以上的非重复序列(不含单序列)划为1个操作分类单位(operational taxonomic units,OTU)并聚类,在聚类过程中去除嵌合体,得到OTU的代表序列;将测序获得的所有OTU与Genbank(https://www.ncbi.nlm.nih.gov/)中的模式菌株对应序列比对,获取OTU前20种优势物种对应的分类单元(包括门纲目科属种)及其相应的丰度信息[8-10],对丰度排名前20的种属构建关联网络,将测序得到的微生物组成映射到数据库中,使用PICRUSt软件(https://picrust.github.io/ picrust)对六神曲和半夏曲中的细菌及真菌的基因功能进行预测[11-12],并参照基因功能数据库京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)进行注释。
2.3 细菌、真菌的计数
称取5 g样品粉末于盛有45 mL无菌水的锥形瓶中混匀,制成1∶10的稀释液;用无菌吸管吸取5 mL稀释液于新的盛有45 mL无菌水的锥形瓶中,制成1∶100的稀释液;重复此操作,依次得到稀释梯度为1∶1000、1∶10 000、1∶100 000、1∶1 000 000的稀释液。分别取稀释梯度为1∶10 000、1∶100 000、1∶1 000 000的稀释液1 mL,涂布到马铃薯琼脂培养基,30 ℃培养2~3 d后计数,每个稀释度做3个重复。细菌的培养计数采用营养琼脂培养基37 ℃培养24 h后计数,每个稀释度做3个重复。
2.4 优势真菌的分离鉴定
挑取马铃薯琼脂培养基上长势良好、无污染的单菌落,采用平板划线法纯化,3次纯化后,在薄层(厚度不超过3 mm)马铃薯琼脂培养基中培养至长出菌丝,于倒置显微镜下直接观察培养皿中的菌丝生长形态。
2.5 优势真菌产酶特性研究
针对发酵过程样品,测定半夏曲在发酵过程中的α-淀粉酶和蛋白酶活力变化趋势;针对接种真菌纯培养菌株发酵72 h后的半夏曲及对照(接种六神曲自然发酵的半夏曲),测定其α-淀粉酶和蛋白酶活力。α-淀粉酶和蛋白酶活力分别采用碘量法及分光光度法测定[13]。
2.6 优势真菌减毒作用研究
清半夏、生姜汁、白矾、面粉按80∶10∶5∶16比例混合均匀后,分装入500 mL三角瓶,每瓶装量100 g,121 ℃灭菌20 min后分别接种丝衣孢霉、宛氏拟青霉28 ℃发酵64 h,以接种六神曲发酵的半夏曲为对照,在光学显微镜(150倍)和电子显微镜(1000倍)下观察发酵后半夏曲中的草酸钙针晶状态。
3 结果与分析
3.1 半夏曲发酵过程中真菌区系变化趋势
从表1可以看出,总体上,半夏发酵过程中检测到的真菌种属较少,发酵前期反映物种丰富度的Chao1指数最高,发酵0~24 h期间检测到的OTU数量最多,也不超过140个OTU,发酵40 h后,仅检测到3个真菌OTU,而序列条数大幅增加,即真菌种属减少,数量增加,表明从发酵40 h开始,一些优势真菌逐渐取得群体优势,并抑制其他真菌的生长,直至发酵结束其生长减弱后其他真菌又开始生长。Shannon指数和Simpson指数主要反映物种多样性及分布均匀性,可以看出,发酵前期(0~40 h)及后期(64~72 h)真菌多样性均远高于发酵中期(40~64 h),这表明半夏曲的发酵过程实际上也是对半夏曲中真菌菌群的选择驯化过程,仅有3个OTU的真菌在发酵旺盛期产生作用,1个OTU的真菌全程参与发酵。
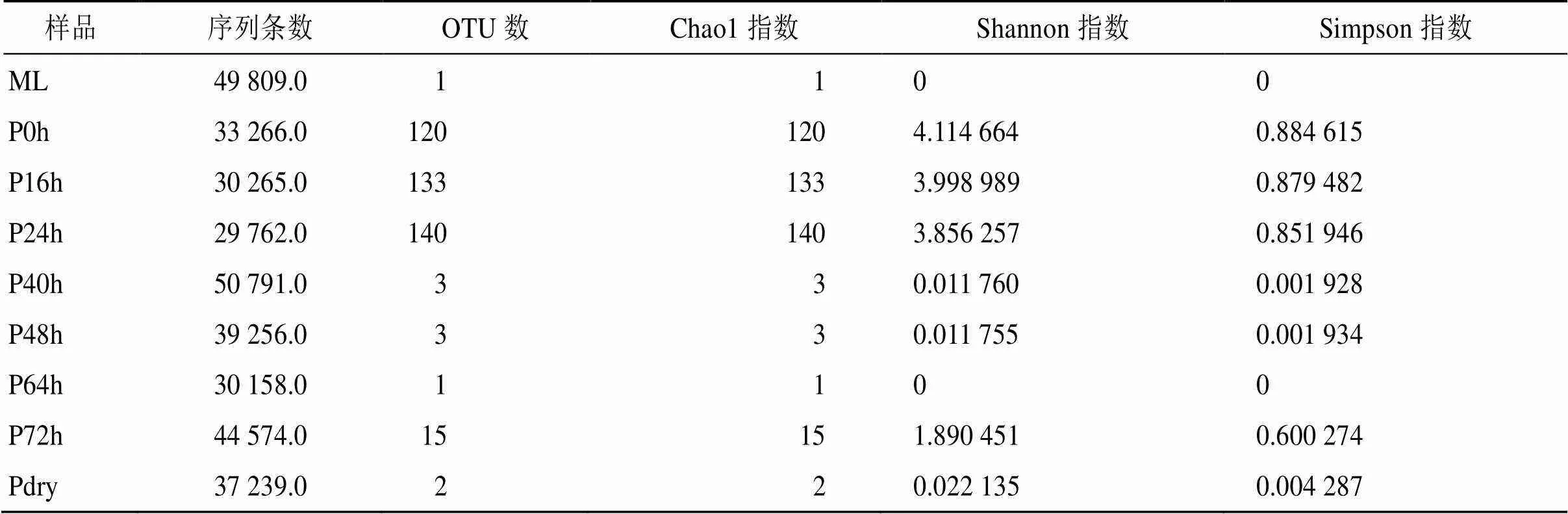
表1 半夏曲发酵过程中真菌区系多样性变化趋势
进一步采用基于UniFrac距离群的加权(weighted)和非加权(unweighted)分析热图对半夏曲霉菌类群的β多样性[14]进行了分析,发现半夏曲发酵过程中真菌区系组成及各种属的丰度差异非常明显,发酵前期和发酵末期半夏曲中的真菌区系构成没有显著差异(>0.05),发酵40~64 h期间半夏曲中的真菌区系与发酵前期的差异达到极显著(<0.01),如图1所示。尽管发酵40~64 h期间半夏曲中的真菌种属数量远少于发酵前期及末期(表1),但从平板计数结果来看(图5),这一阶段真菌数量急剧上升,最高达到4×106CFU/g,推测此时增殖的真菌主要是一些对半夏曲发酵环境适应良好的种属,可能对半夏曲发酵有重要影响。
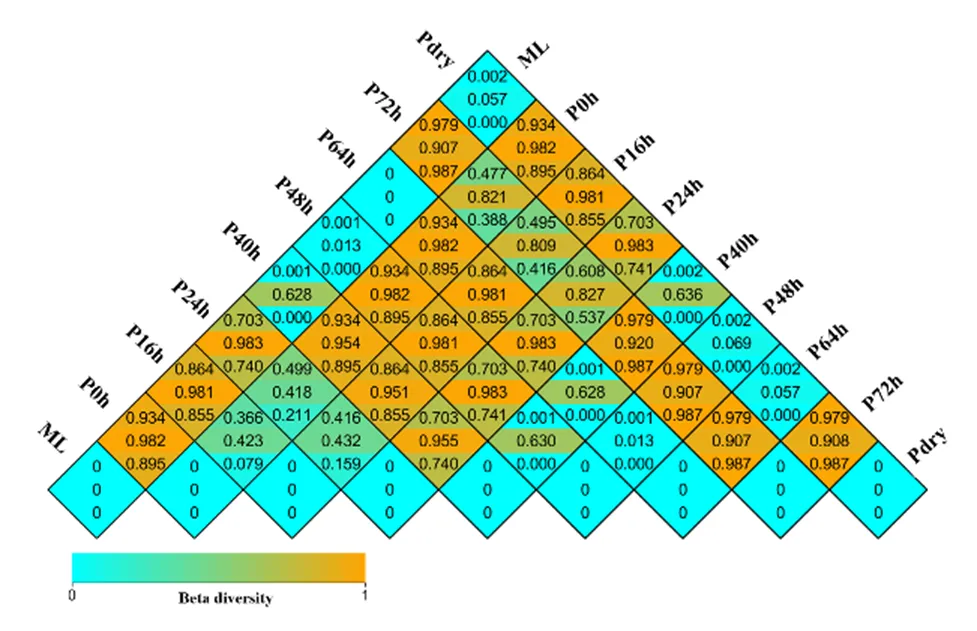
方格内数字从上到下分别代表加权指数、非加权指数及差异显著性
图2展示了半夏曲发酵过程中真菌区系构成及各真菌种属的丰度变化趋势,可以看出,仅有丝衣孢霉菌同时在六神曲和半夏曲发酵过程中被检测到,推测该真菌可能是经由六神曲接种到发酵基质。丝衣孢霉菌全程参与了半夏曲发酵,其平均丰度达61.3%,特别是在发酵40~64 h期间该属真菌丰度接近100%,表明丝衣孢霉菌是半夏发酵过程中的核心真菌。
除此之外,半夏曲发酵体系中丰度大于>1%的真菌还有根毛霉、链格孢霉、根霉、曲霉等属,但这些属在六神曲中的丰度很低,推测其主要来自环境,且这些真菌在半夏曲发酵24 h后随着丝衣孢霉逐渐取得生长优势而趋于消亡,至发酵72 h时仅有根毛霉、根霉属真菌的丰度有所回升。

图2 六神曲及不同发酵阶段半夏曲中的真菌区系构成(A、B、C分别为样品分组编号)
3.2 半夏曲发酵过程中细菌区系变化趋势
从细菌区系组成来看,半夏曲不同发酵阶段的细菌区系差异显著(<0.05),但优势种属丰度相对稳定(图3)。发酵过程中假单胞菌的丰度在48~64 h期间超过70%,发酵完成干燥后的半夏曲中假单胞菌的丰度更是高达80%,且该细菌在六神曲中的丰度也高于80%,表明该细菌可能来自六神曲并对半夏曲发酵机制适应良好,同时,芽孢杆菌在半夏曲发酵过程中的平均丰度超过30%,特别是在发酵72 h时丰度超过80%(图4),表明假单胞菌和芽孢杆菌是半夏曲发酵过程中的主要优势细菌属。
3.3 半夏曲发酵过程中真菌、细菌数量变化趋势
图5展示了半夏曲发酵过程中真菌、细菌数量变化趋势,可以看出,半夏曲发酵过程中其细菌、真菌的数量变化趋势不同,发酵前期半夏曲内细菌较多,其数量超过1×106CFU/g,经过24 h的适应期后半夏曲中的细菌数量大幅下降,直至发酵结束均维持在较低水平,这可能是由于半夏、生姜等原料抑制了多种属细菌的生长,仅有芽孢杆菌、假单胞菌等少数细菌可在半夏曲中存活,但也没有明显增殖,推测细菌不是半夏曲发酵的主要功能微生物。真菌数量在发酵49 h后急剧上升,到64.5 h时数量达到顶峰(4.0×106CFU/g),随后略有下降,这说明了在半夏曲发酵过程中真菌有明显增殖,推测真菌在半夏曲发酵过程中起主要作用。
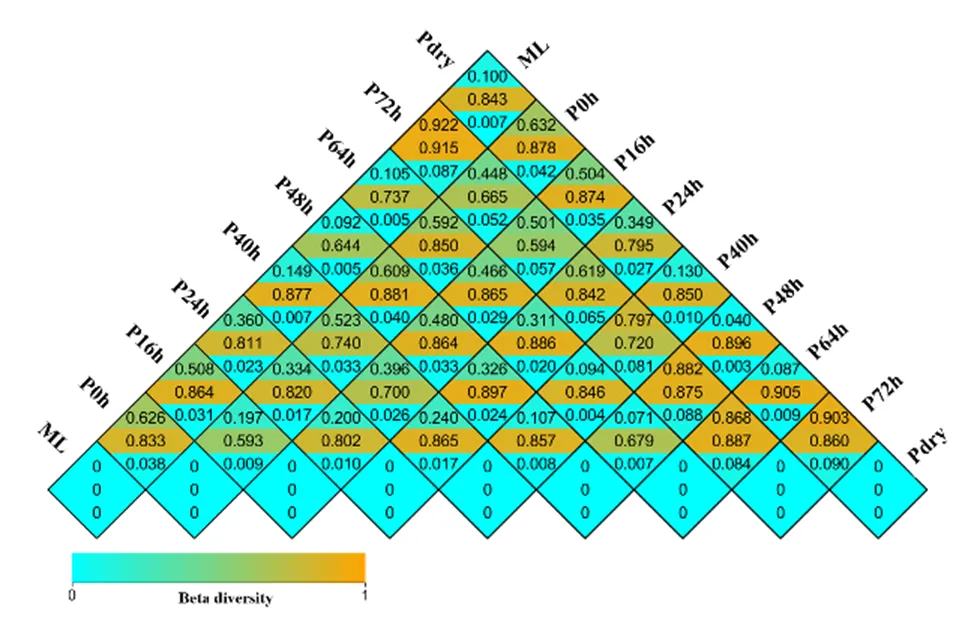
方格内数字从上到下分别代表加权指数,非加权指数及差异显著性
3.4 半夏曲发酵过程中优势真菌的分离鉴定
通过培养法分离不同发酵阶段半夏曲中的真菌,在发酵49~64 h的样品中共分离到4株丝状真菌,参考《真菌鉴定手册》[15],将这些真菌初步鉴定到丝衣孢霉属、宛氏拟青霉属、根毛霉属及黑曲霉属,图6展示了3株分属于丝衣孢霉属、宛氏拟青霉属、根毛霉属的真菌菌落及菌丝形态。可以看出,丝衣孢霉菌落白色致密,孢子梗短小发达,有孢子囊;宛氏拟青霉菌落黄色,菌丝放射状分布,椭圆形分生孢子呈串珠状;根毛霉菌落呈白色絮状,菌丝单一,无梗,顶端生孢子囊。
3.5 半夏曲发酵过程中真菌功能分析
图7揭示了半夏曲发酵过程中各种属真菌的互作关系,图中红色表示相互促进,蓝色表示相互抑制,圆圈大小代表该属真菌丰度。可以看出,半夏曲发酵过程中检测到的真菌以子囊真菌为主,其中丰度最高的丝衣霉属与其他真菌的相互作用最少,且主要体现为对其他真菌如米勒酵母、根毛霉、曲霉的抑制作用;米勒酵母与根毛霉、曲霉存在相互促进作用;镰孢霉与其他真菌的相互作用最广泛,可促进米根霉、链格孢霉、曲霉、青霉、米勒酵母的生长。这表明在半夏曲发酵过程中,丝衣霉属通过抑制其他优势种属取得生态优势,而相对弱势的其他属真菌则倾向于依赖相互之间的促进作用维持生态稳定。
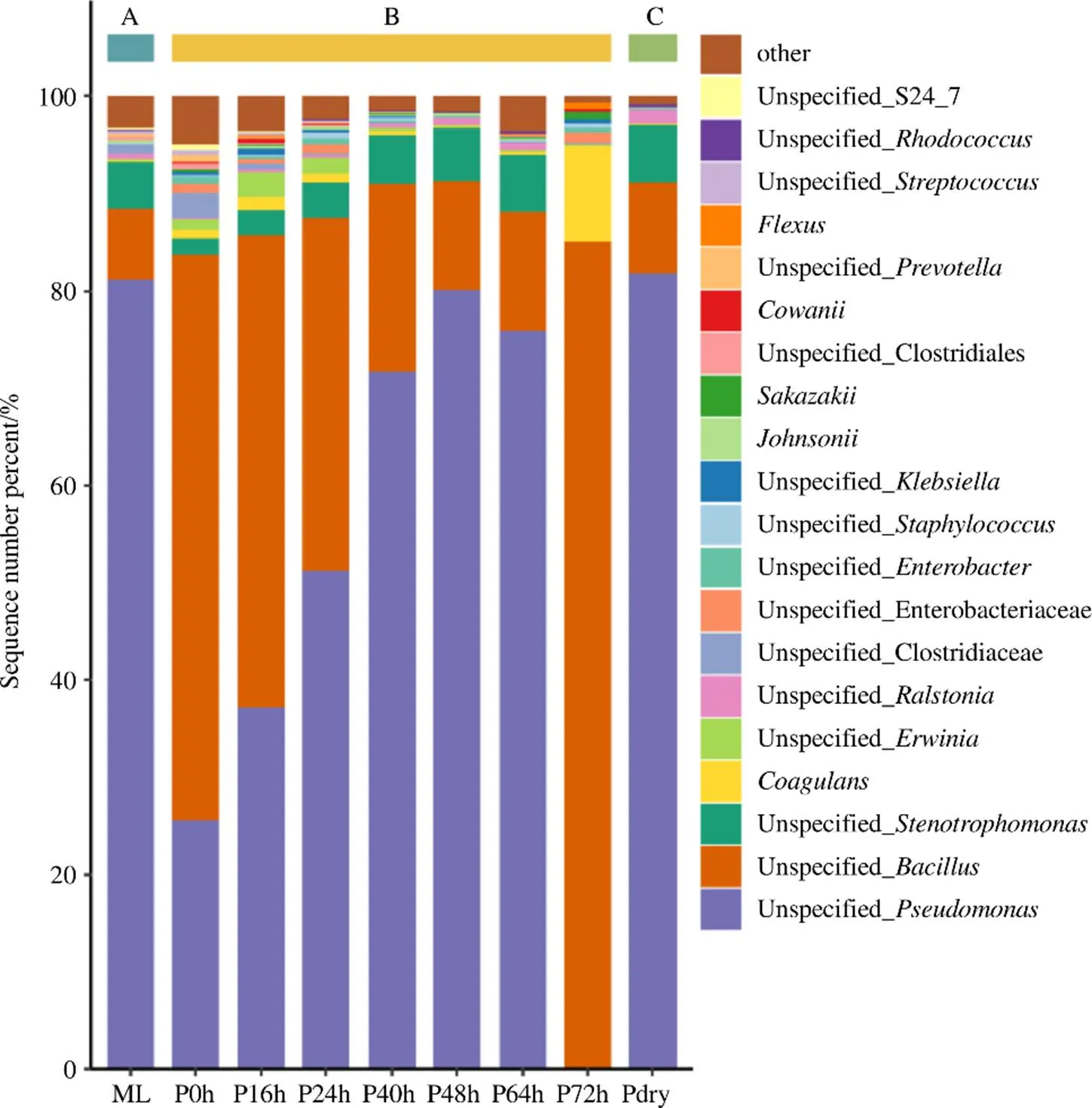
图4 六神曲及半夏曲发酵过程中细菌区系构成(A、B、C分别为样品分组编号)
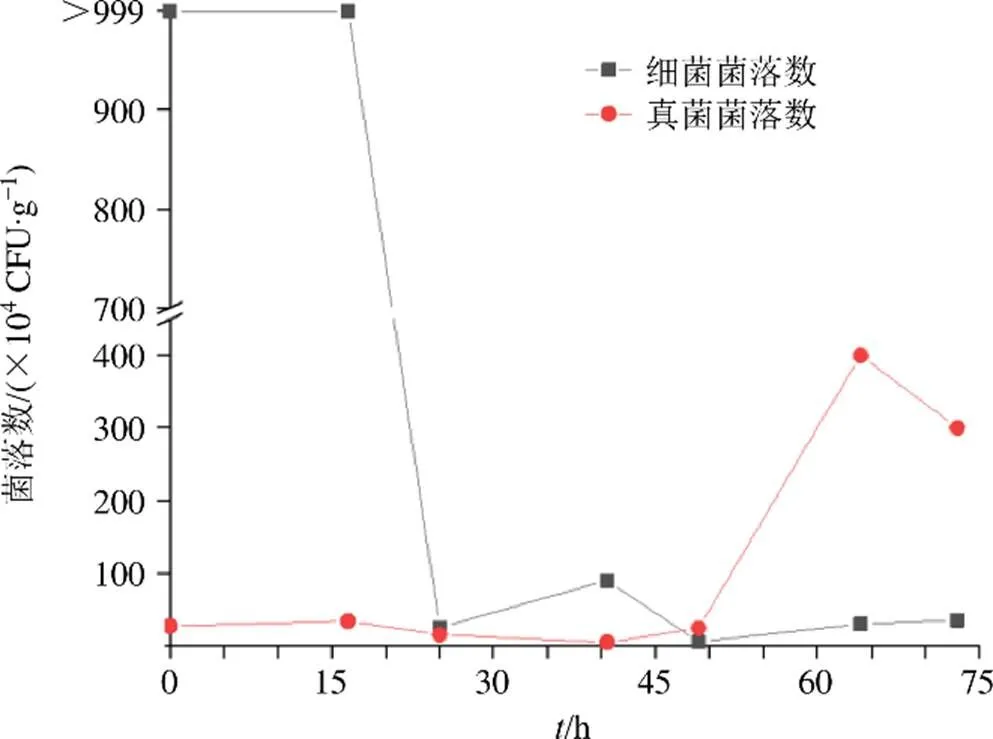
图5 半夏曲发酵过程中细菌与真菌的数量变化趋势
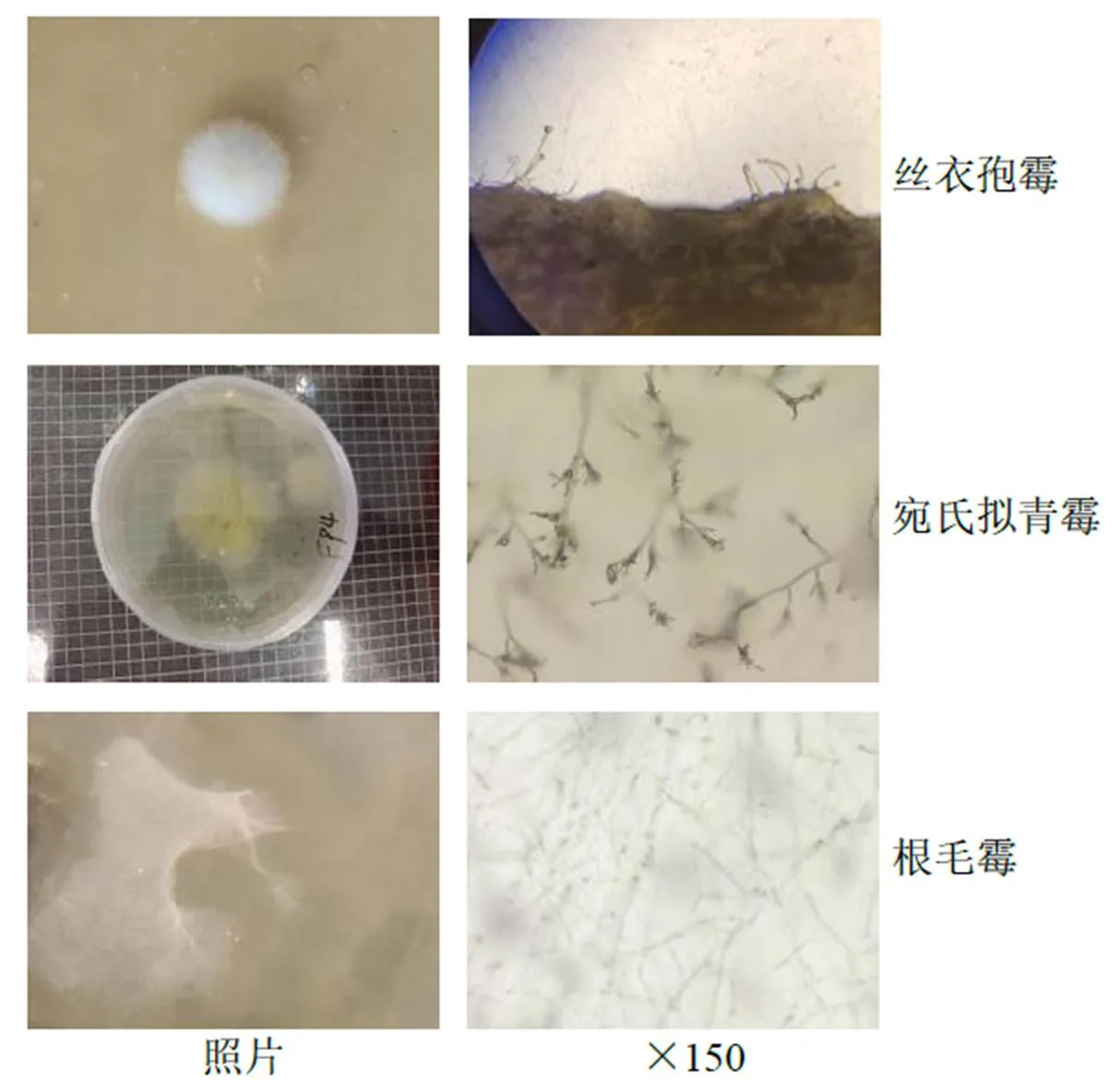
图6 优势真菌的菌落及培养基内的菌丝形态
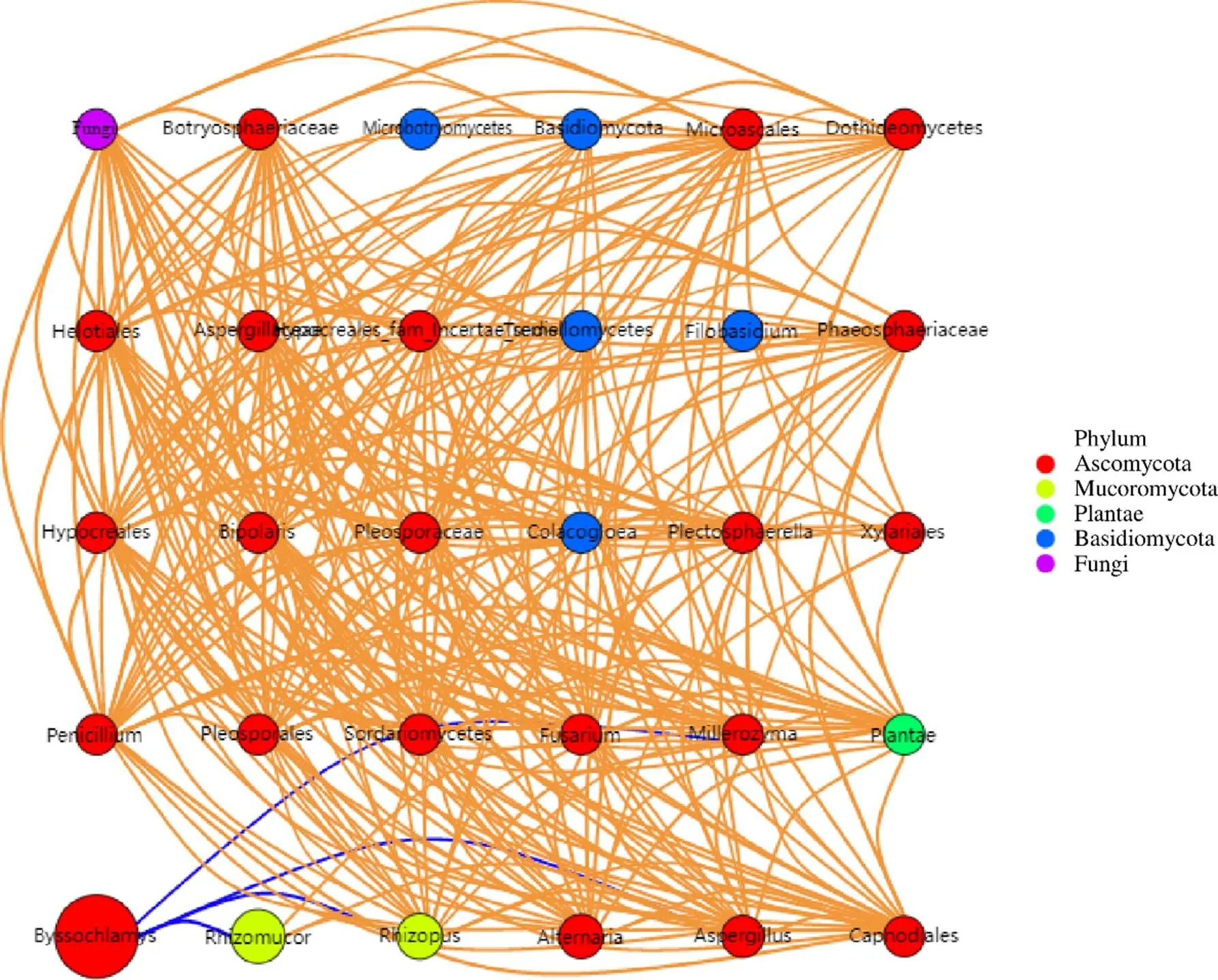
图7 半夏曲发酵过程中真菌属水平相互作用网络
图8-a展示了半夏曲发酵过程中的微生物代谢以氨基酸代谢、碳水化合物代谢为主,其次为维生素代谢、脂质代谢等,微生物外源化合物的降解代谢能力从发酵前期至中后期,由增强到稳定再下降,但其他方面的代谢强度,差异性不显著(>0.05),说明半夏曲中存在某种降解能力强的优势微生物。图8-b显示脂肪酸及甘露糖代谢强度随发酵深度不同而存在差异,从发酵40 h开始,甘露糖的合成代谢及大分子物质的降解代谢趋于活跃,而脂肪酸代谢却逐渐变弱,表明微生物在发酵中期大量降解含糖化合物为发酵后期的脂肪酸代谢合成脂质物质做铺垫,而这又与优势菌属的酶活力有密切关系。
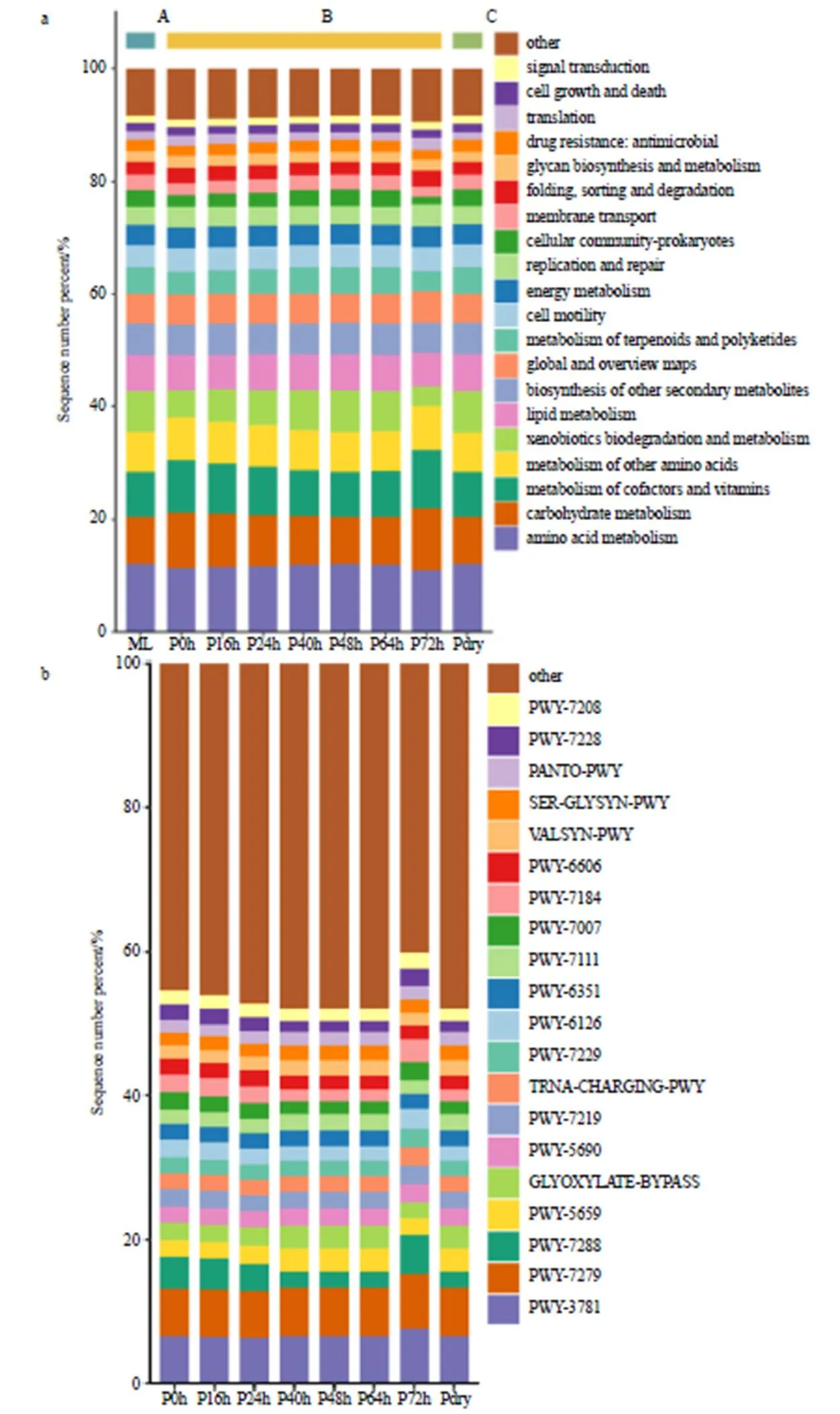
图8 半夏曲发酵过程中真菌区系代谢功能预测
图9展示了半夏曲自然发酵过程中蛋白酶、α-淀粉酶活力及真菌、细菌数量变化趋势。可以看出,半夏曲中α-淀粉酶活力与真菌数量变化趋势高度相关,与细菌数量变化关系不大;蛋白酶活力与真菌、细菌数量变化关系均不明显,表明真菌可提升半夏曲的促消化功能,这也进一步证实,半夏曲发酵过程中的功能微生物以真菌为主。
3.6 优势真菌发酵功能验证
将分离纯化的优势真菌及细菌纯培养物单独或组合发酵清半夏,以接种六神曲发酵的清半夏为对照,分析各种属微生物对半夏曲酶活力的影响。从表2中可以看出,纯菌发酵的淀粉酶、蛋白酶活性高于混菌发酵,表明各种属菌株在产淀粉酶及蛋白酶方面可能存在不同程度的相互作用,如丝衣孢霉与根毛霉属组合在发酵中后期的淀粉酶活性均低于对照,表明这2种微生物相互之间存在明显的产淀粉酶相互抑制作用,从其他组合中也可看出,酵母可减少丝衣孢霉与根毛霉在产淀粉酶方面的相互抑制。比较各处理的α-淀粉酶活力,可以看出,接种枯草芽孢杆菌的处理在发酵90 h时淀粉酶活力达到最高,其次是宛氏拟青霉、丝衣孢霉,但发酵到120 h时,各处理的淀粉酶活力均大幅下降,这可能是由于发酵后期积累的有机酸抑制了淀粉酶活力;比较各处理蛋白酶活性,可以发现接种丝衣孢霉的清半夏蛋白酶活力在发酵48 h时达到最高,为对照的336%。上述结果表明,接种丝衣孢霉发酵的半夏曲可以获得最大的α-淀粉酶活性及蛋白酶活性,如主要以α-淀粉酶活性作为质量监控指标,发酵时间以90 h为宜,如主要以蛋白酶活性作为质量监控指标,发酵时间以48 h或90 h为宜。
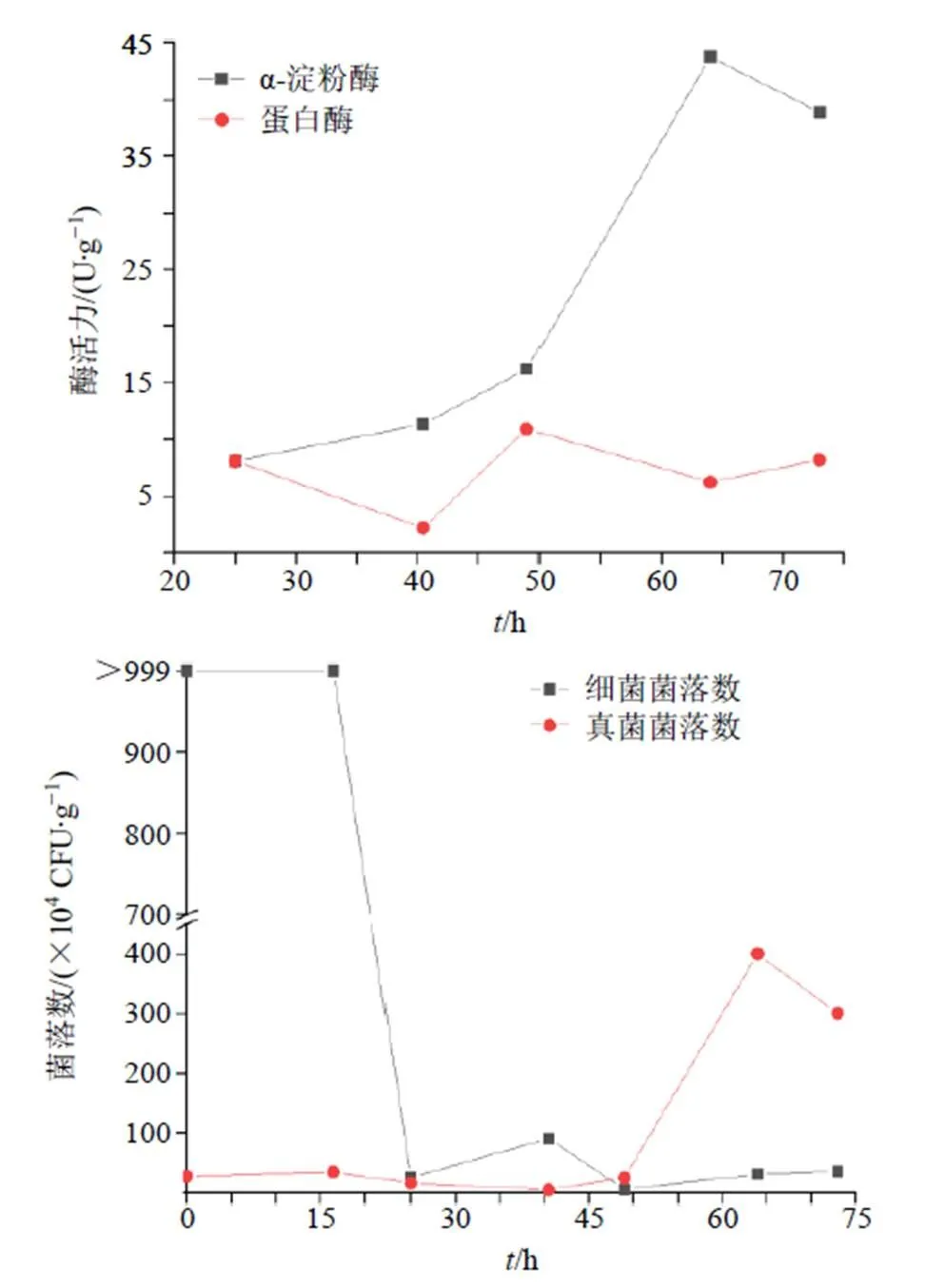
图9 半夏曲发酵过程中微生物数量及酶活力变化趋势
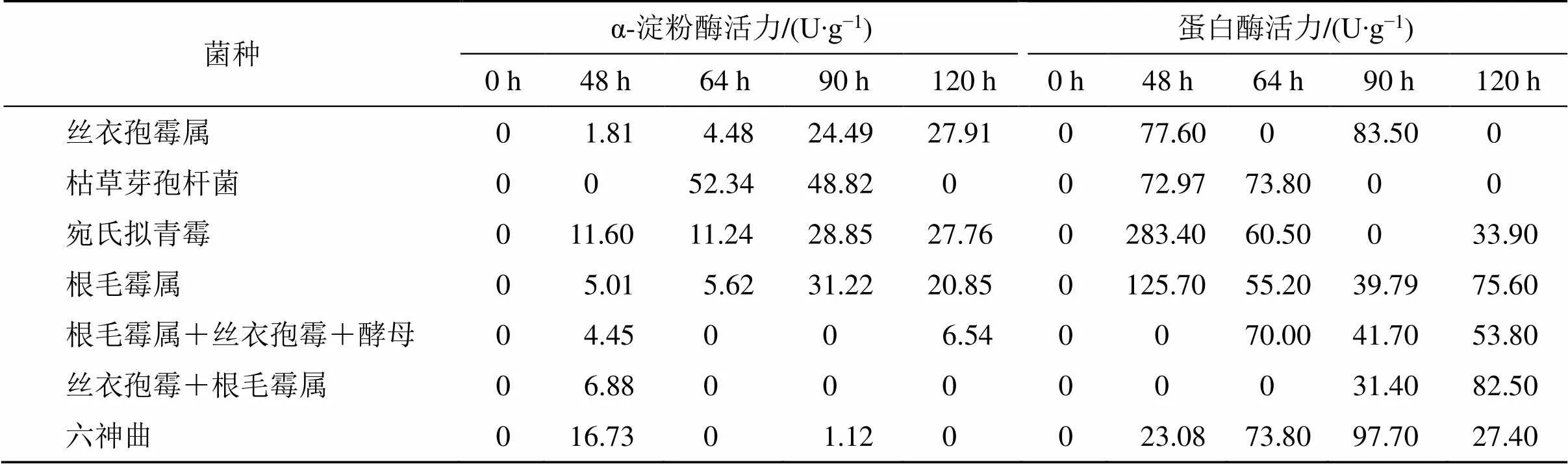
表2 纯菌发酵与混菌发酵半夏曲的酶活力比较
0%表示酶活力低于检测阈值
0% indicates that the enzyme activity is lower than the detection threshold
3.7 丝衣孢霉及宛氏拟青霉对草酸钙结晶的破坏作用
接种六神曲发酵后的清半夏毒性明显降低,研究表明这主要由于发酵后半夏曲中的草酸钙针晶被破坏,减少了对细胞的刺激性[16]。采用分离所得优势真菌发酵半夏曲,在光学及电子显微镜下观察半夏曲发酵过程中草酸钙针晶的形态变化情况,发现丝衣孢霉、六神曲、宛氏拟青霉对草酸钙针晶具有不同程度的破坏作用(图10),特别是接种六神曲及以丝衣孢霉发酵64 h的半夏曲中的草酸钙针晶断裂缺口可在光学显微镜和电镜下明显观察到,推测丝衣孢霉、宛氏拟青霉等可降低半夏中因草酸钙针晶所导致的毒副作用。
半夏毒针晶是目前公认的半夏毒性来源,实验发现半夏中的结晶簇在粉碎过程中大部分崩解,80目粉碎的未发酵半夏中大部分草酸钙结晶为大于1000 μm的单束长针晶,其在发酵过程中经过微生物内呼吸分解转化为活性成分而导致半夏毒性下降。表3展示了分别以六神曲及丝衣孢霉纯培养物作为接种剂发酵半夏曲的情况下,不同发酵时间基质内草酸钙针晶的数量。从表3可以看出,草酸钙单束针晶随发酵时间延长而递减,且递减速度逐渐变慢。与接种六神曲的对照相比,从48 h开始,接种丝衣孢霉的半夏发酵基质内草酸钙针晶降解速度与对照有极显著差异(<0.01),到发酵64 h时,85%以上的单束长针晶已被降解,而此时对照中仅有61%的单束长针晶被降解,表明纯菌发酵降解效率更高,能在短时间内降解大量草酸钙针晶,但无论是六神曲还是纯菌都不能完全降解基质中的草酸钙针晶,且少量草酸钙针晶的存在是否与药物活性有关尚待进一步研究证实。

a-半夏原料 b-六神曲发酵后的半夏 c-丝衣孢霉发酵后的半夏 d-宛氏拟青霉发酵后的半夏

表3 丝衣孢霉纯菌发酵对草酸钙针晶降解的影响(400倍下任选3个针晶测定)
与六神曲发酵相同时间比较:**<0.01
**< 0.01same time fermented by medicated leaven
4 讨论
郭佳佳等[3]认为半夏曲炮制过程中的优势霉菌为宛氏拟青霉()、壮观丝衣霉()及黑曲霉(),本研究也在半夏曲发酵过程中检测到上述真菌,从这些真菌的丰度来看,将半夏曲发酵过程中的主要功能真菌聚焦于来自六神曲的丝衣孢霉菌,与在酒曲、酱油曲等其他自然固态发酵体系中占优势的曲霉、根霉、毛霉等真菌相比,丝衣孢霉菌能够在自然发酵体系中的众多环境真菌中脱颖而出,不仅源于六神曲接种导致的数量优势,也基于对半夏曲发酵基质的良好适应性。这种与半夏物料相互依存的生态优势不仅是该真菌得以在半夏曲发酵过程中实现其功能的生态基础,也为纯菌发酵创造了有利条件,将丝衣孢霉的纯培养物用于半夏曲发酵,对改善半夏曲产品标准化,实现中药炮制工艺的可控化自动化有重要意义,但要将其用于半夏曲纯菌发酵,还需要进一步优化物料配比、料层厚度、温湿度等半夏曲纯菌发酵工艺参数,促使丝衣孢霉在半夏曲发酵基质中尽快形成生态优势,同时还需要深入探讨其对半夏曲成分及活性的影响。本研究发现,丝衣孢霉对半夏主要毒性成分草酸钙针晶蛋白[17]呈现特殊的溶解破坏作用,且纯菌发酵半夏时高产蛋白酶(蛋白酶活性在发酵48 h时达到对照的434%),推测这种溶解破坏作用很可能就是源于丝衣孢霉所产蛋白酶对草酸钙针晶结合蛋白的降解,但由于半夏曲的毒性与活性可能相互依存,如何通过控制发酵条件使半夏曲的毒性、活性相互平衡,还有待进一步研究。
总体上,本研究将纯培养及免培养方法相结合,研究半夏曲发酵机制,得到以下主要结论:(1)半夏曲发酵过程中的优势真菌为丝衣孢霉属、宛氏拟青霉、根毛霉属等,优势细菌是假单胞菌、芽孢杆菌属等,其中,以丝衣孢霉为主的丝状真菌是半夏曲发酵过程中的主要功能微生物;(2)半夏曲发酵过程中的微生物代谢以氨基酸代谢、碳水化合物代谢为主,其次为维生素代谢、脂质代谢等;(3)丝状真菌可改善半夏曲的促消化功能;(4)丝衣孢霉、宛氏拟青霉等可降低半夏中因草酸钙针晶所导致的毒副作用。
利益冲突 所有作者均声明不存在利益冲突
[1] 孙佳彬.发酵半夏曲减毒增效的研究 [D].成都: 成都中医药大学, 2018.
[2] Shu B O, Ying J, Wang T,.Microbiota and chemical compounds in fermented(Banxiaqu) from different areas in the Sichuan Province, China [J]., 2019, 68(1): 83-92.
[3] 郭佳佳, 苏明声, 王立元, 等.半夏曲炮制过程中优势微生物的鉴定 [J].中国中药杂志, 2016, 41(16): 3027-3031.
[4] 龙凯, 郭佳佳, 苏明声, 等.半夏曲炮制中4种优势微生物的生理生化特性及黄色素含量测定 [J].中草药, 2019, 50(15): 3637-3641.
[5] 卢玲玲, 单洪波, 许育绚, 等.rDNA测序在酵母菌和丝状真菌鉴定中的临床应用评价 [J].中国抗生素杂志, 2021, 46(5): 432-436.
[6] 郭鹏豪, 刘秀丽, 崔颖鹏, 等.真菌通用引物Its1和Its4在丝状真菌鉴定中的价值评价 [J].中国微生态学杂志, 2013, 25(8): 922-924.
[7] 刘新武, 于艳妮, 滕海风, 等.16S rDNA序列在细菌鉴定和检测分析中的应用价值 [J].医学检验与临床, 2017, 28(7): 30-32.
[8] Edgar R C.Search and clustering orders of magnitude faster than BLAST [J]., 2010, 26(19): 2460-2461.
[9] Caporaso J G, Kuczynski J, Stombaugh J,.QIIME allows analysis of high-throughput community sequencing data [J]., 2010, 7(5): 335-336.
[10] Asnicar F, Weingart G, Tickle T L,.Compact graphical representation of phylogenetic data and metadata with GraPhlAn [J]., 2015, 3: e1029.
[11] Langille M G, Zaneveld J, Caporaso J G,.Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences [J]., 2013, 31(9): 814-821.
[12] Comeau A M, Douglas G M, Langille M G I,.Microbiome helper: A custom and streamlined workflow for microbiome research [J]., 2017, 2(1): e00127-16.
[13] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准食品添加剂食品工业用酶制剂: GB 1886.174—2016 [S].北京: 中国标准出版社, 2017.
[14] Lozupone C, Lladser M E, Knights D,.UniFrac: An effective distance metric for microbial community comparison [J]., 2011, 5(2): 169-172.
[15] 魏景超遗.真菌鉴定手册 [M].上海: 上海科学技术出版社, 1979: 130-131, 500-501, 60-63.
[16] 靳晓琪, 黄传奇, 张耕.半夏的毒性物质基础及其炮制解毒机制 [J].时珍国医国药, 2019, 30(7): 1717-1720.
[17] 吴皓, 钟凌云, 张琳, 等.半夏草酸钙针晶的毒性和针晶结合蛋白的研究[A] // 中华中医药学会四大怀药与地道药材研究论坛整中药地制分会第二届第五次学术会议与第三届会员代表大会论文集[C].焦作: 中华中医药学会中药炮制分会, 2007: 96-101.
Fermentation mechanism of(Banxiaqu) and fermentation function of main dominant fungi
SHU Bo1, YU Jin-hong2, WANG Tao2
1.Department of Pharmacy, Affiliated Hospital of Northern Sichuan Medical College, Nanchong 637000, China 2.Sichuan Key Laboratory of Soild-state Fermentation Resource Utilization, Yibin University, Yibin 644000, China
To explore the natural solid-state fermentation mechanism of(Banxiaqu),The composition and main metabolic functions of fermentation fungi and bacteria were studied by culture and uncultured methods, and the isolated strains of main dominant fungi were detected on the amylase and protease production by iodometry and spectrophotometry respectively and observed by microscope on the destruction of calcium oxalate crystal.,,,,andwere involved in the fermentation of.The number of fungi increased significantly during the fermentation, and the fungal diversity in the early and late stage was much higher than that in the vigorous fermentation period.The fungal flora in the fermentative matrix during 40 h to 64 h were significantly different from other samples (< 0.01).was the only dominant fungi species in samples from all stages of the fermentation process of, and obviously inhibited the growth of,and.The number and diversity of bacteria was lower than that of the fungi, and the number had not increased obviously.Picrust functional prediction analysis showed that fungi infermentation were closely related to amino acid metabolism, glucose metabolism and nucleotide synthesis metabolism.Fermentation by fungi strains showed that the, not bacteria, was related to producing of α-mylase and the damage of calcium oxalate crystal.were the main dominant functional microorganisms in the fermentation of, which were mainly contributed to the amylase activity and lower irritation of Banxiaqu.
Banxiaqu; fermentation mechanism; fungi;; fermentation function; solid-state fermentation; iodometry; amylase; protease; calcium oxalate;;;;;; amino acid metabolism; glucose metabolism; nucleotide metabolism
R283.6
A
0253 - 2670(2022)10 - 3022 - 10
10.7501/j.issn.0253-2670.2022.10.012
2021-12-14
南充市科技局基金项目(19SHZ0450)
舒 波(1981—),男,学士,研究方向为中药炮制工艺。Tel: 15181786677 E-mail: 30387948@qq.com
通信作者:王 涛,教授,主要从事固态发酵技术研究。E-mail: 289615848@qq.com
[责任编辑 郑礼胜]
