基于UPLC-Q/TOF-MS的金振口服液在大鼠体内外源物表征
2022-05-24张嘉颖李海波刘苓娴石丹枫王振中姚新生
张嘉颖,李海波,刘苓娴,石丹枫,王振中,曹 亮,姚新生,肖 伟*,于 洋*
基于UPLC-Q/TOF-MS的金振口服液在大鼠体内外源物表征
张嘉颖1,李海波2,刘苓娴1,石丹枫1,王振中2,曹 亮2,姚新生1,肖 伟2*,于 洋1*
1.暨南大学中药及天然药物研究所,广东 广州 510632 2.江苏康缘药业股份有限公司中药制药过程新技术国家重点实验室,江苏 连云港 222001
采用UPLC-Q/TOF-MS技术对大鼠ig金振口服液后的血浆、尿液、胆汁和粪便中的原型成分及代谢产物进行分析,描绘金振口服液体内代谢轮廓,初步揭示其体内物质基础。采用Waters ACQUITYTMBEH C18(100 mm×2.1 mm,1.7 μm)色谱柱,流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B)进行梯度洗脱,体积流量0.4 mL/min,柱温40 ℃。电喷雾离子源(ESI),centroid 模式进行数据采集。基于高分辨质量亏损过滤技术,建立5步检识策略来表征金振口服液在大鼠体内的相关外源物。大鼠ig金振口服液,在生物样本中共检识112个外源性成分,包括44个原型成分(22个成分经对照品比对)和68个代谢产物,主要的代谢途径为II相代谢葡萄糖醛酸化、硫酸化及I相代谢甲基化等。采用UPLC-Q/TOF-MS技术及建立的检识策略可对金振口服液在大鼠血浆、尿液、粪便和胆汁中的外源物进行快速有效的定性检识,有助于揭示其体内药效成分,为其药动学特征的描绘及建立与功效相关联的质量控制方法提供一定的参考依据。
金振口服液;UPLC-Q/TOF-MS;原型成分;代谢产物;黄芩苷;甘草苷
金振口服液(Jinzhen Oral Liquid,JZOL)为江苏康缘药业股份有限公司独家产品,由山羊角、大黄、黄芩、平贝母、人工牛黄、石膏、青礞石、甘草8味中药组成,已列为国家中药保护品种[1]。方中山羊角、黄芩、平贝母为君药,其中山羊角具有解热、镇静和抗惊厥的功效,黄芩通腹泄肺热,平贝母清热散结、化痰止咳;大黄、石膏、人工牛黄为臣药,大黄泻热通腑,使肺之痰热由下而解,生石膏泻火、化痰,协助君药清泄肺热,人工牛黄降温、化痰、止咳、平喘;青礞石为佐药,坠痰下气,平肝定惊;甘草为使药,和中缓急,调和诸药;诸药合用,共奏清热解毒、去痰止咳的功效[2]。金振口服液临床上主要用于治疗小儿急性支气管炎符合痰热咳嗽者[3-4],表现为咳嗽、咳吐不爽、咳吐黄痰、发热、舌质红、苔黄腻。其疗效可靠、不良反应少、服用方便、依从性高,是我国儿童医疗保险品种,被誉为治疗小儿肺热咳嗽的妙药[5]。
前期采用UPLC-Q/TOF-MS技术描绘了JZOL的整体化学轮廓,共检识鉴定了90余个化学成分,总结了不同结构类型化合物的色谱行为和碎片裂解途径,为金振口服液药效物质基础研究提供了参考。到目前为止,JZOL在临床试验、药理学和质量控制等领域都进行了大量的研究[6-8]。其中,JZOL中组方药味及相关单体化合物的代谢研究报道较多[9-14],为JZOL体内代谢产物的分析和鉴定奠定了一定的基础。然而,对于口服JZOL后外源性成分的入血情况及其在大鼠体内的生物转化的报道甚少,给药效的深入研究、临床安全用药及质量标准的进一步提升造成了一定的困难。因此,有必要对JZOL进行全面地体内代谢产物表征。本实验采用超高效液相色谱与飞行时间质谱联用技术(UPLC-Q/TOF-MS),建立一种快速有效的JZOL在大鼠体内外源性成分及代谢途径的分析方法,为其药动学特征描绘及其质量标准提升奠定基础,也为JZOL深入的药理活性研究及进一步开发利用提供科学依据。
1 材料
1.1 仪器设备
超高效液相色谱四级杆飞行时间质谱联用仪:色谱系统为Waters ACQUITYTMUPLC超高效液相色谱仪,Waters ACQUITYTMI-Class超高效液相色谱仪(包括二元梯度泵-自动进样器-柱温箱-二极管阵列检测器);质谱系统为Waters SYNAPTTMG2 Q/TOF HDMS四级杆串联飞行时间高分辨质谱(Manchester,U.K.);Waters ACQUITYTMBEH C18(100 mm×2.1 mm,1.7 μm)色谱柱;Sartorius BP 211D型电子天平(德国Sartorius公司);KQ3200E型超声波清洗器(江苏省昆山市超声仪器有限公司);Anke TGL-16G-A型高速离心机(上海安亭科学仪器厂);Sigma台式高速冷冻离心机3K-15(德国Sigma公司)。
1.2 试剂与材料
质谱用水,北京屈臣氏蒸馏水有限公司;质谱级乙腈及甲醇,美国赛默飞世尔科技公司;质谱级甲酸,美国西格玛奥德里奇公司;JZOL制剂,江苏康缘药业股份有限公司(批号201114)。甘草苷(批号110714-201711)、黄芩苷(批号110715- 201821)、大黄酸(批号110757-201607)、汉黄芩素(批号111514-201706)、胆酸(批号100078- 201415)、猪去氧胆酸(批号100087-201411)、去氧胆酸(批号110724-201808)、黄芩黄酮Ⅱ(批号111610-201908),以上均购自中国食品药品检定研究院;汉黄芩苷(批号BP1454)、异甘草素(批号BP0787)、千层纸苷(批号BP1046)、白杨素7--β--葡萄糖醛酸(批号BP3423)、(18β,20)-甘草酸(批号BP2052)、甘草次酸(批号BP0681),以上购自成都普瑞法科技开发有限公司;芦荟大黄素-8--β--葡萄糖苷(批号DST141028-013)、甘草素(批号DST190920-010)、异甘草苷(批号DST190802-142),购自成都乐美天医药科技有限公司;甘草酸(批号B20417)、大黄酚-8--β--葡萄糖苷(批号B20239),购自源叶生物有限公司;贝母素乙(批号B20081-20),购自上海麦克林生化科技有限公司;甘草皂苷G2、甘草素二糖苷为课题组自制,所有对照品质量分数均大于98%。
1.3 动物
雄性SPF 级Sprague-Dawley(SD)大鼠,体质量(250±20)g,由广东省实验动物中心提供,许可证号:SCXK(京)2019-0008。动物房温度(23±2)℃,湿度(55±10)%,大鼠每天接受光照12 h,自由饮水进食。动物实验经暨南大学伦理审批(20220304-010)。
2 方法
2.1 动物实验
2.1.1 大鼠ig溶液的配制 取10支JZOL(10 mL/支,共100 mL,批号201114),采用旋转蒸发仪减压浓缩至20 mL,作为JZOL大鼠ig溶液。
2.1.2 分组及给药 大鼠实验前适应性喂养1周,实验前禁食不禁水12 h,随机分成2组:给药组(=6)和对照组(=4),给药组大鼠ig给药JZOL浓缩液7.576 g/(kg·d)(生药量),对照组ig给予等量饮用水。连续ig 5 d,最后1 d ig后,分别采集大鼠0.5、1、2、4 h肝门静脉血置于涂有肝素钠溶液的2 mL EP管中,14 000 r/min离心10 min制备血浆样本,合并各时间点血浆,−20 ℃冰箱保存备用。收集给药后第3~5天的尿液和粪便;取最后1次给药后0~8 h胆汁。
2.2 供试品溶液的制备
2.2.1 对照品溶液的制备 取黄芩苷、汉黄芩苷、甘草苷、甘草酸、大黄酸、贝母素乙等对照品适量,加甲醇定容至10 mL,配制成各化合物终质量浓度为10 μg/mL 的混合对照品溶液。经14 000 r/min高速离心10 min后,取上清液进样UPLC-Q/TOF-MS分析。
2.2.2 JZOL样品溶液的制备 取JZOL适量,经14 000 r/min高速离心10 min后,取上清液进样UPLC-Q/TOF-MS分析。
2.3 体内样品前处理
2.3.1 血浆样品的制备 取100 μL血浆样品于1.5 mL EP管中,加入400 μL冰乙腈沉淀蛋白,涡旋2 min,经14 000 r/min高速离心10 min后,上清液常温下氮气吹干,取100 μL甲醇复溶,涡旋2 min,14 000 r/min高速离心20 min,取4 μL上清液进样UPLC-Q/TOF-MS分析。空白血浆样品处理方法同上。
2.3.2 胆汁样品前处理 混合不同时间段的给药组胆汁样本,取收集的胆汁样本上样于活化平衡后的SPE小柱,待其充分吸附后,先用3 mL 5%的甲醇-水溶液洗去极性大的杂质,再用3 mL纯甲醇进行洗脱,收集纯甲醇洗脱部位,在室温下用氮气吹干,残渣用100 μL纯甲醇复溶,经14 000 r/min高速离心20 min后,取4 μL上清液进样UPLC-Q/TOF-MS分析。空白胆汁处理方法同上。
2.3.3 尿液样品前处理 将不同时间段的给药组尿液样本混合,14 000 r/min高速离心10 min,上清液浓缩至6 mL,上样于活化平衡后的SPE小柱,每次1 mL,重复6次。其他处理步骤同胆汁样品。空白尿液样本按同种方法处理并进样分析。
2.3.4 粪便样品前处理 混合给药组的粪便样本,风干。干粪便样本(1 g)粉碎成粉末后置锥形瓶中,加入10 mL纯甲醇,浸泡24 h后,超声提取30 min,过滤取上清液,经14 000 r/min高速离心10 min后,上清液常温下氮气吹干,残渣用1 mL纯水复溶后,上样于活化平衡后的SPE小柱,其他处理步骤同胆汁样品。空白粪便处理方法相同。
2.4 UPLC-Q/TOF-MS条件
2.4.1 色谱检测条件 Waters ACQUITYTMBEH C18(100 mm×2.1 mm,1.7 μm)色谱柱;柱温40 ℃;体积流量0.4 mL/min;流动相:0.1%甲酸水溶液(A)- 0.1%甲酸乙腈(B)。洗脱梯度:0~13 min,50% B;13~16 min,50%~100% B;16~17 min,100% B;17~18 min,100%~5% B。
2.4.2 质谱检测条件 电喷雾离子化源(ESI),离子源毛细管电压正离子模式3.0 kV,负离子模式−2.5 kV,锥孔电压正离子模式35 V,负离子模式为40 V。二级锥孔电压4 V,离子源温度100 ℃,脱溶剂气温度300 ℃,脱溶剂气体积流量600 L/Hr,在MSE模式中,低能通道碰撞能6 eV,高能通道碰状能20~50 eV。质谱扫描范围为/50~1500,以甲酸钠溶液校正质量轴,以亮氨酸脑啡肽为内标校正质量精度,LockSprayTM体积流量5 μL/min。数据采集为centroid 模式。
闭式热水系统压力膨胀罐的选型需结合具体热水系统经计算后选定,同一系统热水回水温度设定值不同则所需压力膨胀罐的体积也不同且差距明显。用水点多的大型热水系统压力膨胀罐体积较大,在热水设备房专业提资时需充分考虑其安装位置。
2.5 数据采集及分析技术
数据采集应用Waters Masslynx 4.1质谱控制平台,在MSE模式下采集分析样本总离子流图(total ion chromatogram,TIC)。目标物筛选应用基于MDF技术的Waters MetabolynxTM数据处理软件。高分辨质量亏损过滤技术(mass defect filter,MDF)是指一个化合物的准确分子质量和该化合物的整数质量之间的差值,是一项随着高分辨质谱技术的发展而诞生的一种技术[15]。数据处理参数设置如下:分析窗口0~16 min,质量残差过滤窗口设置±70 mDa,代谢物质量数波动窗口0.02;代谢物与空白样本匹配保留时间波动范围±0.4 min;峰面积大于10倍以上,以甲基化等常见代谢反应设置质量亏损数据库[16]。
3 结果与分析
采用“2.4”项的UPLC-Q/TOF-MS条件,在正、负离子模式下,对JZOL、给药组及空白组生物样本(血浆、尿液、粪便、胆汁)进行检测分析。课题组前期对JZOL的化学成分进行快速检识,根据复方的检识结果,以空白大鼠生物样本作为对照,共检识到112个大鼠体内外源物。其中原型成分共44个(22个成分经对照品准确指认,结构见图1),代谢产物共68个(数据见表1,离子色谱提取图见图2、3),TOF-MS的测得值与理论值比较,精确质量数的误差均小于1×10−5。
3.1 JZOL吸收成分及代谢产物分析策略
采用5步策略法表征igJZOL后大鼠体内相关外源物。(1)根据前期对JZOL化学成分表征所建立的化学成分数据库,通过比较其保留时间和碎片离子确定原型成分。(2)基于MDF技术处理筛选大鼠生物样本中的潜在代谢物。JZOL中的成分可以根据其不同的基本骨架划分为几个类型,其中同源成分是在其基本结构上被不同的取代基取代[17]。因此,这一步最关键是确定几个具有代表性的结构,以便于JZOL在体内的代谢产物分析。(3)基于文献检索,从文献中寻找代表性化合物的代谢反应和特征碎片离子。(4)与空白生物样品的对比,找出潜在代谢物。(5)识别和确认大鼠生物样本中代谢物的分子离子和碎片离子。综上,本实验将五步策略法应用于描述JZOL在大鼠体内的代谢特征。
3.2 原型成分的鉴定
在给药组(JZOL)的大鼠血浆、尿液、粪便和胆汁中鉴定出44个原型成分(22个成分经对照品比对),包括21个黄酮类成分、6个三萜类成分、6个胆烷酸类成分、5个生物碱类成分、4个蒽醌类成分、2个有机酸类成分。其中来源于血浆中29个、尿液中34个、胆汁中7个、粪便中20个(图1和表1)。
通过对比空白与含药样品色谱峰的保留时间及质谱数据,并结合对照品及JZOL化学成分的质谱裂解规律,对JZOL体内原型成分进行了鉴定,其色谱图如图3所示。P6的准分子离子为[M-H]−/431.098 0,确定分子式为C21H20O10,二级碎裂给出碎片离子为[M-H-Glc]−/269.045 0,[M-H-Glc-CH2O]−/239.035 2,通过与对照品比对,鉴定P6为芦荟大黄素-8--β--葡萄糖苷。
P23的准分子离子为[M-H]−/459.092 4,确定分子式为C22H20O11,脱去葡萄糖醛酸形成碎片离子[M-H-GluA]−/283.060 4,再脱去CH3形成/268.036 6,通过与对照品比对并结合文献报道[16],P23鉴定为汉黄芩苷。化合物P14(R=6.06 min)、P18(R=7.34 min)在负离子模式下质谱图中显示出相同的准分子离子峰[M-H]−/445.077 7,确定分子式为C21H18O11,MSE高能图中均给出脱掉1分子葡萄糖醛酸形成的特征碎片离子[M-H-GluA]−/269.045 0。此外,P18检识到碎片峰[M-H-GluA-2CO-H2O]−/195.045 8。P14在血浆、尿液及胆汁中检出,经对照品比对,确定为黄芩苷。经过裂解规律分析及课题组前期体外检识结果对比[18],化合物P18确定为去甲汉黄芩素-7--β--葡萄糖醛酸,在血浆、尿液及粪便中均有检出。

*表示经对照品准确指认

表1 大鼠生物样品中JZOL原型及代谢产物的UPLC-Q/TOF-MS数据

续表1

续表1
P-原型成分 M-代谢产物;P、U、B和F代表血浆、尿液、胆汁和粪便样本;*与对照品比较;gluA-葡萄糖醛酸化结合;sul-硫酸化结合
P-prototypes M-metabolites; P, U, B and F represent plasma, urine, bile and fecal samples; *compared with the reference substance; gluA-glucuronide; sul-sulfate

图2 汉黄芩苷和黄芩苷可能的代谢途径
通过查阅文献、与对照品比对保留时间及碎片信息等,共准确指认了包括甘草素二糖苷、异甘草素二糖苷[16,19]等在内的22个原型成分。
3.3 代谢物的鉴定
基于策略第3步,定义了6个化合物为代表结构,涵盖了JZOL的主要化学结构类型(黄酮、三萜、生物碱、蒽醌):甘草苷、黄芩苷、汉黄芩素、甘草酸、贝母素乙、大黄酸。将6种代表性结构的分子式输入Metabolynx XS软件,分别进行了处理。通过对软件处理预测所得潜在的代谢产物进行分析,最终在ig JZOL后的大鼠的生物样本中共检识到68个JZOL相关的代谢物,包括30个黄酮类成分,23个生物碱类成分、9个蒽醌类成分和6个三萜类成分(表1和图3~5,图4为部分代表性代谢产物色谱和碎片离子谱图)。将甘草苷的分子式(C21H22O9)输入Metabolynx XS软件计算后发现,其主要发生的代谢反应包括还原、甲基化、葡萄糖醛酸化和硫酸酯化,基于MDF技术类似外源物筛选出来的结果进行抽提,通过代谢特征及文献比对结果确定代谢产物。
甘草苷结构中含有1分子葡萄糖,在体内容易丢失葡萄糖,以苷元的形式存在[20]。代谢物M13准分子离子峰为[M-H]−/431.097 5,保留时间为3.74 min,分子式为C21H20O10,MSE模式下主要碎片离子为/255.065 3、135.008 8、119.049 1,且碎片离子/255.065 3为母离子丢失176(C6H8O6)产生,推测M13为甘草素的葡萄糖醛酸化代谢产物。同样的,保留时间在6.23 min的色谱峰M36也为甘草素不同位点的葡萄糖醛酸化代谢产物。因此,判断M13和M36分别为甘草素-7--β--葡萄糖醛酸苷和甘草素-4′--β--葡萄糖醛酸苷[20]。
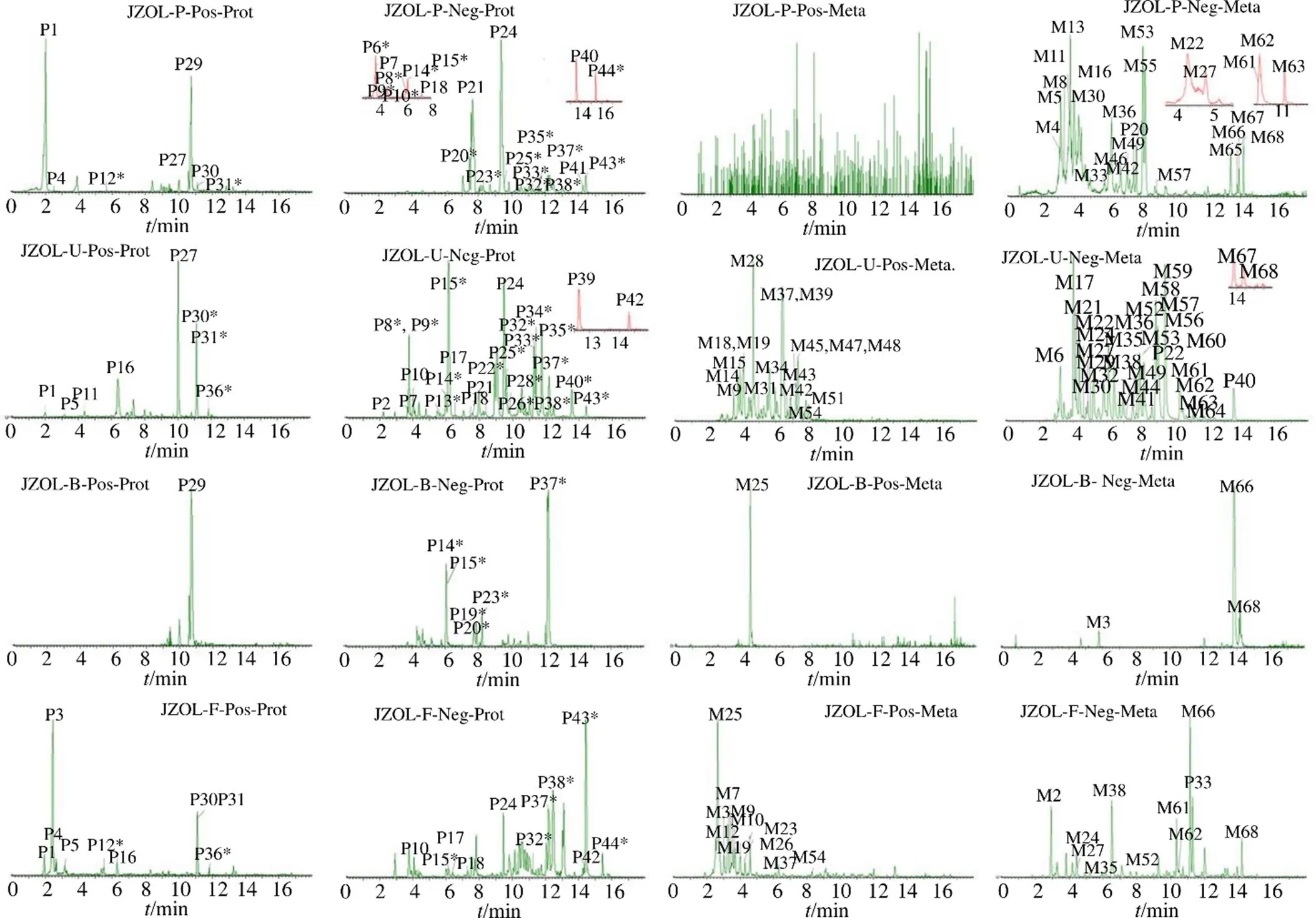
P、U、B、F分别代表大鼠血浆、尿液、胆汁和粪便样本;Pos和Neg分别表示正负离子模式;*表示经对照品准确指认的原型成分;Prot代表原型成分;Meta 表示代谢产物
M5、M24的准分子离子同为[M-H]−/335.023 1,确定分子式为C15H12O7S,脱去1分子硫酸酯基(80)形成[M-H-SO3]−/255.066 1碎片离子,与甘草素的准分子离子(/255.066 1)相同,且发生RDA裂解,形成/135.008 6与119.049 8的碎片离子,与甘草素裂解碎片相同,根据文献报道[21],甘草素经过硫酸酯结合代谢途径形成甘草素-7--硫酸酯和甘草素-4′--硫酸酯,结合位点与葡萄糖醛酸化途径相似,且前者保留时间先于后者,M5和M24的保留时间为3.10、4.36 min,综合文献报道[20]可判断M5为甘草素-7--硫酸酯,M24为甘草素-4′--硫酸酯。
M4的准分子离子为[M-H]−/511.055 1,保留时间为3.03 min,确定分子式为C21H20O13S,脱去1分子葡萄糖醛酸(176)形成[M-H-GluA]−/335.023 2 的碎片离子,提示其为通过葡萄糖醛酸化代谢途径所产生的代谢产物,又脱去SO3形成与甘草素准分子离子相同碎片离子,提示可能经过了硫酸酯结合代谢途径,推测M3为甘草素的硫酸酯和葡萄糖醛酸结合物。
黄芩苷的准分子离子为[M-H]−/445.077 1,在体内易脱去葡萄糖醛酸,以其苷元黄芩素(/269.044 5)存在[22],给药后可在大鼠血浆中发现。黄芩素在体内易发生硫酸酯化反应,结合1分子硫酸酯基(80)形成准分子离子为[M-H]−/349.001 8 的硫酸化产物M16、M52。同时,再结合1分子葡萄糖醛酸(176)形成准分子离子为[M-H]−/525.033 9,葡萄糖醛酸化和硫酸酯化合物M8、M11、M33。M55、M58分别在8.27、9.04 min出峰,前者丢失176,后者丢失80均形成[M-H]−/283.060 7碎片离子,进一步丢失15(CH3)得到268.037 8,结合文献推测[23],M55、M58为黄芩素在体内甲基化后的葡萄糖醛酸化和硫酸酯化产物。

图4 JZOL的主要代谢产物的MS色谱图

图5 JZOL在大鼠体内的代谢特征
汉黄芩苷([M-H]−/459.092 7),在体内易脱去1分子葡萄糖醛酸形成汉黄芩素,M46的准分子离子[M-H]−/459.093 2与汉黄芩苷相同,其碎片离子为 [M-H-GluA]−/283.059 0,推测其为汉黄芩素-5--葡萄糖醛酸苷。汉黄芩素在体内易发生去甲基化反应,M59的准分子离子为[M-H]−/269.044 9,其碎片离子为[M-H-H2O]−/251.034 7,[M-H-CO]−/241.049 9,[M-H-CO-H2O]−/223.040 1,与汉黄芩素裂解规律相同,推测其为汉黄芩素丢失1分子甲基(14)后形成。M30为[M-H]−/635.124 4,确定分子式为C28H28O17,碎片离子/459.091 6,为母离子丢失葡萄糖醛酸(176)而形成,提示结构里含有1分子葡萄糖醛酸,碎片离子/283.060 6为/459.091 6脱去葡萄糖醛酸(176)形成,与汉黄芩素准分子离子相同,提示可能是经过葡萄糖醛酸化代谢途径产生,推测M30为汉黄芩素的2分子葡萄糖醛酸结合形成的代谢产物(图2)。
生物碱主要的活性成分为贝母素乙,生物碱类化合物在正离子模式下出峰,负离子下无响应。通过Metabolynx XS软件对贝母素乙进行分析,发现其以I相代谢为主,易发生水合反应、还原反应和羟基化,相关代谢产物在血中几乎无响应,主要存在于尿液和粪便当中。M1准分子离子为[M+H]+/448.342 4,脱去1分子H2O得到/430.332 5,与原型成分贝母素乙的准分子离子相同。连续丢失2分子H2O,得到/412.320 3,判断M1为贝母素乙的水合化产物。M15准分子离子为[M+H]+/446.326 4,为贝母素乙的羟基化代谢产物。M45保留时间为7.18 min,准分子离子为[M+H]+/416.316 0,脱去1分子H2O得到[M+H-H2O]+/398.305 9,同时检测到其他碎片[M+H-2H]+/414.304 1,[M+H-C18H26O2]+/141.102 6,符合贝母素乙的裂解规律,判断M45为贝母素乙的去甲基化合物。
甘草酸分子结构中由1分子甘草次酸和2分子葡萄糖醛酸组成,在体内易丢失2分子葡萄糖醛酸而水解形成苷元[24],以苷元的形式发生I相及Ⅱ相代谢反应,主要代谢产物能在血中检出。M65的保留时间为13.41 min,准分子离子为[M-H]−/485.327 0,确定分子式为C30H46O5,其碎片信息为[M-H-C6H8O]−/389.270 0,推测该代谢物为甘草次酸羟基化产物。
蒽醌类主要的活性代表成分为大黄酸,大黄酸发生I相和II相代谢。I相代谢以甲基化、羟基化为主。M62的保留时间为10.40 min,准分子离子为[M-H]−/297.040 9,确定分子式为C16H10O6,其碎片信息为[M-H-CO2]−/253.051 7,[M-H-CO2-CO]−/225.055 1,与文献报道的相同[24],因此确定该代谢物为大黄酸甲基化产物。结合CH3后,极易发生II相代谢,得到葡萄糖醛酸化产物(M42)。II相代谢以葡萄糖醛酸化和硫酸化为主。M21保留时间为4.19 min,准分子离子为[M-H]−/362.981 2,脱去1分子硫酸酯基(80),得到[M-H-SO3]−/283.024 3碎片离子,与大黄酸的准分子离子相同,同时还检测到碎片[M-H-SO3-CO2]−/239.034 7,[M-H-SO3-CO2-CO]−/211.039 5,可以判断M21为大黄酸的硫酸酯结合物。
此外,文献报道[25]大黄酸在体内易发生还原反应,还原成蒽酮类化合物(M64:大黄酸-9-蒽酮),大黄酸-9-蒽酮发生Ⅱ相代谢,结合SO3,准分子离子为[M-H]−/349.001 8(C15H10O8S)的硫酸酯结合物M56为大黄酸-9-蒽酮-8--硫酸酯。
4 讨论
本研究采用UPLC-Q-TOF-MS技术结合五步分析策略法对JZOL大鼠ig后体内原型成分及代谢产物进行快速检识,鉴定了112个源自JZOL的外源性成分,包括44个原型成分和68个代谢产物。其中,共29个原型成分和31个代谢成分被吸收入血。上述结果表明,JZOL吸收入血成分主要为黄酮类、三萜类和蒽醌类。在大鼠体内主要代谢反应类型为水合、羟基化、葡萄糖醛酸化及硫酸酯化等。
以黄芩苷为代表的黄酮类成分是JZOL的药效成分。有研究表明黄芩苷及其衍生物具有抗氧化、抗炎、镇痛、抗病毒等多种重要的药理作用[21-24],同时黄芩苷入血迅速,能在体内产生多种类型的代谢产物。本实验通过与空白样品的比较,共检测到了5个黄芩苷相关代谢产物,与文献报道基本一致,主要为黄芩苷葡萄糖醛酸化代谢物、黄芩素硫酸酯化代谢物、3个黄芩素葡萄糖醛酸和硫酸化代谢物[22]。本实验中,平贝母的生物碱成分的相关原型在血中几乎没有检出,其主要暴露于尿液中,这可能与生物碱类成分在血中的达峰时间较快,半衰期较短[26],药物成分经血液循环至肾小球中,随尿液排出;另一种可能是由于JZOL作为一个复方制剂,药味多,所含化学成分复杂,各个成分在吸收入血过程中可能形成竞争或协同作用,而未表现出与单味药或单个成分相同的多种代谢途径。基于上述研究结果,后期可以聚焦入血代表性活性成分,探究口服JZOL后,大鼠血浆中多成分药动学特征,以揭示JZOL发挥临床功效的体内潜在药效物质。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S].一部.2020: 1164-1165.
[2] 李瑾.金振口服液临床研究应用进展 [J].内蒙古中医药, 2014, 33(8): 118-119.
[3] 季汝凤, 夏煜.金振口服液治疗小儿支气管肺炎的疗效观察 [J].中国医药指南, 2017, 15(17): 195-196.
[4] 段永彬, 歹丽红, 张俊霞.金振口服液联合美洛西林治疗小儿急性支气管炎的临床研究[J].现代药物与临床, 2021, 36(5): 1036-1039.
[5] 陆权, 鲍一笑, 王薇, 等.金振口服液有效性和安全性的多中心、随机对照临床研究 [J].中国实用儿科杂志, 2010, 25(5): 383-387.
[6] 舒毅芳, 牛小玲, 吴杰.金振口服液治疗小儿支气管炎的临床疗效观察 [J].贵州医药, 2018, 42(1): 48-50.
[7] 杨莉颖, 陈慧, 杨红丽, 等.金振口服液治疗风热犯卫型小儿流行性感冒的临床观察 [J].中国社区医师, 2019, 35(23): 117.
[8] 洪倩, 陈昌秀, 刘艳侠, 等.金振口服液退热作用机制动物实验研究 [J].儿科药学杂志, 2021, 27(2): 1-4.
[9] Kim J K, Kim Y S, Kim Y,.Comparative analysis of flavonoids and polar metabolites from hairy roots ofand[J]., 2014, 30(3): 887-892.
[10] 孙欣光, 张洁, 庞旭, 等.天然黄酮苷的代谢途径研究进展 [J].中草药, 2020, 51(11): 3078-3089.
[11] Han H, Zeng W L, He C Y,.Characterization of metabolites of sweroside in rat urine using ultra-high-performance liquid chromatography combined with electrospray ionization quadrupole time-of-flight tandem mass spectrometry and NMR spectroscopy [J]., 2014, 49(11): 1108-1116.
[12] Du L Y, Qian D W, Shang E X,.UPLC-Q-TOF/MS-based screening and identification of the main flavonoids and their metabolites in rat bile, urine and feces after oral administration ofextract [J]., 2015, 169: 156-162.
[13] Zhu H Y, Bi K S, Han F,.Identification of the absorbed components and metabolites of Zhi-Zi-Da-Huang Decoction in rat plasma by ultra-high performance liquid chromatography coupled with quadrupole-time-of-flight mass spectrometry [J]., 2015, 111: 277-287.
[14] 贾彩霞, 陈建新, 庞小涵, 等.基于网络药理学和分子对接预测大黄素治疗脑缺血中风的作用机制[J].世界中医药, 2021, 16(6): 878-886.
[15] 冯年平, 狄斌, 刘文英.药物代谢研究与中药现代化 [J].世界科学技术-中医药现代化, 2003, 5(2): 5-7.
[16] Geng J L, Dai Y, Yao Z H,.Metabolites profile of Xian-Ling-Gu-Bao Capsule, a traditional Chinese medicine prescription, in rats by ultra performance liquid chromatography coupled with quadrupole time-of-flight tandem mass spectrometry analysis [J]., 2014, 96: 90-103.
[17] Zhang H Y, Zhang D L, Ray K,.Mass defect filter technique and its applications to drug metabolite identification by high-resolution mass spectrometry [J]., 2009, 44(7): 999-1016.
[18] Zhang F X, Xie Z N, Tang X Y,.A combination of representative compounds, metabolism platform and diagnostic extraction strategy for characterization of metabolites of Shuang-Huang-Lian Oral Liquidby ultra-performance liquid chromatography coupled with time-of-flight mass spectrometry [J]., 2018, 155: 216-234.
[19] Ma L, Zhao Y Y, Zhang X X,.Characterization of the global metabolic profile of liquiritin in rat plasma, urine, bile and feces based on UHPLC-FT-ICR MS [J]., 2018, 8(11): 5945-5952.
[20] 王志鹏, 孙亮, 张凤, 等.基于UPLC-Q-TOF/MS分析痰热清注射液在大鼠体内的入血成分 [J].中国实验方剂学杂志, 2018, 24(9): 77-85.
[21] Hu L F, Yao Z H, Qin Z F,.metabolic profiles of Bu-Zhong-Yi-Qi-Tang, a famous traditional Chinese medicine prescription, in rats by ultra-high-performance liquid chromatography coupled with quadrupole time-of-flight tandem mass spectrometry [J]., 2019, 171: 81-98.
[22] Xiang C, Qiao X, Wang Q,.From single compounds to herbal extract: A strategy to systematically characterize the metabolites of licorice in rats [J]., 2011, 39(9): 1597-1608.
[23] 张沂, 穆杰, 高伟华, 等.基于网络药理学从系统层面探讨黄芩苷治疗肺纤维化的效应机制研究[J].世界中医药, 2020, 15(10): 1373-1380.
[24] 金汉台, 刘建庭, 王建方, 等.基于UPLC-Q-TOF/MS的复方鱼腥草合剂大鼠血清药物化学研究 [J].中草药, 2021, 52(10): 2890-2896.
[25] Song R, Xu L, Xu F G,.metabolism study of rhubarb decoction in rat using high-performance liquid chromatography with UV photodiode-array and mass-spectrometric detection: A strategy for systematic analysis of metabolites from traditional Chinese medicines in biological samples [J]., 2010, 1217(45): 7144-7152.
[26] 赵益, 朱卫丰, 刘红宁, 等.贝母辛平喘作用及机制研究 [J].中草药, 2009, 40(4): 597-601.
Characterization of xenobiotics of Jinzhen Oral Liquid in rats based on UPLC-Q/TOF-MS
ZHANG Jia-ying1, LI Hai-bo2, LIU Ling-xian1, SHI Dan-feng1, WANG Zhen-zhong2, CAO Liang2, YAO Xin-sheng1, XIAO Wei2, YU Yang1
1.Institute of Traditional Chinese Medicine and Natural Products, Jinan University, Guangzhou 510632, China 2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China
To study the prototypes and their metabolites in rat plasma, urine, bile and feces after intragastric administration of Jinzhen Oral Liquid (金振口服液, JZOL) by UPLC-Q/TOF-MS technique.A Waters ACQUITYTMBEH C18column (2.1 mm×100 mm, 1.7 μm) was used for gradient elution with mobile phase 0.1% formic acid aqueous solution (A) and 0.1% formic acid acetonitrile (B), and the flow rate was 0.4 mL/min, the column temperature was 40 ℃.Electrospray ion (ESI) source was applied for the qualitative analysis under the positive and negative ion modes.Data is collected in centroid mode.Mass defect filter (MDF) technique and a five-step strategy were established to characterize the related xenobiotics of JZOL in four biological samples of rats.A total of 112 xenobiotics were identified, including 44 prototype components and 68 metabolites, of which 22 prototype components were identified with reference substance.The main metabolic pathways were phase Ⅱ metabolic reactions (mainly including glucuronidation and sulfonation) and phase Ⅰ metabolic methylation, etc.The established five-step strategy based on UPLC-Q/TOF-MS technique can be used for the rapid and effective qualitative identification of the xenobiotics in rat plasma, urine, feces and bile after oral administration of JZOL, which would be helpful to reveal the effective components.It provides some reference for the characterization of pharmacokinetic characteristics and the establishment of quality control methods related to efficacy.
Jinzhen Oral Liquid; UPLC-Q/TOF-MS; prototypes; metabolites; baicalin; liquiritin
R284.1
A
0253 - 2670(2022)10- 2956 - 12
10.7501/j.issn.0253-2670.2022.10.004
2021-12-06
江苏省省级工业和信息产业转型升级专项资金项目:多组分中药研究关键技术;国家自然科学青年基金资助项目(81903426)
张嘉颖(1997—),女,广东省韶关市人,硕士研究生,研究方向为中药及天然药物的活性成分研究。E-mail: 574487287@qq.com
通信作者:于 洋,副研究员,硕士生导师,研究方向为中药及天然药物活性成分研究。E-mail: 1018yuyang@163.com
肖 伟,研究员级高级工程师,博士生导师,中国工程院院士,研究方向为中药及天然药物活性成分研究。E-mail: xw_kanion@163.com
[责任编辑 王文倩]
