结构性肺病合并侵袭性肺曲霉病40例临床分析
2022-05-20梁嫄琦陈愉生李鸿茹
梁嫄琦,陈愉生,李鸿茹
1.福建省立医院干部特诊一科,福建 福州 350001;
2.福建省立医院呼吸与危重症医学科,福建 福州 350001;
3.福建医科大学省立临床医学院,福建 福州 350001
肺真菌病发病率日益增加,其易感人群主要为免疫缺陷者,如获得性免疫缺陷病、粒细胞减少或缺乏等人群[1],慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)、支气管扩张、间质性肺病、慢性肺脓肿、肺囊肿等结构性肺病导致肺正常结构遭到破坏,肺部真菌感染十分常见,曲霉是其首位感染真菌[2],已受到越来越多的关注。本研究回顾性分析我院结构性肺病合并侵袭性肺曲霉病(invasive pulmonary aspergillosis,IPA)患者的临床资料,对其发病危险因素进行总结,旨在早期发现高危人群并干预。
1 资料与方法
1.1 一般资料 回顾性纳入2008 年1 月至2021年12月间在福建省立医院住院治疗的40例结构性肺病合并IPA的患者(感染组)。纳入标准:(1)年龄≥18岁;(2)入院后确诊IPA:侵袭性肺曲霉病诊断标准参照2008年EORCT/MSG[3]及2016年美国感染病学会(IDSA)共识组发布的指南[1],确诊IPA 定义为:患者肺病变组织穿刺活检病理标本中检出曲霉菌丝;同时存在曲霉感染的宿主因素和临床特征;下呼吸道标本直接镜检发现菌丝、标本培养阳性或血清半乳甘露聚糖(GM)试验阳性。排除标准:(1)肺结构正常;(2)临床诊断、拟诊IPA、慢性肺曲霉菌病、过敏性支气管肺曲霉菌病;(3)严重慢性脏器功能异常;既往已存在自身免疫性疾病;免疫缺陷者;(4)长期使用免疫抑制剂或器官移植患者;(5)资料不全、无法追踪。感染组患者中COPD 15 例,支气管扩张17 例,其他肺结构异常(包括先天性肺囊肿、气道畸形)7例,间质性肺病1例。男性25例,女性15例,中位年龄64.5岁。按1∶2比例随机选择同期住院,且年龄和性别一致、基础疾病相同的同种结构性肺病但未患有IPA 的患者80 例作为对照组。两组患者均处于急性炎症期。
1.2 研究方法 采用回顾性病例对照分析法,收集临床资料包括:(1)一般情况:性别、年龄、住院时间、既往史、曲霉感染史、临床症状体征;(2)辅助检查:微生物检查、胸部CT、气管镜、肺功能;(3)诊疗措施:抗真菌药物方案(发病前3个月内是否使用氟康唑、治疗方案)、感染前入住ICU、激素使用情况(感染前3 个月内糖皮质激素使用总剂量>700 mg、使用时间超过3周)、抗菌药物使用情况(联用广谱抗生素超过2 种、使用时间>14 d)、是否有侵入性操作(如机械通气、成功拔除气管插管等)。
1.3 统计学方法 应用SPSS22.0 统计软件分析数据。计数资料比较,若理论数T>5采用χ2检验,理论数1≤T≤5采用连续校正χ2检验,至少2格以上理论数1≤T≤5 或理论数T<1 采用Fisher 精确概率法检验。计量资料采用S-W 检验是否符合正态分布,正态分布采用均数±标准差(±s)表示,组间比较采用t 检验,非正态分布采用中位数(四分位数间距)表示,组间比较采用Mann-Whitney U 检验。危险因素采用多因素条件Logistic 回归分析,计算比值比(OR)、95%可信区间(CI)。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的基线情况比较 感染组患者中心血管疾病21例、慢性轻症肝病5例,神经系统疾病3例、慢性肾病1例。感染组中3例患者有曲霉感染史,纳入本研究时均为第二次感染。感染组与对照组在年龄、性别、基础疾病、肺功能方面、既往肺部曲霉感染史等方面比较差异均无统计学意义(P>0.05),但感染组患者的住院时间明显长于对照组,差异具有统计学意义(P<0.05),见表1。

表1 两组患者的基线资料比较[例(%)]
2.2 两组患者的下呼吸道病原谱比较 感染组患者均获得病理学证据,其中10例下呼吸道标本培养出曲霉。检出8例(80.0%)烟曲霉,1例(10.0%)黄曲霉,1 例(10.0%)黑曲霉。两组患者共23 例合并其他病原菌感染,以革兰氏阴性菌(Gram-negative bacteria,G-)(17 例,14.2%)感染最常见,其中以假单胞菌属感染为主(8 例,6.7%)。感染组患者的G-菌和真菌感染比例明显高于对照组,差异有统计学意义(P<0.05),见表2。

表2 两组患者的下呼吸道病原谱比较[例(%)]
2.3 两组患者的临床特征比较 感染组患者确诊前急性心力衰竭、急性肾衰竭、营养不良、住院天数>14 d、长期卧床、入住ICU、机械通气、联合使用>2种广谱抗生素、抗生素使用大于14 d、使用抗铜绿假单胞菌抗生素、3个月内使用氟康唑、感染前3个月糖皮质激素使用总剂量>700 mg、使用糖皮质激素超过3周的比例明显多于对照组,差异均有统计学意义(P<0.05),见表3。

表3 两组患者的临床特征比较[例(%)]
2.4 结构性肺病并发IPA的危险因素 将上述有统计学意义的因素进一步多因素Logistic分析,结果显示,联合使用超过2种广谱抗生素、合并G-菌感染、住院天数>14 d、感染前3个月泼尼松总量超过700 mg为IPA发生的独立危险因素(P<0.05),见表4。

表4 结构性肺病合并IPA危险因素的多因素条件Logistic回归分析结果
2.5 两组患者的临床症状和影像学特征比较 感染组患者合并咯血、合并Ⅱ型呼吸衰竭的比例明显高于对照组,差异有统计学意义(P<0.05)。确诊后30 d内感染组患者的病死率为17.5%,而对照组为0,差异有统计学意义(P<0.05),见表5。感染组影像表现为斑片渗出、结节、实变、空洞、新月征等,未发现晕轮征。新发空洞、空气新月征的比例明显高于对照组,差异有统计学意义(P<0.05),见表6。典型影像表现见图1~图3。
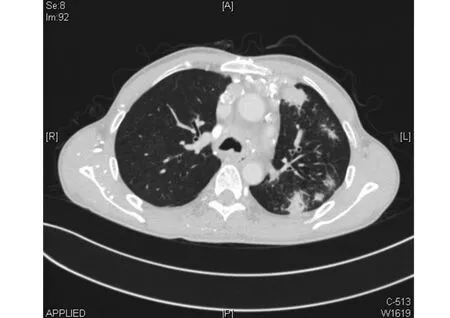
图1 胸部CT显示左肺结节影伴部分空洞

图3 胸部CT显示右肺多发空洞

表5 两组患者的临床症状比较[例(%)]
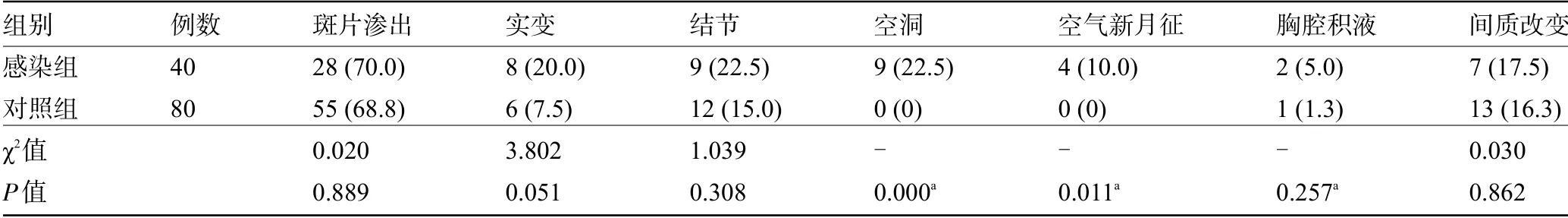
表6 两组患者的影像学特征比较[例(%)]
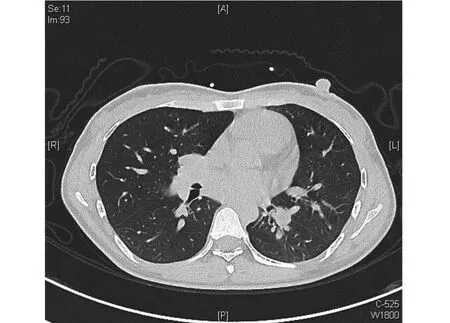
图2 胸部CT显示左肺支气管腔内新生物形成
2.6 治疗方法 IPA 治疗方案上,药物治疗(单药、联合用药)共19 例(47.5%),手术切除联合术后伏立康唑11 例(27.5%),单纯手术治疗7 例(17.5%),未治疗3 例(7.5%),药物种类包括伏立康唑,氟康唑、伊曲康唑、两性霉素Β。单用伏立康唑26 例(65.0%),单用两性霉素Β2例(5.0%),单用氟康唑1例(2.5%),单用伊曲康唑3 例(7.5%),伏立康唑联合两性霉素Β1 例(2.5%)。30 d 内死亡病例中单药治疗共6 例(氟康唑1 例,2.5%;两性霉素Β1 例,2.5%;伊曲康唑1 例,2.5%;伏立康唑3例,7.5%),联合用药1例(2.5%)。
3 讨论
本研究纳入的结构性肺病包括支气管扩张、COPD、间质性肺病及其他肺结构异常疾病。曲霉作为其易感真菌不仅加速结构性肺病的进展,使原发疾病恶化[4-5],也是其不良预后的独立危险因素[6]。本研究发现结构性肺病患者合并IPA 住院时间延长,30 d内病死率高达17.5%。因此,探索结构性肺病合并IPA的发病的危险因素,可以预防曲霉等真菌感染。
我院曲霉感染主要包括烟曲霉、黑曲霉、黄曲霉等,结构性肺病患者中以烟曲霉感染最为常见,这与我国深部真菌病原谱流调结果一致[7]。本研究中易感人群主要集中在40~80 岁之间,性别分布差异无统计学意义。临床症状是以发热咳嗽为主,与文献中报道结果相似[8]。但本研究发现部分结构性肺病合并IPA时更易出现咯血、呼吸衰竭,临床症状相对较重。影像上以斑片渗出非特异性表现最常见,空洞、空气新月征为特征性表现,但临床少见,可能与患者免疫状态、影像资料采集时机有关[9]。
IPA发生与机体体液免疫、细胞免疫、生理屏障受损有关,总结近年国内外关于侵袭性肺曲霉病发病危险因素的研究报道,常见因素包括,脏器功能不全,营养不良,医源性因素(如:机械通气时间>5 d)、感染前入住ICU、预防使用氟康唑等[10-13]。另外SHAHID等[14]指出肺恶性肿瘤特别是非小细胞肺癌也是IPA发生危险因素之一,肺癌患者继发IPA 的发生率至少为40.6%。除上述外,本研究单因素分析结果还发现确诊前急性心力衰竭、急性肾衰竭、长期住院、长期卧床、长期使用广谱抗生素、使用抗铜绿假单胞菌抗生素、长期使用激素与等IPA发生相关。
多因素分析显示住院时间>14 d、联合使用广谱抗生素>2 种、合并G-菌感染、感染前3 个月泼尼松使用总量>700 mg 这4 项是IPA 发生的独立危险因素。对于长期住院的结构性肺病患者通常为年老体弱免疫力低下人群,易接受各种侵入性治疗如鼻胃管、尿管等,机体免疫屏障受损,院内机会性感染的机率增加。同时长期住院院内感染风险高,常联合使用抗生素治疗各类感染性疾病,抗生素使用品种多,频繁更换,造成此类患者肺内细菌多样性降低。肺内菌群具有免疫调节功能,可一定程度限制真菌定植预防感染,菌群的破坏不仅为曲霉提供了有利的生长条件,也减弱宿主免疫反应[15],因而增加感染风险。糖皮质激素应用已有多篇研究证实其与IPA发病有关[5,10]。本研究发现感染前3 个月泼尼松累计总剂量超过700 mg 是IPA 发生的独立危险因素,也与GUINEA 等[12]报道一致。其机制在于大剂量应用激素使全身中性粒细胞、巨噬细胞的吞噬功能降低而对曲霉菌的防御能力减弱,同时糖皮质激素也可通过一种叫甾醇结合蛋白的作用刺激烟曲霉的生长[16],以上两方面共同造成IPA的发生。
病原谱分析显示结构性肺病患者下呼吸病原菌仍是以G-菌为主,且感染组较对照组更易出现G-菌感染,其中最多见的仍是假单胞菌属,与文献报道结果一致[17]。本研究也经多因素分析发现合并G-菌感染与曲霉感染有明显相关性,但具体菌种有待进一步探讨。研究表明,G-菌中的铜绿假单胞菌和曲霉感染存在密切联系[13,15,17]。机制尚不明确。有研究分析当铜绿假单胞菌和烟曲霉分离时,铜绿假单胞菌释放的挥发物有利于烟曲霉对肺实质的入侵[18],但一旦这两种微生物在肺内定殖并直接接触,因铜绿假单胞菌对曲霉的生物被膜的形成有竞争抑制作用,可限制曲霉生长繁殖,联合广谱抗生素使用引起的铜绿假单胞菌被抑制导致曲霉生物被膜形成,也降低了对抗真菌药物的敏感性[19-20]。
本研究仍存在一些局限性。首先,收集的样本量有限,可能会对结果产生一定的影响;其次研究采用回顾性资料进行分析,容易出现信息偏倚;最后,结构性肺病包含病种较多,每种疾病的临床特征不同可能会对结果造成影响。
综上所述,结构性肺病合并IPA 临床特征包括咯血、合并呼吸衰竭、肺内新发空洞、空气新月征,对于结构性肺病的患者,易合并革兰氏阴性菌感染,同时该菌也增加曲霉感染机会,此类患者应避免多种广谱抗生素联合使用,避免长期住院,避免长期大剂量激素使用可一定程度减少IPA发生风险。
