GbCDPK83基因在干旱胁迫下的功能鉴定
2022-05-19史光珍朱新霞
史光珍,高 鑫,朱新霞
(石河子大学 生命科学学院,绿洲城镇与山盆系统生态兵团重点实验室,新疆石河子 832003)
棉花是重要的经济作物也是最重要的纤维作物之一。干旱是制约棉花产业发展的一大问题,它会使棉花叶片出现萎蔫,棉株生长和发育受阻,对棉花的产量、品质影响非常大[1-2]。新疆是中国最大的商品棉生产基地,海岛棉纤维品质优良、生育期较长,主要在无霜期较长的南疆种植,而南疆又干旱、少雨,挖掘海岛棉的耐旱基因,提高海岛棉的耐旱性是目前亟待解决的主要问题。
为了应对干旱胁迫,植物需要进行转录调控以尽量减少干旱对植物的危害。钙依赖性蛋白激酶(calcium dependent protein kinase,CDPKs)是一类重要的钙信号感受响应蛋白,当植物处于逆境时,C端与EF-hands结构结合,CDPKs的活性被激活,从而引发调控过程改变,使得植物细胞的生理生化发生变化,提高植物对不良环境的耐受性[3]。前期研究报道在拟南芥中,AtCPK10基因可通过参与 ABA 途径,增强植株耐旱性[4];过表达AtCPK8可以显著提高转基因植株的抗旱能力[5];在水稻中,过表达OsCDPK7可显著提高转基因植株的抗旱能力[6]。这些研究结果说明 CDPKs可能参与了植物对干旱胁迫的响应。
病毒介导的基因沉默(virus-induced gene silencing,VIGS)是一种利用 TRV 病毒来构建特异性载体,进行基因转化实现基因沉默的技术,VIGS技术在植物抗逆、抗病等相关基因功能鉴定中已被广泛应用[7]。
绿洲城镇与山盆系统生态兵团重点实验室前期发现,GbCDPK83基因在棉花植株受干旱胁迫时上调表达,为研究该基因对棉花抗旱性的影响,本研究采用基因沉默技术,在棉花幼苗中将GbCDPK83基因沉默,对沉默植株及对照植株作干旱胁迫处理,通过观察测定沉默植株与对照植株表型差异及生理生化指标变化,探究GbCDPK83基因的功能,为提高海岛棉抗逆性奠定 基础。
1 材料与方法
1.1 材 料
海岛棉H7124(GossypiumbarbadenseL. H7124),大肠杆菌(Esherichiacoli) DH5α、农杆菌GV3101、pTRV1(辅助载体)、pTRV2均由绿洲城镇与山盆系统生态兵团重点实验室保存。
1.2 方 法
1.2.1 RNA的提取及cDNA的制备 采集海岛棉幼苗叶片,加液氮充分研磨后,使用南京诺唯赞生物科技股份有限公司的RNA提取试剂盒和反转录cDNA试剂盒,按照说明书进行操作,得到海岛棉cDNA。
1.2.2GbCDPK83的克隆 从CottonFGD(https://cottonfgd.org/)数据库中调取GbCDPK83的序列,使用Primer Premier 5.0设计特异性引物(表1)。以反转录的海岛棉cDNA为模板进行PCR扩增,PCR体系共20 μL:1 μL cDNA模板、1 μL混合引物、10 μL 2×Mix、8 μL ddH2O补足体积。PCR反应程序为:94 ℃预变性 4 min;94 ℃变性30 s,59 ℃复性30 s,72 ℃延伸 2 min,35个循环;72 ℃延伸7 min;16 ℃保存。PCR产物用10 g/L的琼脂糖凝胶电泳进行检测,回收、纯化,送上海生工生物工程有限公司进行测序验证。
1.2.3GbCDPK83的生物信息学分析 基于该基因的氨基酸序列,利用ProtParam(http://web.expasy.org/protparam)分析蛋白的理化性质;ProtScale(https://web.expasy.org/protscale)分析蛋白的亲/疏水性;TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM)预测蛋白的跨膜结构域;SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP)分析蛋白的信号肽序列;PRABI-GERLAND(https://npsa-prabi.ibcp.fr/cgi-bin)预测蛋白的二级结构;SWISS-MODEL(https://swissmodel.expasy.org/interactive)预测蛋白的高级结构;SMART MODE(http://smart.embl-heidelberg.de)分析蛋白的结构域;PSORT Prediction(http://psort1.hgc.jp/form.html)预测蛋白的亚细胞定位信息。
1.2.4 VIGS载体构建 以pMD-19T-GbCDPK83为模板进行PCR扩增,所用引物见表1,表1中的下划线为酶切位点,得到VIGS片段,对pTRV2空载体用BamH I和XhoI进行双酶切,得到线性化载体。将回收所得VIGS片段与pTRV2线性载体用T4连接酶连接,转入DH5α感受态细胞,经PCR及双酶切鉴定,成功构建载体pTRV-GbCDPK83。
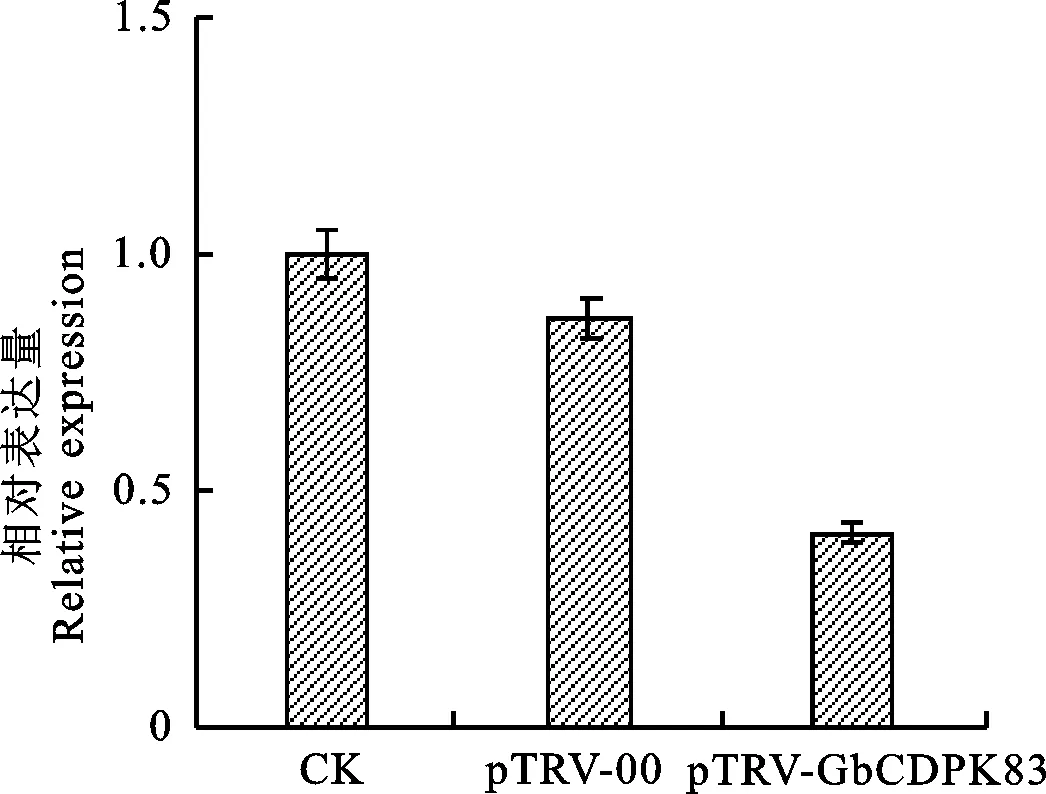
1.2.5 VIGS沉默及相对表达量检测 选取出苗10 d的海岛棉H7124,分别向子叶注射含有重组载体pTRV1/pTRV2-GhCLA1的农杆菌菌液和含有GbCDPK83基因沉默载体pTRV1/pTRV2-GbCDPK83的农杆菌菌液,以非转基因植株和注射了仅含有空载体的农杆菌菌液的棉花植株作为对照,置于25 ℃黑暗培养24 h后于适宜条件下培养。当pTRV-GhCLA1的侵染苗表现出白化后,分别采集沉默植株(pTRV-GbCDPK83)和对照植株第二片真叶液氮保存,提取RNA反转录成cDNA,以UBQ7做内参基因,所用引物见表1,利用SYBR Green实时定量PCR染料对GbCDPK83基因进行实时荧光定量PCR,所得数据用 2-ΔΔCt方法计算获得相对表达量[8]。
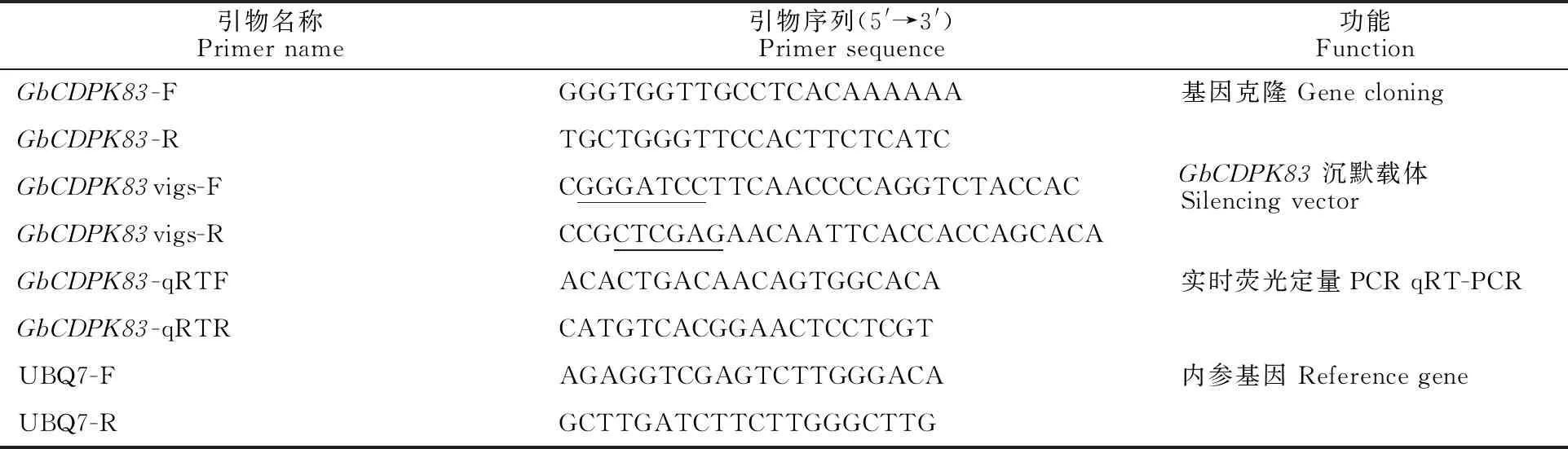
表1 所用引物
1.2.6GbCDPK83基因的功能探究 将非转基因棉株(CK)、空载对照棉株(pTRV-00)、试验组(pTRV-GbCDPK83)分为两组,对其中一组进行干旱胁迫处理,另一组以正常条件进行培养。培养一段时间后,观察表型变化,并取叶片进行相对含水量、相对电导率、脯氨酸含量、丙二醛含量的测定。
2 结果与分析
2.1 GbCDPK83基因的克隆
以反转录获取的海岛棉cDNA为模板,通过PCR扩增GbCDPK83基因,10 g/L琼脂糖凝胶电泳检测结果如图1所示,克隆得到全长1 611 bp的GbCDPK83基因序列,测序后比对,与数据库中的CDS序列相一致。
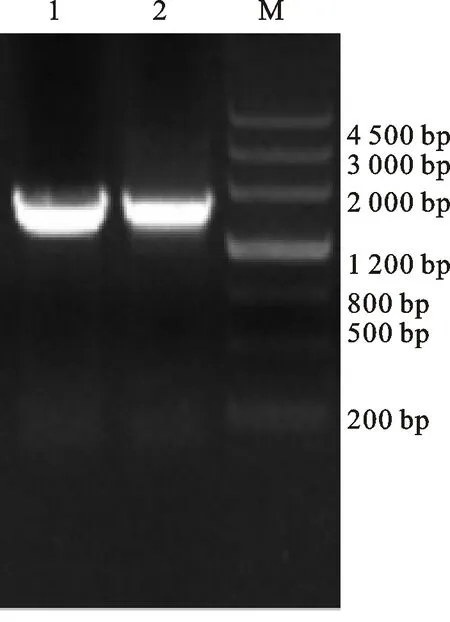
1,2. PCR扩增产物; M. DL2000 DNA Marker
2.2 GbCDPK83蛋白的生物信息学分析
2.2.1 GbCDPK83蛋白理化性质分析 GbCDPK83共编码536个氨基酸,其中精氨酸和赖氨酸(带正电荷)共计67个,天冬氨酸和谷氨酸(带负电荷)共计76个;单个数目最多的赖氨酸残基(Lys)共41个(7.6%),数目最少的色氨酸残基(Trp)仅5个(0.9 %)。分子式C2668H4205N741O810S25,相对分子质量60 423.72 u,理论等电点(pI)为6.09。
2.2.2 GbCDPK83蛋白的亲/疏水性分析 利用ProtScale分析GbCDPK83蛋白的亲疏水性,汇总为图2的曲线。其中131和132位的Lys和Glu评分最低(-3.144),即亲水性最高,而评分最高(2.744)的是279位的Leu,即疏水性最高。就整体而言,GbCDPK83蛋白表现为亲水性。
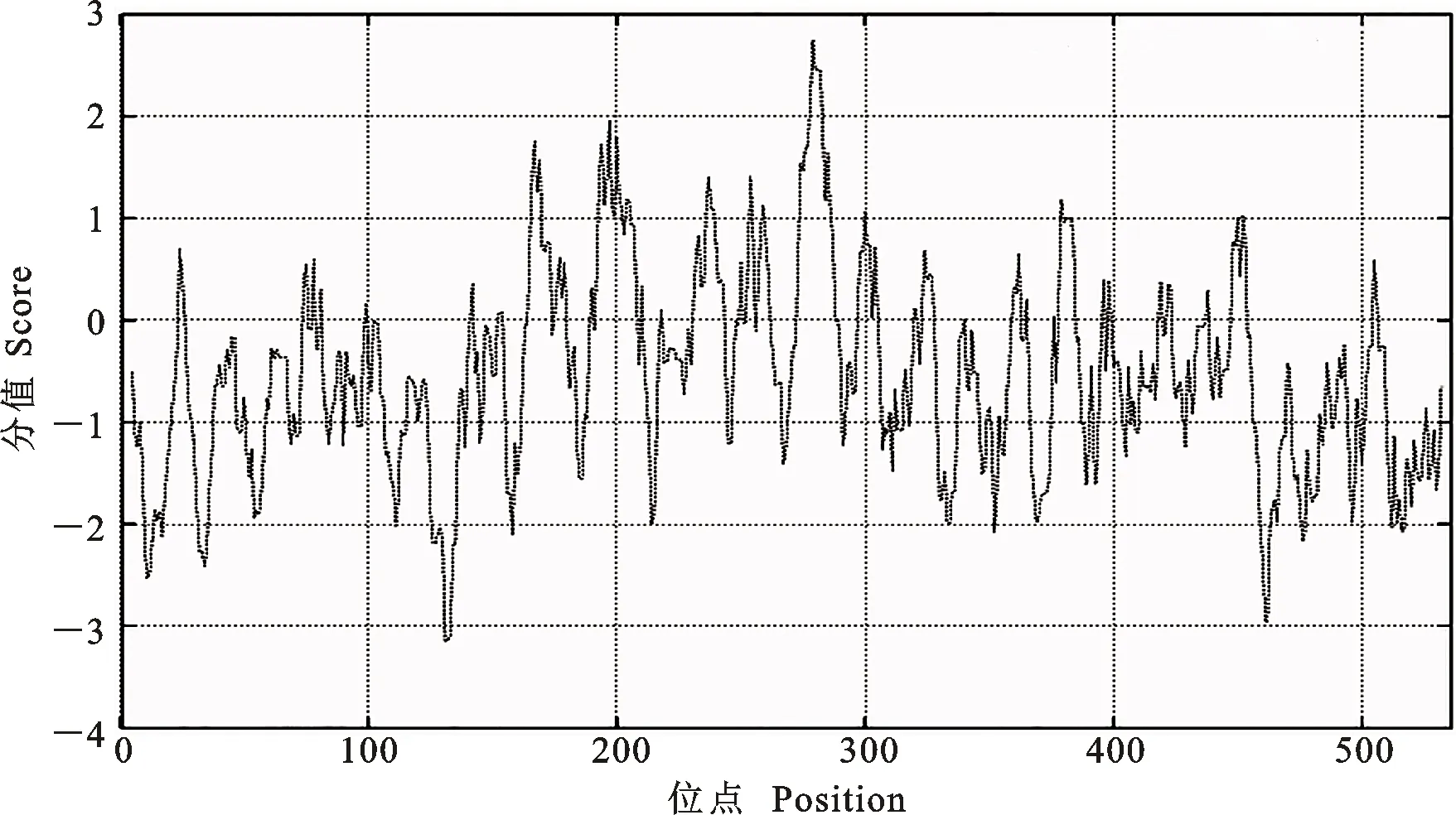
图2 GbCDPK83蛋白的亲/疏水性分析
2.2.3 GbCDPK83蛋白的跨膜结构域分析与信号肽预测 经TMHMM Server v.2.0分析 GbCDPK83蛋白无跨膜结构域,为非跨膜蛋白。SignalP-5.0 Server分析GbCDPK83蛋白的信号肽预测评价为0.003,而无信号肽(其他)的评价为0.997,表明GbCDPK83蛋白并不具备信 号肽。
2.2.4 GbCDPK83蛋白的二级结构和三级结构分析 使用PRABI-GERLAND预测二级结构,发现GbCDPK83蛋白二级结构组成主要为α螺旋(224个氨基酸残基,占比41.79%),其次为无规卷曲(211个氨基酸残基,占比39.37%),β转角(48个氨基酸残基,占比8.96%)。使用SWISS-MODEL预测三级结构,发现GbCDPK83蛋白三级结构空间构象中包含大量的α螺旋,此外还有β转角及一些无规卷曲,与二级结构预测相符。
2.2.5 GbCDPK83蛋白的结构域分析 结构域预测此蛋白在89~347位具有一个Ser/Thr 蛋白激酶基序,在394~422、430~458、466~494、 501~529四个位置,有4个可结合Ca2+进而激活其活性的EF-hands结构(图3),说明GbCDPK83蛋白具有CDPKs特有的结构。
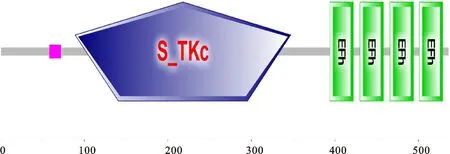
图3 GbCDPK83蛋白的结构域预测
2.2.6 GbCDPK83蛋白的亚细胞定位预测 在线分析工具的预测结果:质膜0.850,内质网膜 0.496,微体(过氧化物酶体)0.306,叶绿体内膜 0.118,说明GbCDPK83蛋白发挥生物学功能的位点有可能在质膜上。
2.3 GbCDPK83的基因沉默
2.3.1GbCDPK83基因的VIGS载体构建 琼脂糖凝胶电泳检测结果见图4-A,说明扩增出大小为403 bp的GbCDPK83基因沉默片段。使用BamH I和XhoI对构建的VIGS载体进行双酶切鉴定(图4-B), 发现VIGS片段与空载体pTRV-00成功连接,表明沉默载体构建成功。
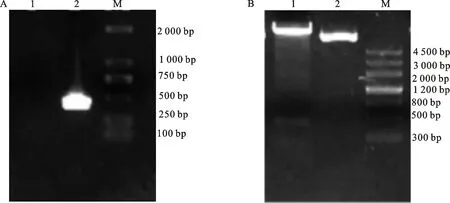
A. GbCDPK83沉默片段扩增产物;1. 阴性对照;2. 沉默片段;M. DL2000 DNA Marker;B. 沉默载体双酶切结果; 1. 双酶切结果;2. 质粒对照;M. Marker Ⅲ
2.3.2GbCDPK83基因的沉默及相对表达量测定 VIGS侵染后的结果如图5所示,注射空载体和注射GbCDPK83沉默载体菌液的棉花叶片颜色正常,未出现白化现象。而注射GhCLA1沉默载体菌液的棉花植株,叶片表现出明显白化,表明本试验所使用的沉默载体可用于棉花VIGS沉默研究。

pTRV-GhCLA1. CLA1基因沉默植株;pTRV-00.TRV空载体植株; pTRV- GbCDPK83. GbCDPK83基因沉默植株
相对于注射了空载体pTRV-00的棉株,注射GbCDPK83沉默载体菌液的棉花植株,表达量极显著降低(图6),表明TRV体系成功抑制了GbCDPK83基因的表达。
2.4 GbCDPK83基因的功能探究
2.4.1 干旱胁迫处理后表型变化 自然干旱10 d 后, 注射pTRV-GhCLA1的植株失水萎蔫,注射空载体和pTRV-GbCDPK83的植株严重失水枯萎,注射 pTRV-GbCDPK83的叶片枯萎更严重(图7-A)。离体叶片在20%PEG中,非转基因植株的叶片萎蔫程度较轻,注射pTRV-GbCDPK83的沉默植株萎蔫严重(图7-B)。
*P<0.05,**P<0.01
pTRV-GhCLA1. CLA1基因沉默植株;WT. 非转基因植株; pTRV-00.TRV空载体植株;pTRV- GbCDPK83. GbCDPK83基因沉默植株;A.干旱胁迫10 d后的棉花;B.干旱胁迫后的离体叶片
2.4.2 生理指标测定结果 在正常状态下,空载体植株相对含水量最高,GbCDPK83基因沉默植株的相对含水量和非转基因的植株相差不大。干旱胁迫后,相对含水量均降低,其中GbCDPK83基因沉默植株的相对含水量极显著降低(图8-A)。
在正常状态下,空载体植株相对电导率最高,GbCDPK83基因沉默植株的相对电导率最低。干旱胁迫后,相对电导率均升高,其中GbCDPK83基因沉默植株的相对电导率极显著上升(图8-B)。
在正常状态下,空载体植株脯氨酸含量最高,GbCDPK83基因沉默植株的脯氨酸含量介于空载体植株和非转基因植株之间。干旱胁迫后,脯氨酸含量均增加,但非转基因植株的脯氨酸含量增加的最多,空载体植株次之,GbCDPK83基因沉默植株增加的最少(图8-C)。
在正常状态下,空载体植株丙二醛含量最低,GbCDPK83基因沉默植株的丙二醛含量介于非转基因植株和空载体植株之间。干旱胁迫后,MDA 含量均有升高,GbCDPK83基因沉默植株的MDA 含量极显著上升,空载体植株次之,非转基因植株上升的不明显(图8-D)。
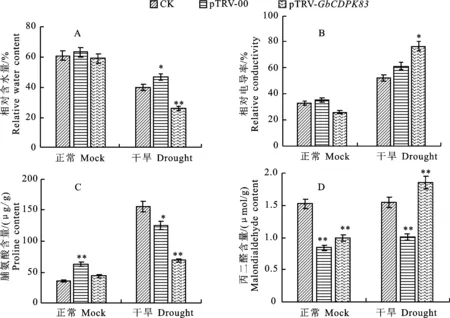
图8 正常与干旱胁迫状态下生理指标
3 讨 论
GbCDPK83蛋白具有CDPK家族典型的结构,二级结构和三级结构预测该蛋白主要由α-螺旋组成,前人研究报道CDPKs中EF-hand功能域是保守的,该功能域中的保守氨基酸残基多数位于α-螺旋中,GbCDPK83蛋白具有相同的结构[9]。
VIGS技术能够在短期内稳定的将目标基因沉默,进而通过表型、生理生化指标对目标基因进行功能分析[10]。为了进一步研究GbCDPK83的功能,本研究利用VIGS技术构建沉默表达载体,经分析沉默GbCDPK83基因前后基因表达量,发现TRV体系成功抑制了GbCDPK83基因的表达。
干旱胁迫下植物的生长发育变缓,其原因就是植物体内水分缺失,造成了渗调物质增加、膜脂过氧化损伤[11]。丙二醛和电导率是反映植物细胞膜损伤程度的重要指标,干旱胁迫会增加丙二醛含量和电导率[12]。脯氨酸对维持植物细胞渗透调节的平衡起着重要作用,脯氨酸含量越高,抗旱能力越强[13],干旱胁迫后,GbCDPK83基因沉默植株的相对含水量显著降低,相对电导率和丙二醛含量显著上升,脯氨酸含量升高但低于空载体及非转基因植株,可能是GbCDPK83基因沉默植株中,GbCDPK83基因表达受到了抑制,GbCDPK83蛋白在细胞内的水平降低,响应干旱胁迫时,传递信号的能力受到影响,使得细胞无法及时适应干旱胁迫带来的不利影响,因此受到了比GbCDPK83基因正常表达植株更严重的细胞膜损伤,渗透调节平衡能力也受到影响。
4 结 论
基于VIGS技术,成功构建GbCDPK83基因的沉默载体,获得GbCDPK83基因沉默棉株。干旱胁迫后,GbCDPK83基因沉默棉株表现为相对含水量显著降低,相对电导率和丙二醛含量显著升高,脯氨酸含量升高但低于空载体及非转基因植株,表明沉默棉株耐旱性减弱。
