宁夏部分地区新生犊牛腹泻的病原调查及主要病原的遗传进化分析
2022-05-19郭仕辉赵清梅陈绍淑张浩东田新岳张津慎许立华余永涛
郭仕辉,赵清梅,陈绍淑,张浩东,田新岳,张津慎,许立华,马 云,余永涛
(1.宁夏大学 农学院,银川 750021;2.北方民族大学 生物科学与工程学院,银川 750021;3.国家民委发酵酿造工程生物技术重点实验室,银川 750021)
犊牛腹泻是犊牛发生的以消化不良、腹泻为主要临床特征的消化道疾病综合征。犊牛腹泻多发生于断奶前的新生哺乳犊牛,故通常将哺乳期犊牛腹泻称为新生犊牛腹泻(Neonatal calf diarrhea,NCD)[1]。NCD是造成断奶前犊牛死亡的最主要原因之一。据报道,美国NCD的死亡率为57%,韩国为53.4%[2],给奶牛和肉牛养殖业带来了巨大的经济损失。此外,NCD还会造成后备母牛生长缓慢、生产性能和免疫力低下,饲养和治疗成本增加,严重制约牛场的良种选育和牛群扩繁[3]。研究表明,中国犊牛腹泻的发病率为 9.6%~60.0%,死亡率大约为1%,但大多研究未对NCD和断奶后犊牛腹泻进行严格区分,NCD的发病情况和死亡率未明确报道[4]。哺乳期犊牛和断奶后犊牛在生理机能和消化道解剖结构、饲养管理方式等方面有很大不同,这也决定了NCD和断奶后犊牛腹泻的发病特点、病原流行特点会有所差别,对NCD进行深入系统地研究有助于犊牛腹泻的早期防控[5]。
肠道病原感染是造成犊牛腹泻的主要原因,流行病学研究表明牛轮状病毒(Bovine Rotavirus,BRV)、牛冠状病毒(Bovine Coronavirus,BCoV)、K99型大肠杆菌和隐孢子虫(Cryptosporidium)是引起犊牛腹泻的最常见病原[6]。此外,沙门氏菌(Salmonella)、产气荚膜梭菌(Clostridiumperfringen)、牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)、十二指肠贾第鞭毛虫(Giardiaduodenalis)等感染也可导致犊牛腹泻[7]。近年研究发现,在美国、韩国、埃及等数十个国家腹泻犊牛的粪便中检出或分离到牛诺如病毒(Bovine Norovirus,BNoV)和纽布病毒(Nebovirus, NeV),这两种病毒可造成肠道黏膜上皮细胞的损伤,可能也是造成犊牛腹泻的重要病原[8-10]。自2018年以来,中国多地也检测到BNoV,但BNoV在宁夏地区的流行情况尚不清楚[11-13]。目前宁夏地区关于犊牛腹泻相关病原的流行病学研究较少,王文佳等[14]、高海慧等[15]对宁夏地区腹泻犊牛主要病原进行了流行病学调查,但没有明确断奶前犊牛的病原检出情况,且未对BCoV、BNoV等其他相关病原进行调查。
为了解宁夏部分地区NCD相关病原的流行情况及主要病原的遗传进化规律,本研究拟对宁夏地区主要奶牛养殖区域的部分中大型规模化牛场中2月龄内的断奶前犊牛进行腹泻相关病原检测及主要病原的遗传进化关系研究,以期为宁夏地区犊牛腹泻的早期防控提供参考。
1 材料与方法
1.1 材 料
1.1.1 试验材料 2019年7月至2019年9月对宁夏银川市、吴忠市、石嘴山市主要奶牛养殖园区的9个中大型规模化奶牛场2月龄内的断奶前犊牛粪便样本进行随机采集,共采集腹泻犊牛粪便106份和健康犊牛粪便89份。详见表1。
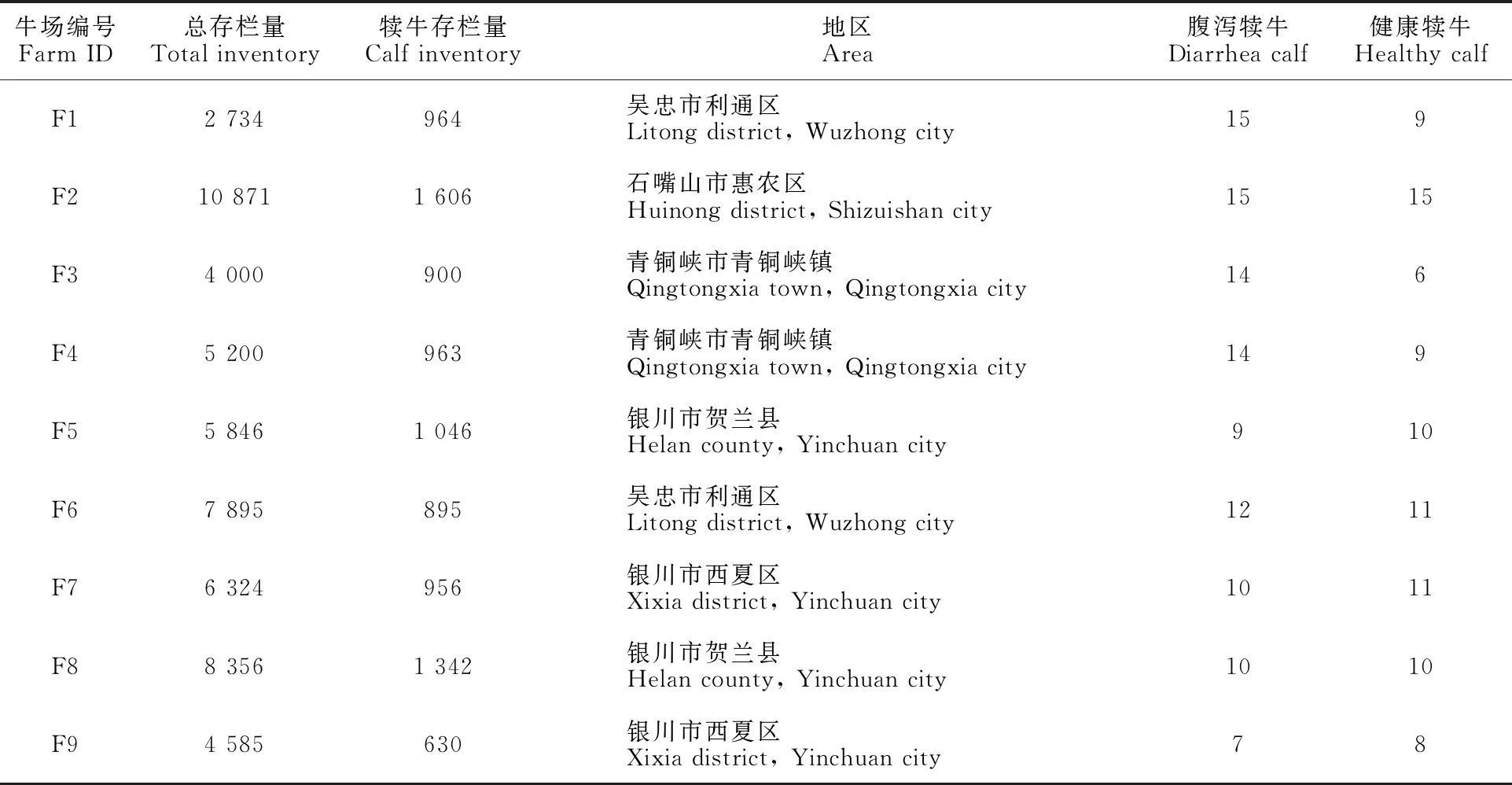
表1 采样情况
根据威斯康星大学麦迪逊分校的粪便评分标准对犊牛是否发生腹泻进行评判[16]。粪便成型、质地良好为0分,为健康犊牛。半成型、粪便稀软为1分,为健康犊牛。粪便稀软、不成型为2分,为腹泻犊牛。粪便完全成液体状为3分,为腹泻犊牛。
1.1.2 主要试剂 RNA提取试剂盒(RNAiso Plus)、反转录试剂盒(PrimescriptTM1st Strand NCDNA Synthesis Kit)、PremixTaqTM、琼脂糖凝胶回收试剂盒(TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0)、DL 1000 DNA Marker均购自宝日医生物技术(北京)有限公司;粪便DNA提取试剂盒(Stool DNA Kit)购自OMEGA公司。
1.1.3 主要仪器 凝胶成像系统(Bio-Rad,ChemiDoc XRS+)、PCR仪(Bio-Rad,S1000 Thermal Cycler)、台式高速冷冻离心机(Eppendorf,5430)。
1.2 方 法
1.2.1 样本采集 首先对待采集犊牛进行日龄等背景信息统计,然后进行粪便样本采集。采用Gomez等[16]报道的肠道侵入法对犊牛直肠粪便进行采集。用酒精棉球对肛门周边区域进行清洁和消毒,佩戴一次性无菌橡胶手套并将食指伸入直肠内轻轻刺激肠壁直至犊牛排出粪便于掌心。将粪便转移至一次性无菌粪便收集杯并置于冰盒中,带回实验室于-80 ℃保存,用于病原检测。
1.2.2 PCR检测 首先按照粪便DNA提取试剂盒说明书提取DNA,然后分别采用K99型大肠杆菌和隐孢子虫的特异性引物进行PCR扩增[17-18]。K99型大肠杆菌 PCR扩增体系为Premix 11.25 μL,DNA 1 μL,上下游引物各0.5 μL,dd H2O 11.75 μL。反应条件为94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸50 s,共35个循环;72 ℃延伸10 min,4 ℃保存。隐孢子虫检测采用巢氏PCR,第一轮扩增体系和反应体系同K99型大肠杆菌,退火温度为55 ℃;第二轮扩增模板为第一轮PCR产物,扩增体系和反应体系同K99型大肠杆菌,退火温度为58 ℃。
另将粪便样本与PBS溶液按1∶5的体积比充分涡旋混匀,-80 ℃冰箱反复冻融3次,3 000 r/min离心10 min,弃沉淀,上清12 000 r/min离心30 min,离心后取上清用于RNA提取。根据RNA提取试剂盒(RNAiso Plus)操作程序对处理样本进行RNA提取。根据PrimescriptTM反转录试剂盒操作程序将提取的总RNA反转录为cDNA。分别参照BRVVP6基因、BCoVN蛋白[19]基因、BNoVRdRp基因[12]、NeVRdRp基因[11]和BVDV5′UTR基因[20]设计并合成引物。以cDNA为模板进行PCR扩增。最后取PCR产物经琼脂糖凝胶电泳和凝胶成像系统进行检测和分析。引物信息详见表2。

表2 引物信息
1.2.3 主要病原的遗传进化分析 根据检测结果,对BRV、BCoV、BNoV和隐孢子虫等主要病原进行遗传进化分析。将PCR产物经琼脂糖凝胶回收试剂盒回收,送至上海生工生物有限公司双向测序。所得序列采用SeqMan(DNAstar 7.0)软件进行序列拼接,在NCBI数据库(https://blast.ncbi.nlm.nih.gov)中进行BLAST比对。应用DNAstar软件中的MegAlign程序对BLAST比对中序列一致性较高的同源序列进行Align分析,根据Align结果,应用Mega 7.0软件采用Neighbor-Joining法构建系统发育树。
1.2.4 统计分析 应用EXCEL 2016软件对病原检测结果进行统计分析并绘图。
2 结果与分析
2.1 腹泻情况统计
对随机采集的106份腹泻犊牛日龄信息进行统计,结果如表3所示。11~20日龄的腹泻犊牛占比最高(33.0%),其次是1~10日龄(31.1%)和21~30日龄(17.9%),其他日龄的腹泻犊牛占比较低,均小于10%。

表3 腹泻犊牛日龄信息分布情况
2.2 病原检测
2.2.1 主要病原检出结果 对PCR检测结果进行统计,结果如表4所示。腹泻犊牛BRV、BCoV、BNoV、NeV、K99型大肠杆菌和隐孢子虫检出率分别为19.8%、9.43%、12.26%、0.94%、2.83%和6.60%,BVDV检出率为0。健康犊牛BCoV、BNoV、NeV、K99型大肠杆菌和隐孢子虫检出率分别为5.62%、5.62%、1.12%、1.12%和3.37%,BRV和BVDV检出率为0。
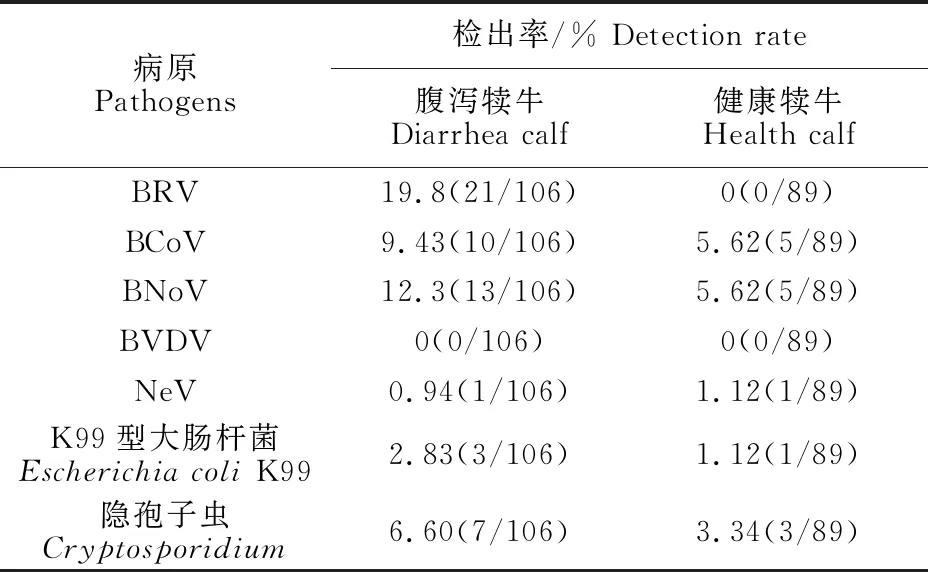
表4 主要病原检出结果
2.2.2 主要病原感染情况 各牛场腹泻犊牛主要病原检出结果如图1所示。检出2种以上病原的牛场有7个,检出3种以上病原的牛场有5个,检出4种以上病原的牛场有2个。BRV、BCoV、BNoV、NeV、BVDV、K99型大肠杆菌和隐孢子虫的场群流行率分别为77.8%(7/9)、44.5%(4/9)、55.6%(5/9)、11.1%(1/9)、0(0/9)、11.1%(1/9)和33.3%(3/9)。其中BRV牛场检出率最高,其次是BNoV、BCoV和隐孢子虫,最后是NeV和K99型大肠杆菌,BVDV未检出。BCoV检出主要集中在牛场F4和F7,BNoV检出主要集中在牛场F5和F8,隐孢子虫检出主要集中在牛场F7、F5和F1,NeV仅在F3牛场检出,K99型大肠杆菌仅在F7牛场检出。
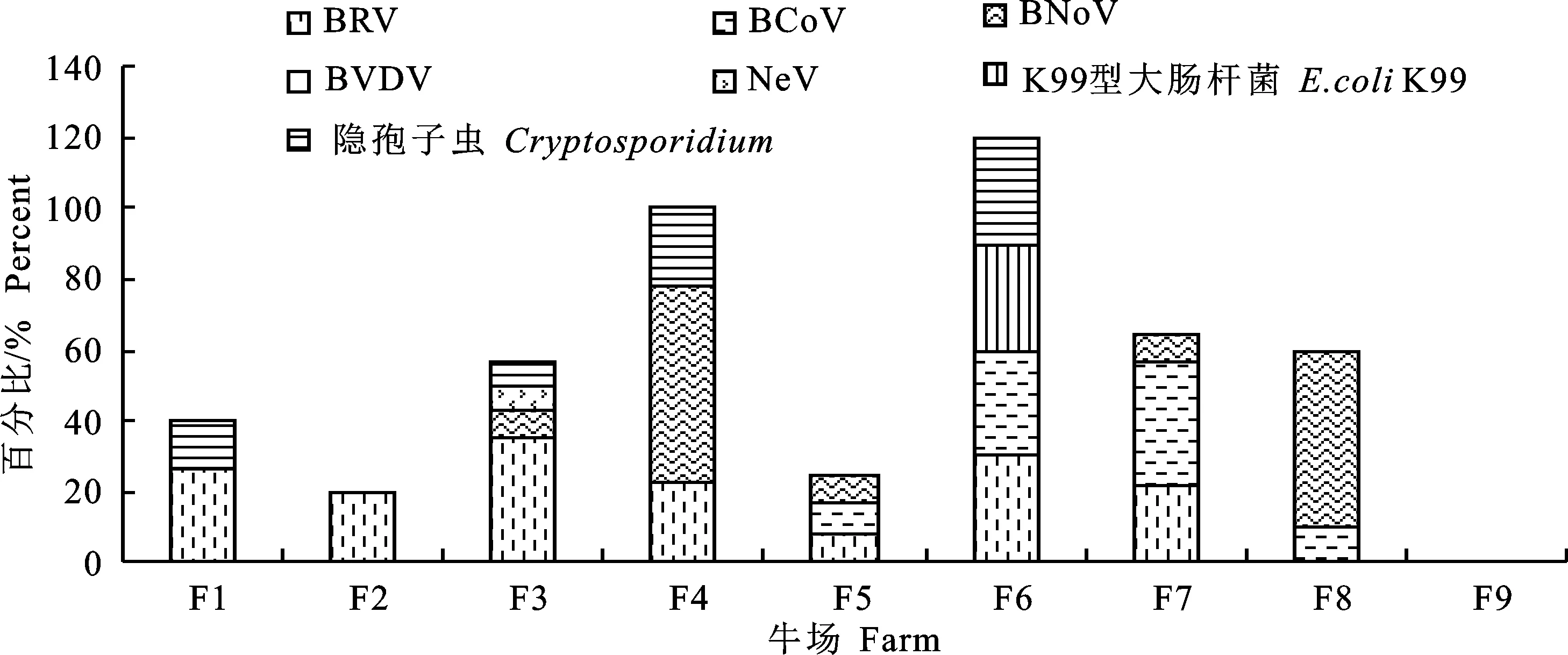
图1 9个牛场腹泻犊牛NCD相关病原检出情况
对腹泻犊牛中BRV、BCoV、BNoV和隐孢子虫等4种检出率较高的病原进行混合感染情况统计,结果如表5所示,单一病原感染的犊牛占 30.2%,2种病原混合感染的犊牛占7.55%、3 种病原混合感染的犊牛占0.94%,未出现4种病原混合感染的情况。腹泻犊牛主要为单一病原感染,其中BRV(15.1%)、BNoV(10.4%)和BCoV(4.72%)单一感染率较高,隐孢子虫在混合感染患牛中检出率较高。

表5 腹泻犊牛混合感染情况
2.2.3 不同日龄犊牛的病原检出结果 将腹泻犊牛中检出率较高的BRV、BCoV、BNoV和隐孢子虫共4种主要病原检出结果按照日龄进行分类,结果如表6所示。感染BRV、BCoV和隐孢子虫的腹泻犊牛主要在30日龄以内,感染BNoV的腹泻犊牛主要在20日龄以内。

表6 不同日龄腹泻犊牛中主要病原检出情况
2.3 NCD主要病原的遗传进化分析
2.3.1 BRV 对21个BRV阳性样品的VP6基因PCR产物进行测序。测序结果表明,获得的21个序列中有10个核苷酸序列不一致,分别为D2、D6、D8、F3、F8、K12、O2、O6、P2和Y7。VP6基因BLAST分析结果表明,所有序列都与GeneBank中已公布的轮状病毒A群VP6基因同源性最高,核苷酸序列一致性为88.8%~99.3%。遗传进化分析结果如图2所示,获得的10个BRVVP6基因与GeneBank中已公布的BRV A群遗传进化距离最近。其中D2、D6、D8、F3、F8、K12、O2、O6和P2与中国株(Bo/HB-BD/CH)聚在同一个分支上,Y7株与美国株(Hu/2011825363/USA)单独聚为一支。
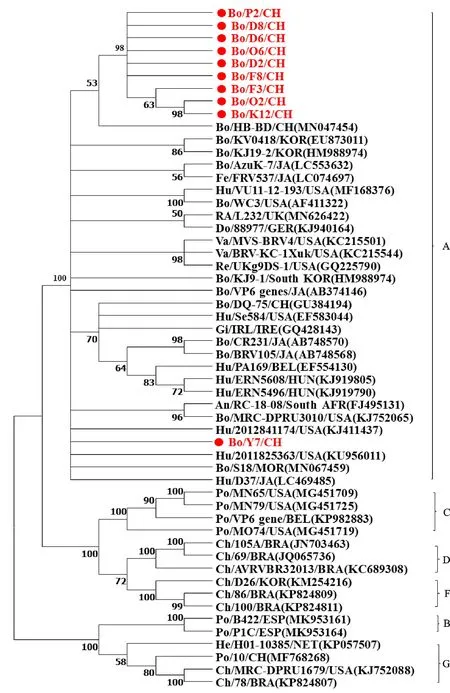
图2 基于BRV VP6基因序列构建的系统发育树
2.3.2 BCoV 对15个BCoV阳性样品的N蛋白基因PCR产物进行测序,结果表明,获得的15个序列中有9个核苷酸序列不一致,分别为C1、D5、D7、E1、E2、I5、O3、O9和O10。BLAST分析结果表明,所有序列都与GeneBank中已公布的牛冠状病毒N蛋白基因同源性最高,核苷酸序列一致性为98.9%~99.9%。遗传进化分析结果如图3所示,获得的9个BCoV N蛋白基因全部与GeneBank中已公布的BCoV N蛋白基因遗传进化距离较近。9个序列与已报道的中国株(Bo/SC1/CH、Bo/LN1/CH)和美国株(Bo/4-17-08/USA)聚在一个大的分支,但C1、D5、D7、E1、O3、O9和O10在该分支中单独聚在一个小的分 支内。

图3 基于BCoV N蛋白区域构建的系统发育树
2.3.3 BNoV 对18个BNoV阳性样品的RdRp基因PCR产物进行测序,结果表明,获得的18个序列中有12个核苷酸序列不一致,分别为A6、F7、F9、F11、F12、I1、I6、I7、I8、I10,J5和J6。BLAST分析结果表明,所有序列都与GeneBank中已公布的BNoV GⅢ.2型RdRp基因的同源性最高,核苷酸序列一致性为87.6%~ 98.4%。遗传进化分析结果如图4所示,获得的12个BNoVRdRp基因与GeneBank中已公布的GⅢ.2型BNoV遗传进化距离最近。其中A6、F7、F9、F11、F12、I1、I6、I7、I8和I10等与中国株(Bo/SCZ-18/CH)等聚在同一个分支上,J5与韩国株(Bo/MG-16/KOR)聚为一支,J6单独聚为一支,但与中国株(Bo/MI-48/CH)遗传进化距离较近。

图4 基于BNoV RdRp区域构建的系统发育树
2.3.4 隐孢子虫 对10个阳性样本的隐孢子虫SSU区域PCR产物进行测序,测序结果表明,获得的10个序列中有6个核苷酸序列不一致,分别为D1、D5、F2、H4、W2和W9。BLAST分析结果表明,D1、D5、F2和W9序列与GeneBank中已公布的微小隐孢子虫(Cryptosporidiumparvum)SSU基因的同源性最高,核苷酸序列一致性为95.7%~98.4%;H4、W2与GeneBank中已公布的牛隐孢子虫(Cryptosporidiumbovis)SSU基因的同源性最高,核苷酸序列一致性为98.5%和99.5%。遗传进化分析结果如图5所示,D1、D5、F2和W9样本序列与GeneBank中已公布的微小隐孢子虫遗传进化距离最近,H4、W2与GeneBank中已公布的牛隐孢子虫遗传进化距离最近。其中D1、D5、F2、W9等与微小隐孢子虫日本株(Ca/NCD01/JAN)、伊朗株(Bo/CPOA5/IRA)、中国株(Bo/245/CH)单独聚为一支;W2与牛隐孢子虫中国株(Bo/C90/CH、Ya/DR-2/CH)聚为一支;H4与牛隐孢子虫土耳其株(Bo/AF_CR07/TUR)、中国株(Bo/ECOST23057/CH、Bo/151/CH和Bo/GS-15/CH)、孟加拉国株(Bo/GC2/BAN)聚为一支。
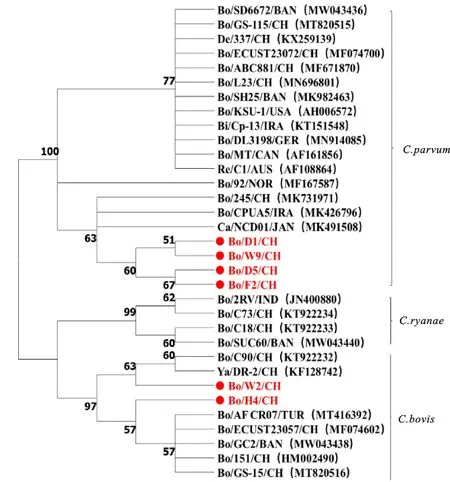
图5 基于隐孢子虫SSU区域的系统发育树
3 讨 论
3.1 新生犊牛腹泻的日龄特点
新生犊牛由于胃肠道结构发育不成熟、肠道物理屏障和生物屏障不完整、机体免疫机能不完善等原因极易受到病原体侵袭,进而发生腹泻[21]。新生犊牛日粮以牛奶为主,在犊牛出生后,如果初乳饲喂不及时、常乳消毒不彻底或饮水不清洁等都可引起NCD。此外,犊牛摄入的牛奶可为感染性病原(如BRV等)提供良好的肠道生存环境,有利于感染性病原的生存[22]。据美国乳业国家动物健康监测系统报告称,NCD多发生于1月龄以下犊牛[23]。Foster等[5]研究表明,腹泻多发于断奶前犊牛,且以1月龄以内犊牛最为常见。本研究中腹泻犊牛主要集中在1月龄内,日龄越小腹泻犊牛占比越高,与Foster等[5]研究结果一致。
3.2 宁夏NCD主要病原的流行特点
王文佳等[14]研究表明,宁夏地区腹泻犊牛的BRV、K99型大肠杆菌、隐孢子虫和贾第鞭毛虫等的检出率分别为32.28%、11.02%、25.20%和4.72%,腹泻犊牛以单一病原感染为主。李复煌[24]研究表明,北京地区犊牛腹泻感染类型以单一感染为主,轮状病毒和隐孢子虫是最主要的混合感染类型。这与本研究检测结果部分一致。国内外普遍认为引起犊牛腹泻的主要病原为BRV、BCoV、K99型大肠杆菌和隐孢子虫,而本研究结果表明宁夏地区引起NCD的主要病原为BRV、BNoV、BCoV和隐孢子虫,检出率分别为 19.8%、12.26%、9.43%和6.6%。BNoV是近年来新发现的一种病原,Cho等[21]研究表明,BNoV可侵入空肠、回肠和结肠远端上皮细胞,引起肠道上皮隐窝和小肠绒毛细胞萎缩、坏死,减少肠道可吸收面积,进而引起腹泻。王玥琳等[12-13]研究表明,腹泻粪便样本中BNoV的检出率显著高于健康粪便样本,中国四川、辽宁、河南、山东、陕西等地腹泻犊牛BNoV的检出率分别为 34.78%、75%、11.11%、9.09%、0。本研究中,半数以上的牧场中均检出BNoV,且检出率较高,表明BNoV已经在宁夏奶牛场中广泛流行。
中国犊牛腹泻发病率为9.6%~60.0%[4],但已有的研究多未对断奶前和断奶后的犊牛腹泻进行严格区分,断奶前犊牛腹泻的病原感染情况并未明确。实际生产中,断奶前犊牛与断奶后犊牛的饲养方式和养殖环境明显不同,断奶前犊牛均在独立牛棚单独饲喂,接触病原的机会相对较低,且初乳饲喂为新生犊牛的早期阶段提供了有效的被动免疫。而断奶后犊牛一般混群饲喂,接触病原机会增多,肠道病原组成可能更为复杂。因此,断奶前与断奶后犊牛肠道感染的病原类型和感染类型可能会有所不同。据报道,BRV和BCoV主要感染3周龄以内的犊牛[25],隐孢子虫主要感染15~21 d犊牛[26],BNoV主要感染2月龄内日龄较小犊牛[27],与本研究统计结果基本 相符。
3.3 NCD主要病原分子特征
根据轮状病毒VP6内壳多肽的特异性,轮状病毒被分为A、B、C、D、E、F和G等7个血清型,犊牛感染的轮状病毒主要为A型[28]。VP6基因的遗传进化分析结果表明,本研究检测到的轮状病毒均属于A型,大部分毒株与中国河北株(Bo/HB-BD/CH)聚在一支,提示本研究得到的大部分宁夏流行株与河北地区流行株同源。轮状病毒可跨种感染,BRV可感染人,并与人轮状病毒发生重组[29-30],本研究中的Y7株与人粪便分离到的美国株(Hu/2011825363/USA)聚为一支,提示该地区存在可感染人的BRV流行株,因此,加强BRV的研究具有一定的公共卫生学意义。
BCoV中编码核衣壳蛋白的N蛋白基因高度保守,常作为BCoV检测的靶基因[31]。N蛋白的遗传进化分析结果表明,本研究检测到的核苷酸序列为BCoV N蛋白基因序列,与中国四川报道株(Bo/SC1/CH)和美国株(Bo/4-17-08/USA)遗传距离较近[32],提示宁夏地区BCoV流行株可能存在国内和国际两种传播途径,应当加强本地区BCoV流行趋势的监控。
诺如病毒可分为GⅠ、GⅡ、GⅢ、GⅣ、GⅤ和GⅥ基因型,已报到感染牛的诺如病毒为GⅢ型,该型不感染人[33]。GⅢ型BNoV又可分为GⅢ.1型和GⅢ.2型,临床上以GⅢ.2型为主,但感染GⅢ.1型BNoV的病牛临床症状更为明显[25]。通过RdRp基因的遗传进化分析可对诺如病毒进行分型鉴定[34]。BNoVRdRp基因的遗传进化分析结果表明,本研究中检出的BNoV全部为GⅢ.2型,与GeneBank中收录的BNoV的RdRp片段核苷酸一致性为87.6%~98.4%。王玥琳[13]在河南、四川等地区检出的BNoV大部分为GⅢ.2型,小部分为GⅢ.1型,本研究中尚未检出GⅢ.1型BNoV。由于BNoV为宁夏地区首次检出,且检出率较高,未检出GⅢ.1型BNoV,提示应该进一步扩大该地区BNoV流行株的研究,这将对NCD的防控提供参考依据。
隐孢子虫是引起犊牛腹泻的最主要寄生虫,中国已报道的可引起犊牛腹泻的隐孢子虫包括瑞氏隐孢子虫(C.ryanae)、牛隐孢子虫、微小隐孢子虫、安氏隐孢子虫(C.andersoni)和人隐孢子虫(C.hominis)等,其中牛隐孢子虫是优势种,其次是微小隐孢子虫[35]。高海慧等[15]报道宁夏地区感染奶犊牛的隐孢子虫主要为牛隐孢子虫、微小隐孢子虫和瑞士隐孢子虫,而本研究中检测到的隐孢子虫为牛隐孢子虫和微小隐孢子虫,其中微小隐孢子虫检出率较高。但高海慧[15]的研究中未对犊牛进行严格区分,而断奶后犊牛为混群饲喂,感染隐孢子虫种类可能更多,所以本研究中检测到的隐孢子虫种类较少。据Li等[36]报道,微小隐孢子虫的检出率与犊牛日龄有关,断奶前新生犊牛粪便中微小隐孢子虫的检出率高于其他种,与本研究检测结果一致。但本研究得到的6株隐孢子虫流行株聚类较为分散,表明该地区内隐孢子虫具有丰富的遗传多样性,提示其演化方向较广,需要进一步扩大探究。
4 结 论
本研究对宁夏部分地区主要奶牛养殖园区断奶前新生犊牛进行腹泻的主要相关病原检测,对主要病原的分布和感染特点、遗传进化特征进行分析。流行病学调查结果表明,腹泻主要发生于30日龄内犊牛,BRV、BCoV、BNoV和隐孢子虫是造成该地区断奶前犊牛腹泻的主要病原,感染形式以单一病原感染为主,BRV和BNoV检出率相对较高,其中BNoV在宁夏地区首次检出。遗传进化分析结果表明,宁夏部分地区新生犊牛检出的BRV、BCoV与国内已报到的毒株基本一致,BNoV主要为GⅢ.2型,隐孢子虫主要为微小隐孢子虫,研究结果为宁夏地区新生犊牛腹泻的防控提供重要参考。
