夏季高原牧草脂肪酸与牦牛乳脂脂肪酸特征及相关性研究
2022-05-19宋雪梅
杨 静,梁 琪 ,宋雪梅,张 炎
(甘肃农业大学 食品科学与工程学院,甘肃省功能乳品工程实验室,兰州 730070)
牦牛(Bosgrunniens)是中国青藏高原最主要的反刍动物,其数量超过1400万头,占世界牦牛总数的94%以上[1],牦牛的养殖依靠天然牧场。青藏高原地处世界“第三极”,自然地理条件特殊[2],分布在青藏高原上的高原牧场具有海拔高(3000~5500m),年平均气温低(1~5℃)[3],含氧量低(是海平面含氧量的33%),强烈的紫外线辐射(是低海拔地区的3~4倍)等特点[4-5],牦牛在青藏高原牧场的放牧过程中食用多种植物物种,包括一些名贵的中药材。牦牛乳脂肪含量约为5.0%~7.2%[6]。牧民将鲜乳立即离心分离出酥油,作为食物,生活必需品等,以此来抵抗高原生活的恶劣和物资匮乏。
乳脂是一种成分极为复杂的物质,近年来,许多学者致力于揭示脂质代谢和人类疾病之间的可能联系,如糖尿病、中风、癌症、关节炎和阿尔兹海默症等[7],脂质组学在生物医学中的研究越来越广泛。许多学者研究得出乳脂肪酸的种类和数量在很大程度上取决于动物的饮食结构[8]。植物的营养价值随着海拔的升高而增加,牦牛乳脂的功效性也随着海拔的升高而增加[9],牦牛所食用的牧草是决定乳脂脂肪酸的重要原因之一。根据Patel[10]报道,以牧场为基础饮食的牛乳具有更好的营养质量,其中最重要的一点是乳脂中的多不饱和脂肪酸(PUFA)含量增加;Geurts等[11]研究发现乳脂脂肪酸的功效性成分,如PUFA、共轭亚油酸(CLA)和反式脂肪酸(TFA)在人体中起着抗病因子或预防因子的作用;有学者研究探讨了奇数碳支链脂肪酸(OBCFA)作为瘤胃发酵和瘤胃细菌标记物的潜力[12]。
牦牛作为青藏高原特有的物种,青藏高原独有的环境和季节影响到不同地区牧草脂肪酸的多样性和营养性,高原牧场中的牧草与乳脂有着密切的联系,对乳脂脂肪酸的形成有着重要的作用。关于青藏高原夏季的牧草脂肪酸与牦牛乳脂脂肪酸究竟以什么程度呈现怎样的联系至今未见报道。本试验分别以青海省海北藏族自治州祁连县和甘肃省甘南藏族自治州夏季牧场盛草期的牦牛乳脂和牧草作为研究对象,探索乳脂脂肪酸组成特征与牧草脂肪酸之间的关系,有利于今后牦牛乳脂质组学的深入研究和应用。
1 材料与方法
1.1 材料与试剂
牦牛乳脂:分别于2019年7月采自青海省海北藏族自治州祁连县和甘肃省甘南藏族自治州合作市(海拔均在3 000 m左右),以酥油的形式采取。全程冷链运输并置于-80 ℃下贮藏,进行脂肪酸分析。
高原牧草:牧草样本2019年7月采集青海省海北藏族自治州祁连县和甘肃省甘南藏族自治州合作市(具体情况见表1),采样地距离公路300 m以外的夏季牧草(盛草期)采取草样,采用五点采样法,面积为1 m2,随机采样。将采取的牧草全程冷链运输,置于-80 ℃下贮藏,进行脂肪酸 分析。
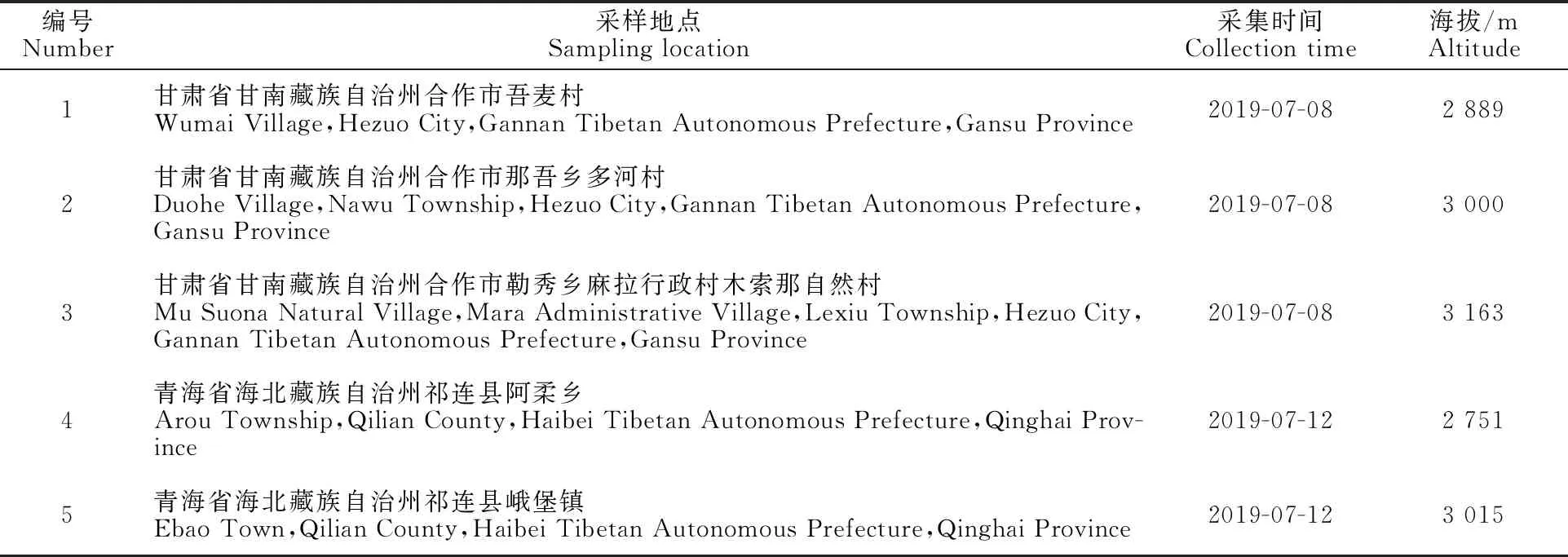
表1 牧草采集信息
试验试剂:氯仿、甲醇、氢氧化钾、三氟化硼-甲醇、乙醚(色谱纯)、正己烷(色谱纯)(除注明试剂外,其余试剂均为分析纯)。
1.2 试验仪器
GC-MS、水浴锅、RE52-98旋转蒸发仪、粉碎机。
1.3 方 法
1.3.1 草样脂肪酸的测定 草样脂肪酸提取测定方法按照罗婧等[13]方法进行,具体操作步骤如下:将草样进行粉碎,取样10 g左右,添加提取液(氯仿∶甲醇=2∶1),超声提取30 min,抽滤,转至分液漏斗,添加40 mL 1%的NaCl溶液,静置过夜,得下层有机相,于50 ℃水浴减压浓缩至干,浓缩后的脂质提取物用5 mL正己烷溶解并添加5 mL 1 mol/L KOH-甲醇溶液,盖塞于 50 ℃水浴甲酯化40 min,甲酯化结束后冷却,添加 5 mL正己烷和15mL 5%HCl溶液进行分层,取上层有机相(正己烷层),经0.22 μm滤膜过滤后供GC-MS测定。
1.3.2 乳脂脂肪酸的测定 (1)样品前处理及脂肪酸甲酯化操作步骤:乳脂样品前处理及脂肪酸甲酯化操作步骤按照巨玉佳等[14]的方法,并稍作改进,具体操作步骤如下:
①取样,112.5 mL氯仿和37.5 mL甲醇混合液溶解样品,均质,过滤后加入25 mL饱和NaCl,摇匀,放置5 min,取下层液,无水硫酸钠脱水,静置,用氯仿-甲醇溶液(体积比3∶1)洗涤无水硫酸钠,抽滤。在40 ℃下旋转蒸发浓缩。
②加入2 mol/L的NaOH-甲醇溶液100 mL,在50 ℃水浴15 min,立即加入2 mol/L的HCl溶液 100 mL,加入50 mL乙醚,静置,得上层有机相。
③加入5 mL三氟化硼-甲醇溶液,60 ℃水浴1 h,冷却后用10 mL乙醚萃取两次,合并萃取液加10 mL蒸馏水再进行二次萃取,取上清液,浓缩至2 mL,待GC-MS分析。
(2)GC-MS参数 气相色谱6890N;弹性石英毛细管柱为SE-54,30 m×0.25 mm×0.25 μm;气化室温度250 ℃,程序升温:80~290 ℃,升温程序:80 ℃保持1 min,以8 ℃/min升至280 ℃,保持30 min;载气:He;载气流量:1.2 mL/min;压力2.4 kPa,线速度:40 cm/s;容积延迟:3 min;进样量:1 μL。分流比:50∶1。质谱为5973N四级杆质谱仪;离子源:电子轰击离子源;离子源温度:230 ℃;传输线温度150 ℃;离子源电离能:70 ev;质量扫描范围m/z:33~660各组分经过GC-MS分析,各峰对应的质谱图与仪器数据库对照检索,确定化合物类型,用面积归一化法确定各脂肪酸成分的相对含量。
1.4 数据分析
所有数据均采用 Excel 2016进行处理,各项指标的结果均采用3次重复平均值标准误差(SE)表示,用 SPSS 19.0 进行相关性分析。
2 结果与分析
2.1 两地区牧草脂肪酸组成与含量
对于青藏高原的牦牛来说,牧草是直接影响其脂肪酸含量和种类的重要因素之一,在近些年来,改变牛的饮食结构以调整牛乳中脂肪酸的含量和比例受到了越来越多学者的关注。有研究报道,一些脂肪酸在体内表达的升高可显著增加体内甘油三酯的沉积,进而影响体脂含量[15]。脂肪酸的体内活性表达和mRNA表达受饮食的调控[16],动物所食用的牧草作为人体健康改善的最初源头,现代研究重视牧草在动物体内的表达活性及对乳脂脂肪酸的调控作用。
通过鉴别所采取的牧草,海北牧草的主要种类有矮嵩草、蕨麻、毛茛、针茅、披碱草和珠芽蓼;甘南牧草的种类主要是蕨麻、棘豆、扁蓿豆和早熟禾。通过图1可知,采取的牧草样本中海北牧草中共检测出28种脂肪酸,甘肃甘南牧草中检出33种脂肪酸,均未检出短链脂肪酸(SCFA),中链脂肪酸(MCFA)分别检出10种和12种, 长链脂肪酸(LCFA)分别检出18种和21种,由图2可知两地区LCFA分别占到总脂肪酸含量的 79.76%±0.88%和47.50%±0.31%。海北牧草和甘南牧草中PUFA含量差异较大 (72.12%±0.95%和 8.39%±0.04%)。海北牧草中的优势脂肪酸为亚麻酸(36.66%±0.85%),亚油酸(34.37%±0.70%)和棕榈酸(15.64%± 0.57%),占总脂肪酸的86.67%;Cui等[17]明确指出,牦牛食用的牧草脂肪酸中亚麻酸、亚油酸和棕榈酸占高山植物总脂肪酸的83%,与本试验得出的结论相当。甘肃甘南牧草中优势脂肪酸为棕榈酸(20.67%±0.88%)、Z-11-十六碳烯酸 (15.54%±0.02%)和6-十八碳烯酸(9.87%±0.19%),占总脂肪酸的46.08%。在采集的样本中,无论是海北还是甘南的牧草中,其不饱和脂肪酸(UFA)所占的比例均高于饱和脂肪酸(SFA)(图2)。Clapham等[18]指出牧草中的主要脂肪酸是肉豆蔻酸、棕榈酸、棕榈油酸、硬脂酸、油酸、亚油酸和亚麻酸。亚麻酸是CLA和ω-3 PUFA的前体,可以增加乳脂中PUFA的含量以提高牛乳的品质[19]。发现PUFA的差异在两个地区也很明显。PUFA是植物细胞膜的重要组成部分,其组成变化影响高寒植物的细胞和生理过程。脂肪酸去饱和酶(FAD)是植物合成PUFA的关键酶,也是植物抗胁迫作用中的重要酶类[20]。目前在植物中已经鉴定出两类FAD:酰基载体蛋白(ACPs)和酰基脂质或膜结合的FAD。前者迄今为止只在植物中被发现[21]。当植物暴露在低温下时,去饱和酶的变化和耐寒性有关[22]。细胞膜作为冷诱导损伤的主要部位,一旦环境温度下降,植物会启动冷适应,从而激活保护细胞膜流动性的机制,通过改变PUFA的水平来调节膜脂流动性的能力是物种适应冷反应的一个特征[23]。所以,高原植物PUFA的含量也间接反映了地区的高寒程度。青海海北地区的年平均气温 (-1.6 ℃)较甘肃甘南地区的年平均气温 (1.7 ℃)低3.3 ℃,海北州夏季日均最低气温 1 ℃,甘南州夏季日均最低气温为7 ℃,相差 6 ℃;海北州夏季日均最高气温15 ℃,甘南州夏季日均最高气温为11 ℃,相差4 ℃。推测这也是造成两地区牧草中PUFA含量差异大的原因之一。饮食结构中的脂肪酸,尤其是不饱和脂肪酸,可抑制体内脂肪酸的活性,其抑制作用与不饱和脂肪酸的含量,饱和程度,链长,双键位置等因素有关[24]。
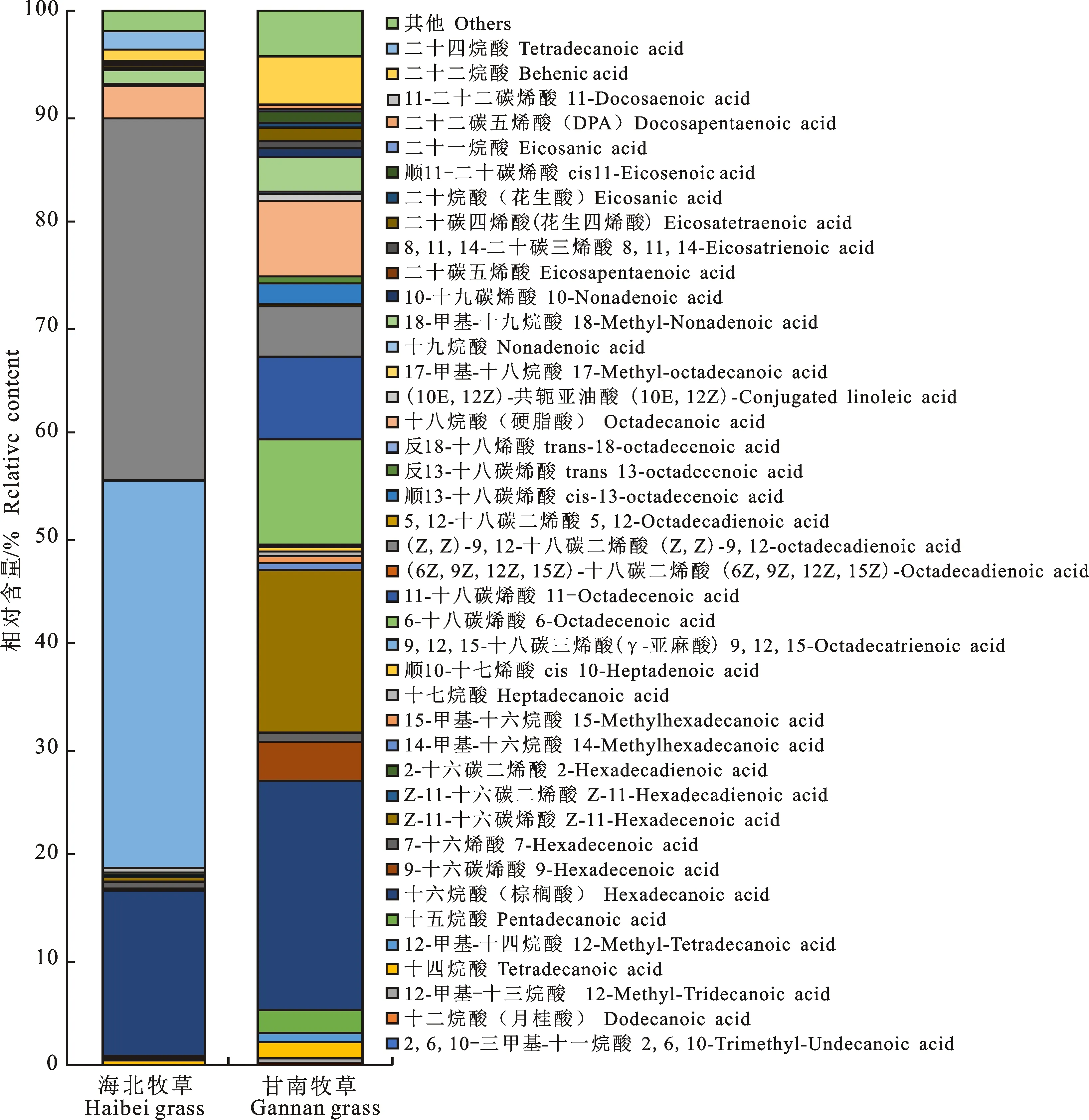
图1 不同地区牧草脂肪酸组成与相对含量
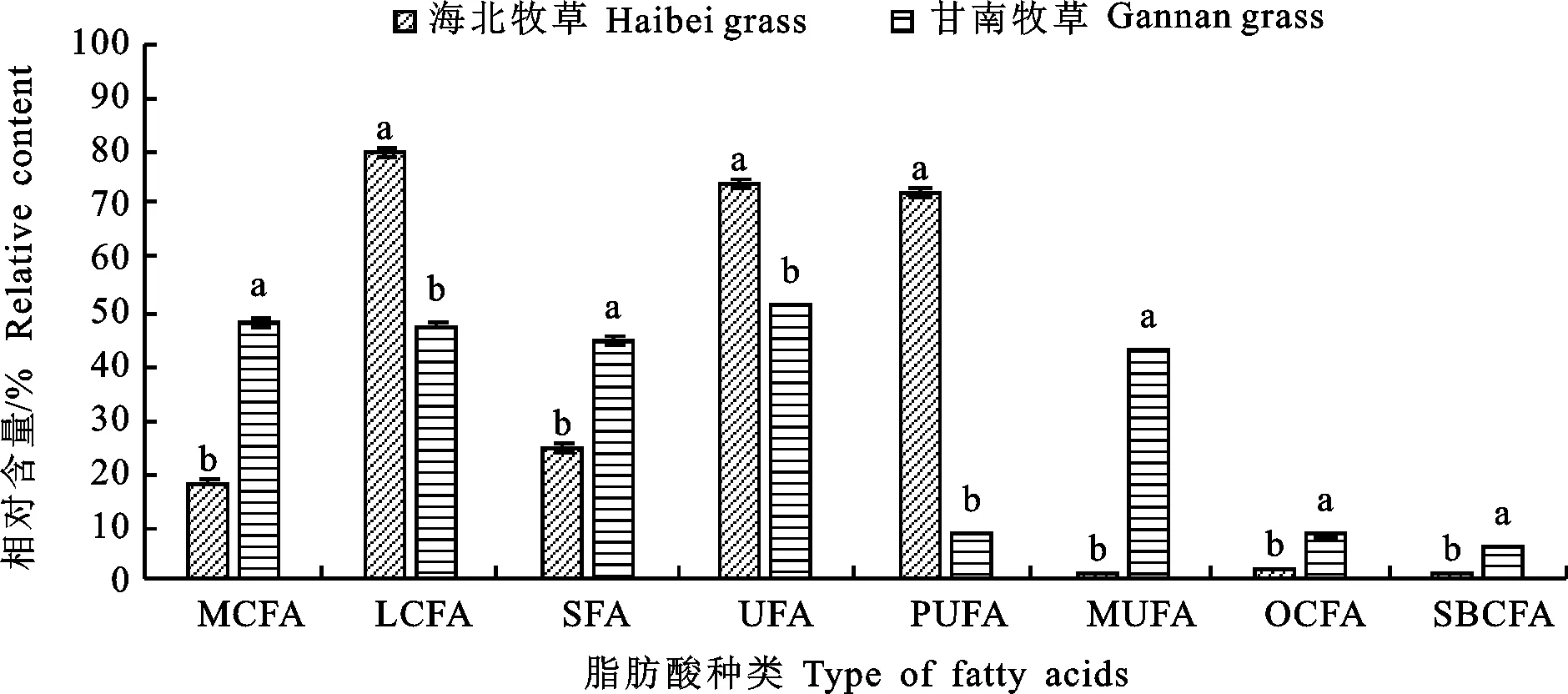
不同小写字母表示差异显著(P<0.05),下同
2.2 酥油脂肪酸组成与含量
2.2.1 青海海北牦牛酥油脂肪酸组成与含量 牛的乳脂是人类饮食中反刍动物脂肪的主要来源,乳脂富含的脂肪酸和其他促进健康的因子是全世界研究的重点。富含PUFA的饲料,可能会增加反刍动物生物氢化过程中FA中间体的形成,如反10,顺12- 十八碳二烯酸和顺9,反11-十八碳二烯酸[25],这些都是提高乳脂品质水平的脂肪酸,这一点在本研究中得到了很好的验证。
由图3与图4可见,在青海海北酥油中共检测出脂肪酸37种,其中,PUFA相对含量为 5.01%±0.03%,奇数碳链脂肪酸(OCFA)相对含量为3.30%±0.04%,支链脂肪酸(SBCFA)相对含量为 2.09%±0.02%。在海北酥油中,十六烷酸,Z-9-十八碳烯酸(油酸),十八烷酸为优势脂肪酸。Neupaney等[26]报道牦牛黄油中主要SFA为C16∶0、C18∶0、C14∶0。从C4∶0到C16∶0的脂肪酸,尤其是C16∶0,都被认为是反刍动物乳腺内从头合成的产物[27]。
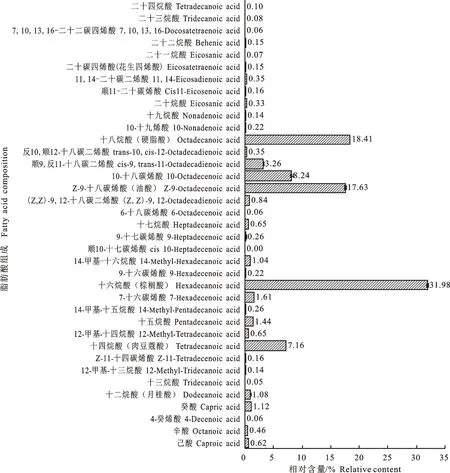
图3 海北酥油脂肪酸组成与相对含量
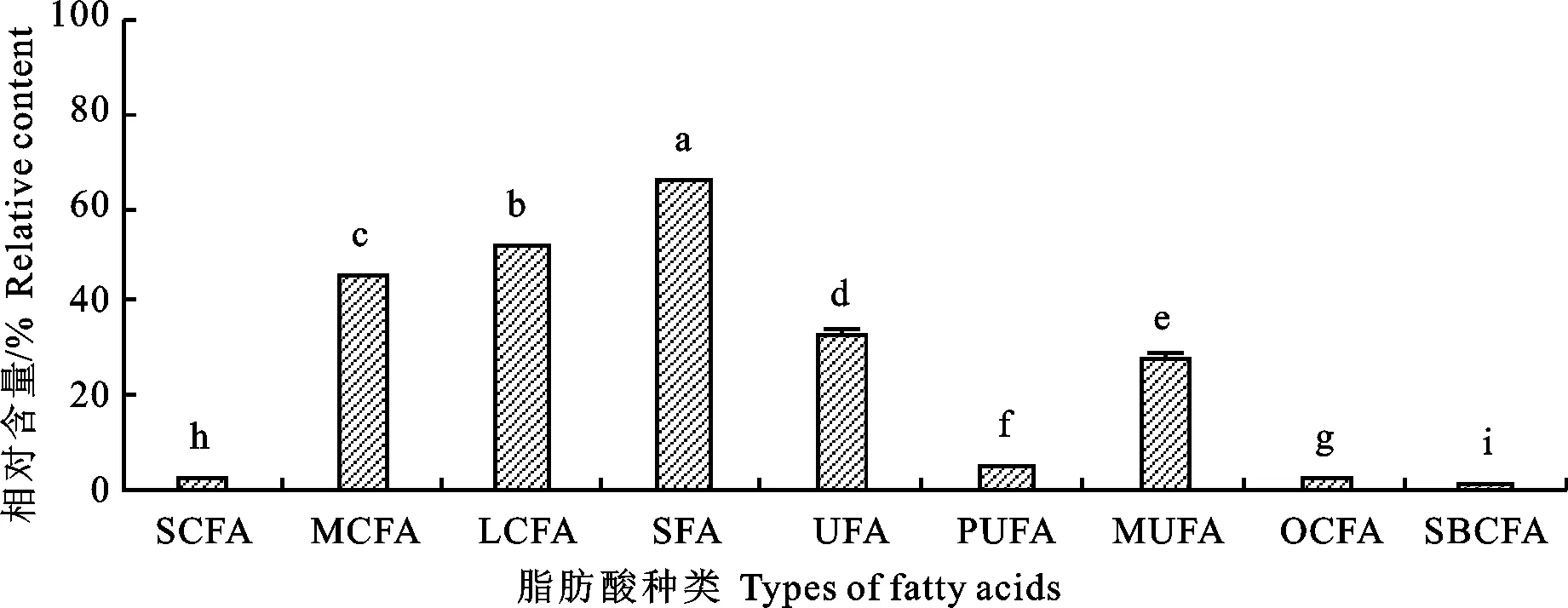
图4 海北酥油脂肪酸种类与相对含量
棕榈酸和硬脂酸是酥油中最丰富的脂肪酸,这与牧草中亚麻酸含量高有关,亚麻酸通过牛的瘤胃的生物氢化反应生成棕榈酸和硬脂酸。有学者指出这类脂肪酸作为食物对人体来说可能是有利的,因为C18∶0对人血清胆固醇浓度的影响是中性的,不会增加低密度脂蛋白(LDL)和高密度脂蛋白(HDL),因此不会增加心血管疾病的风险[28]。此外,当人体摄入硬脂酸时,可以将 C18∶0转换为C18∶1,这被认为是对人体健康有益的[29]。除了棕榈酸和硬脂酸,在海北酥油中的另一个优势脂肪酸是Z-9-十八碳烯酸,其成为优势脂肪酸的原因是牦牛瘤胃中微生物种群的作用。根据Mckain等[30]的说法,在牛的瘤胃中,细菌丁酸弧菌属执行生物氢化的最后一步会将瘤胃中的反11-C18∶1 FA和反10-C18∶1 FA转化为硬脂酸,由于PUFA的抑菌作用,瘤胃中的微生物种群减少可能再以硬脂酸为代价促进C18∶1的积累,在消化和吸收之后,这些瘤胃衍生的脂肪酸可以进入乳脂中[31]。Z-9-十八碳烯酸是一种单不饱和Omega-9脂肪酸,是人体所需的重要营养脂肪酸之一,它可以降低人体胆固醇和人类患乳腺癌的风险,但是在由于瘤胃中的还原性环境较高,牧草中的“单不饱和”脂肪酸很容易“被饱和”,但Z-9-十八碳烯酸在海北酥油中作为优势脂肪酸,进一步验证了牦牛瘤胃相对于其他反刍动物瘤胃来说,其瘤胃环境存在差异[32]。值得注意的一点是,海北酥油中顺9,反11- 十八碳烯酸的相对含量较高,占到总脂肪酸的3.26%± 0.02%。有研究指出这种脂肪酸作为一种生物活性化合物存在于天然牛乳脂肪中,对人类的健康有着积极的影响,例如抗癌作用,抑制II型糖尿病以及免疫调节特性,它和反10,顺12-十八碳烯酸是由亚油酸在瘤胃中进行的部分生物加氢反应产生的[33]。
2.2.2 甘肃甘南牦牛酥油脂肪酸组成与含量 由图5和图6可知,在甘南酥油中共检测出肪酸34种,其中,PUFA相对含量为7.64%±0.12%, OCFA相对含量为4.17%±0.03%, SBCFA相对含量为1.81%±0.03%。在甘肃甘南酥油中,十六烷酸、Z-9-十八碳烯酸(油酸)、十八烷酸为优势脂肪酸。由图7可见,虽然两地区牧草脂肪酸种类与含量相差较大,但是酥油脂肪酸各种类的相对含量却呈现出高度类似,这进一步说明青藏高原牦牛的瘤胃和代谢机制主导了乳中优势脂肪酸。其中,在甘南酥油中的PUFA较海北酥油高出了2.63个百分点,但是在牧草中海北的要比甘南的高得多(高出63.73%),这是因为反刍动物乳脂中的PUFA含量主要取决于瘤胃的生物氢化率以及摄入脂肪酸的净含量和组成[34]。如果瘤胃的生物氢化率较高,PUFA通常完全氢化为硬脂酸,因此,PUFA转化为硬脂酸的含量也间接表明反刍动物瘤胃氢化程度[35]。牧草中的C18∶3 n-3成为了牦牛乳腺合成PUFA极好的前体物质[36-37]。与海北酥油相比,甘南酥油PUFA水平较高,这是由于牦牛瘤胃的生物氢化作用造成的;此外,从两地区酥油中SFA/UFA的比例可以发现,甘南牦牛瘤胃的生物氢化率也是较低的(生物氢化率高,SFA相对含量高)。在甘南酥油中发现UFA,尤其是PUFA含量均高于海北酥油,这可能是由于牦牛的瘤胃生物氢化率存在差异,也就是说有可能甘南牦牛瘤胃的部分氢化作用更强,而海北牦牛瘤胃中的完全生物氢化作用更强,这也是造成海北酥油中UFA较甘南酥油低(36.22%±1.58% 和 33.62%± 0.05%)的可能原因之一。甘南酥油中OCFA的含量 (4.17%±0.03%)比海北酥油(3.30%± 0.04%)的高。OCFA具有较强的生理活性,尤其是抗癌活性[38]。SBCFA一般来源于瘤胃细菌,主要存在于细菌脂膜中[39],在乳腺脱氢酶的作用下,OCFA会进一步代谢,被视为一种具有抗诱变特性的脂肪酸[40]。有研究得出牦牛与平原地区的其他反刍动物相比,牦牛瘤胃中可能存在一个独特的瘤胃微生物种群,正是因为两个地区牦牛所处的高原环境不同,所食用的牧草种类不同,引起瘤胃微生物种群的不同,进而造就了两个地区不同的乳脂脂肪酸[41]。
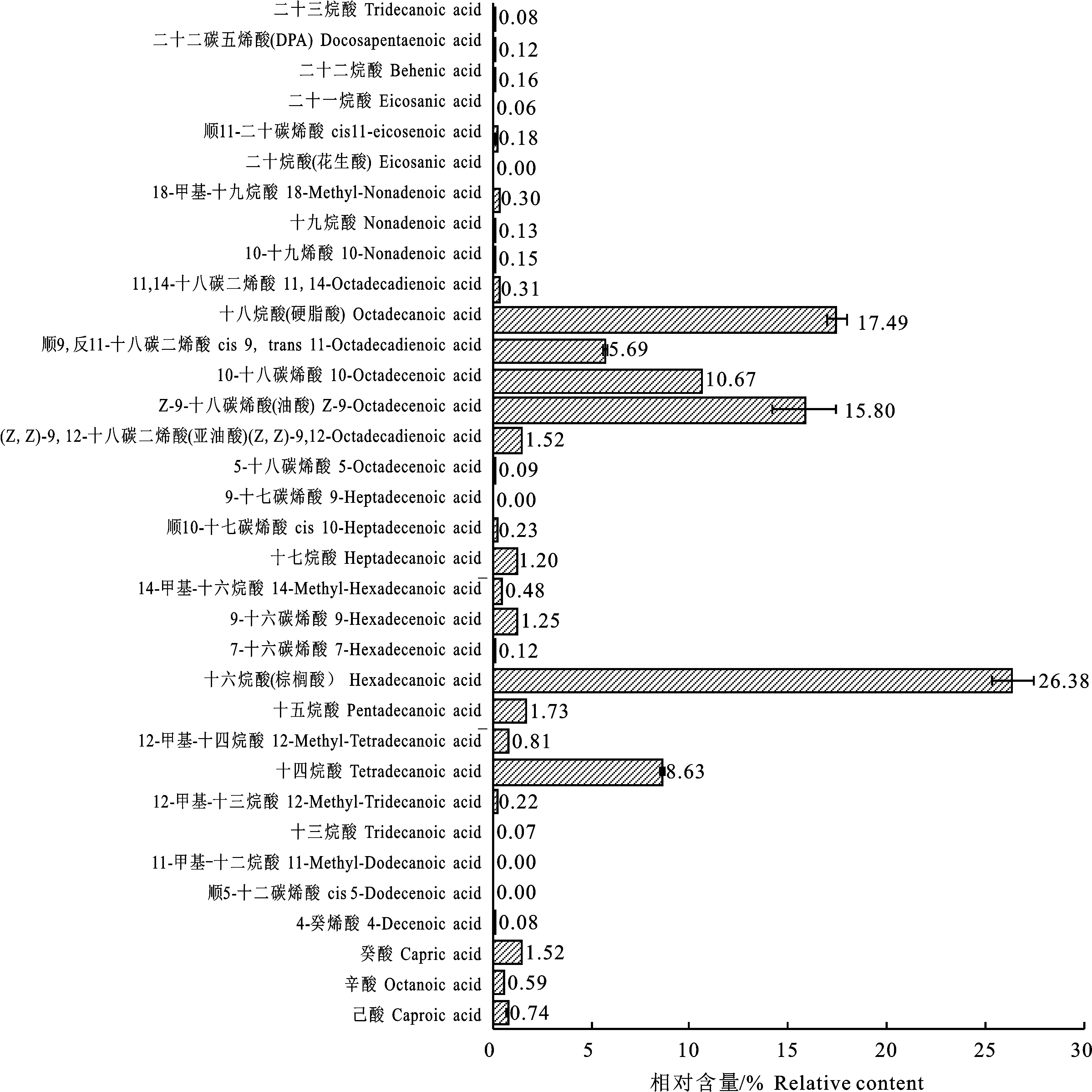
图5 甘南酥油脂肪酸组成与相对含量
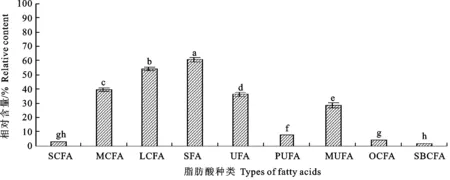
图6 甘南酥油脂肪酸种类与相对含量
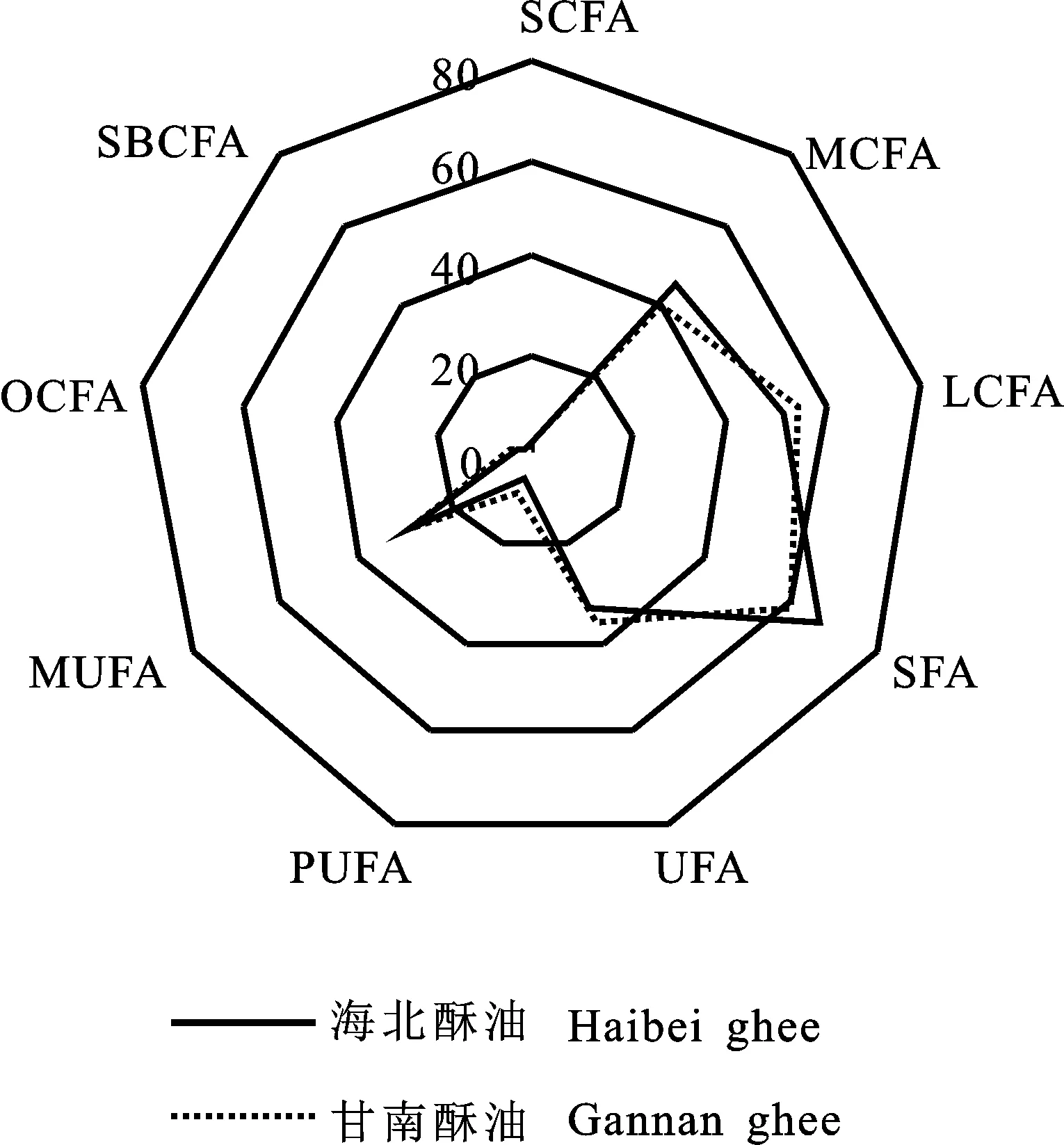
图7 两地区酥油脂肪酸种类与相对含量
2.3 相关性分析
2.3.1 海北地区牧草与新鲜乳脂脂肪酸相关性 根据文献报道,草食动物并不随意吃草,而是有明显的食物偏好[42],这种偏好通常是由两个因素引起的,即植物的营养和有毒成分[43],动物在这两个因素之间会权衡。因此,牦牛在植物营养丰富的天然牧场中对此选择更加多样化。在表2的相关性研究中,我们发现海北地区牧草中LCFA与酥油中LCFA的含量呈现正的强相关(R= 0.86),有文献指出LCFA含量随着牧草的增加而显著增加(P<0.001)[44]。牧草和酥油中的OCFA呈现负的强相关,相关系数为-0.97;SBCFA也呈现强的负相关,相关系数为-0.99,有学者发现牧草中的OBCFA以补充富含亚油酸的食物可能会改变瘤胃发酵模式,减少细菌和OBCFA向十二指肠的流动从而降低血浆和牛乳中OBCFA的水平[45]。
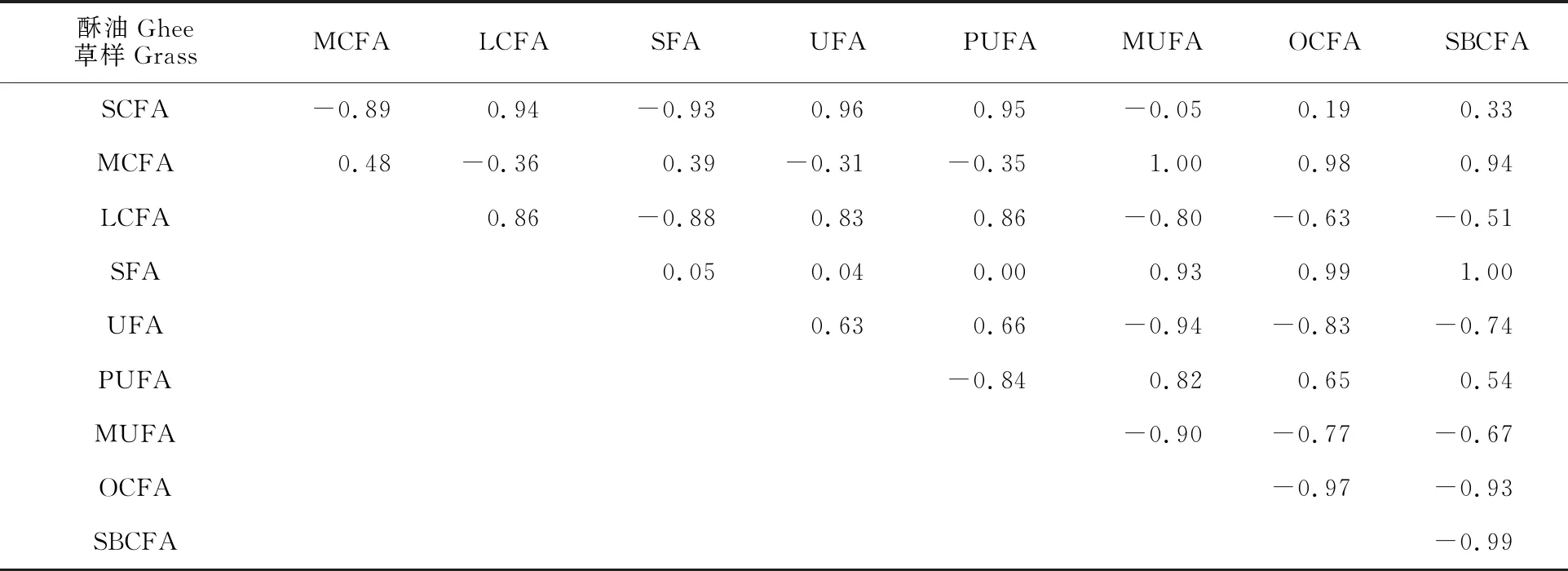
表2 海北地区牧草脂肪酸与酥油脂肪酸相关性
2.3.2 甘南地区牧草与新鲜乳脂脂肪酸相关性 由表3可以看出,甘南地区牧草和酥油中的UFA呈现极强的负相关性(R=-0.96),而与SFA呈现极强的正相关性(R=0.97)。在前面可以看到,在甘南地区牧草中UFA占到总脂肪酸的51.24%,但是酥油中UFA却只占到 36.22%,而SFA占到60.59%,这是因为在牧草中的任何不饱和脂肪酸一旦成为游离脂肪酸就会受到瘤胃细菌的生物氢化作用,其终产物都是C18∶0。微生物油脂的从头合成也发生在瘤胃中,在细胞合成过程中,饱和与不饱和的游离脂肪酸都可能被微生物利用,由于这些微生物的转化,瘤胃脂质和瘤胃消化系统中所含的脂肪酸与饲料中所含的脂肪酸不大相同,之后便代谢到全身组织,包括乳腺,造成乳脂中C18∶0显著丰富[46]。牧草中PUFA和单不饱和脂肪酸(MUFA)与酥油中PUFA均呈现一定程度的相关性,这是因为牧草作为牦牛的唯一饲料来源提供了乳脂中PUFA的可持续来源[47],证实了牧草饲喂的牦牛乳脂具有一定的优越性。
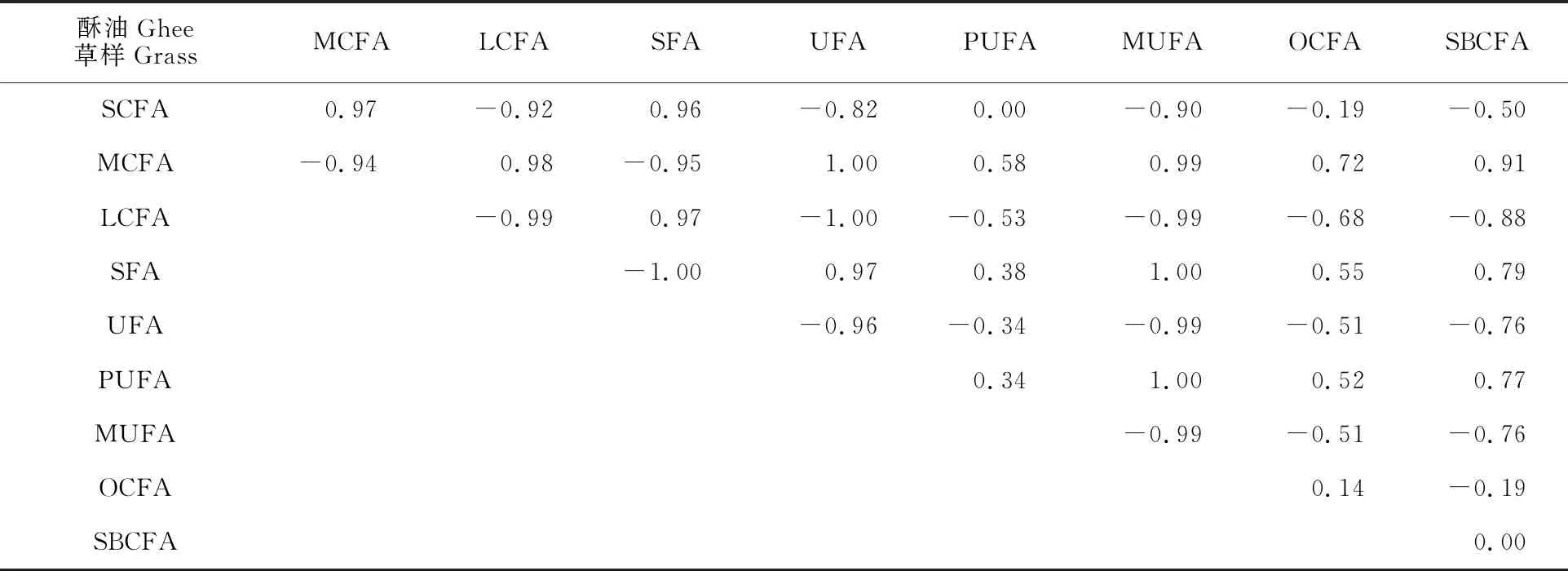
表3 甘南地区牧草脂肪酸与酥油脂肪酸相关性
综上,以夏季高原牧草为日粮的牦牛,其乳脂脂肪酸呈现一定的优越性,这与牧草中含有的多不饱和脂肪酸有很大的关系。但是,乳脂中脂肪酸的种类与含量还与牦牛瘤胃环境相关,牦牛瘤胃的生物氢化作用和瘤胃微生物的种类含量对牧草和乳脂脂肪酸的相关性有较大的影响,本文未进行牧草—瘤胃—乳脂三者之间的脂肪酸关系研究,这也是接下来亟待解决的问题,该问题的解决将进一步推动乳品产业的发展,对乳制品品质的调控具有重要影响。
3 结 论
本研究探讨青藏高原两个不同地区(青海海北和甘肃甘南)牧草脂肪酸和牦牛乳脂脂肪酸情况及其相关性,研究发现两地区牧草和酥油脂肪酸存在差异,但高原地区两种酥油的脂肪酸出现种类及相对含量的类似模式;对应地区的牧草与脂肪酸呈现一定的相关性,但是一些脂肪酸却因为生物氢化的作用减弱了其相关性,是海北和甘南地区牦牛瘤胃微生物种类和数量存在差异性造成的;在相关性研究中我们发现甘南地区牧草和酥油中的PUFA相关性有效地证实天然牧草对牦牛乳脂功能活性及营养的优越贡献。通过分析两个不同地区牦牛乳脂和牧草脂肪酸的相关性和差异性,本研究阐述了相关性和差异性的来源,为牦牛乳制品品质控制具有重要意义。
