阿帕替尼联合放疗对晚期食管癌患者血清肿瘤标志物水平的影响
2022-05-14高天慧张秀娟张雪娣
高天慧,张秀娟,张雪娣
(鹤壁市人民医院药学部,河南 鹤壁 458030)
食管癌是临床上最常见的消化道恶性肿瘤,是食管上皮异常增生引起的恶性病变。食管癌可以分为早、中、晚期,其中早中期患者体内癌细胞无扩散或转移的现象,所以及时手术便可治愈;而晚期食管癌大部分因压迫或者并发症引起,使患者出现吞咽困难、营养不良、昏迷等症状,长期发展下去癌细胞侵犯其他器官,淋巴结出现转移,导致患者慢慢濒临死亡[1-2]。目前,临床上对于晚期食管癌患者通常采用放化疗,但长期放化疗对人体有一定的副作用,放射线和化学药物在杀死癌细胞的同时也会损伤患者体内正常细胞,影响治疗效果。而本研究中阿帕替尼是一种抗血管生成靶向药物,通过阻断对肿瘤细胞内营养和氧气的补给,达到对肿瘤细胞生长或转移的遏制[3]。基于此,本研究分析阿帕替尼联合放疗对晚期食管癌患者血清肿瘤标志物水平的影响。
1 资料与方法
1.1 一般资料
选取2018年3月至2020年3月鹤壁市人民医院收治的晚期食管癌患者97例,采用随机数字表法将患者分为对照组48例和观察组49例。对照组男25例,女23例;年龄49~70岁,平均(63.54±5.48)岁;临床分期:Ⅲ期29例,Ⅳ期19例;病变部位:上段15例,中段21例,下段12例。观察组男27例,女22例;年龄50~70岁,平均(62.08±4.63)岁;临床分期:Ⅲ期28例,Ⅳ期21例;病变部位:上段16例,中段20例,下段13例。两组患者的一般资料比较差异无统计学意义(P>0.05)。本研究经本院医学伦理委员会审核批准。
纳入标准:①肝、肾功能正常者;②通过胃镜和病理检查等确诊为鳞状细胞食管癌[4];③没有放化疗禁忌证;④签署知情同意书。
排除标准:①有严重心、肝、肺、肾功能不全者;②血常规指标异常者;③对阿帕替尼药物过敏者;④食管出现出血或穿孔者。
1.2 方法
两组患者均保持健康饮食,营养护理的基础治疗。对照组采用同步放化疗。①放疗:患者取仰卧位,采用真空负压垫对患者体位进行固定,使用能量为7MV-X射线外照射,采用螺旋CT连续扫描,根据CT扫描结果来确定扫描范围,包括双肺、食管。医师根据结果大致勾画单层或多层靶区,计算出几何中心,然后对中心进行放疗,总剂量为60 Gy,2 Gy/d。②化疗:使用顺铂(齐鲁制药有限公司,国药准字:H20073652,规格:10 mg)进行静脉滴注,化疗3周为1个周期,4个周期为1个疗程。观察组在放疗的基础上使用阿帕替尼(江苏恒瑞医药股份有限公司,国药准字:H20140103,规格:0.25 g×10片)治疗,餐后30 min口服,开始0.75 g/次,1次/d,观察患者不良反应发生率,根据患者耐受性来调整用药剂量。
1.3 观察指标
①临床疗效。采用WHO实体瘤客观疗效评定标准[5]:完全缓解(CR);部分缓解(PR);疾病稳定(SD);疾病进展(PD)。临床总有效率=(部分缓解+完全缓解)例数/总例数×100%。②血清肿瘤标志物。采用全自动化学发光免疫分析仪(SIEMENS系列)检测癌胚抗原(carcinoembryonic antigen,CEA)。糖类抗原125(carbohydrate antigen 125,CA125)和糖类抗原199(carbohydrate antigen 199,CA199)送至上级医院检测。③不良反应。对比两组患者治疗期间产生胃肠道反应,肝、肾功能损伤及脊髓抑制。
1.4 统计学方法
2 结果
2.1 临床疗效
治疗后,观察组总有效率57.14%高于对照组47.92%,但两组比较差异无统计学意义(P>0.05),见表1。

表1 两组临床疗效比较(n,%)
2.2 血清肿瘤标志物
治疗前,两组患者CA199、CEA及CA125水平比较差异均无统计学意义(P>0.05);治疗后,观察组中CA125、CA199及CEA水平较对照组低,但两组比较差异均无统计学意义(P>0.05),见表2。
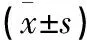
表2 两组血清肿瘤标志物比较
2.3 不良反应
两组患者在治疗过程中均出现不良反应,其中观察组中脊髓抑制、肝、肾功能损伤及胃肠道反应的发生率均比对照组低,两组比较差异有统计学意义(P<0.05),见表3。
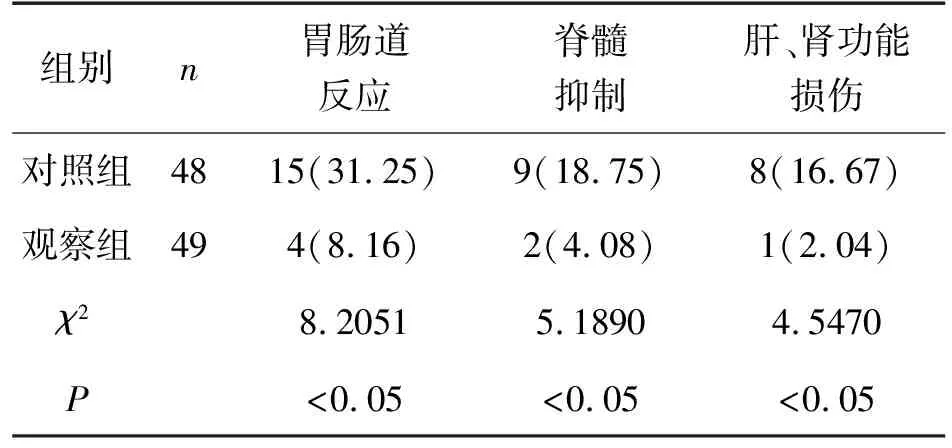
表3 两组不良反应比较(n,%)
3 讨论
在临床上食管通常有三段狭窄之处,其中食管癌好发于第二、三狭窄处,主要由饮食的刺激和病毒的侵入造成。一般早期食管癌患者会出现吞咽困难,食道堵塞等症状,但症状或轻或重,发展缓慢。当患者进入晚期时食物变得难以下咽,痰液增多,还会出现消瘦、无力、营养不良、持续胸痛等症状,久而久之癌细胞便在体内出现转移或扩散等现象,如不加以治疗,病情便会日益加重,缩短患者寿命[6]。目前,临床上对于晚期食管癌患者一般采取放疗和化疗相结合的治疗方法。放疗是指利用一种或多种放射线对患者的恶性肿瘤进行辐射;而化疗是选择一些化学药物进行治疗,其中顺铂是常用的化疗药物。二者联合使用可以阻止体内癌细胞的增生、扩散及转移,从而来延长患者生存期,但同步放化疗的不良反应较多,在杀死癌细胞的同时,体内的正常细胞也会受到影响[7]。阿帕替尼是一种口服的抗血管生成靶向药物,它不仅可以抑制肿瘤细胞的增生与扩散,而且不良反应较少[8]。
食管癌通常有食管腺癌和鳞癌,早期食管癌症状不明显,一般患者确诊为食管癌,则已进入中晚期。晚期食管癌患者在临床上主要以延长患者生存期为目的来进行治疗,其中癌细胞出现增生、扩散和凋亡时均会影响体内蛋白质,激素等水平。血清肿瘤标志物中CEA、CA199及CA125均可以反映肿瘤的组织变化,其水平的高低也可反映出肿瘤的预后效果,从而帮助对肿瘤进行诊断、分类及临床治疗指导[9]。本研究结果发现,治疗后观察组中血清肿瘤标志物水平低于对照组,且观察组总有效率高于对照组,但两组比较均无统计学意义,说明同步放化疗和阿帕替尼联合放疗都可以降低血清肿瘤标志物水平并且两种方法治疗效果相当。对照组患者采用同步放化疗,放疗采用螺旋CT连续对肿瘤进行扫描,利用电离辐射来抑制和杀灭肿瘤内的癌细胞,在此基础上使用顺铂进行化疗。顺铂是一种金属铂类络合物,低氯环境下在细胞内可以迅速解离,采用水合阳离子的形式与细胞中DNA发生结合,以此来破坏DNA的功能与结构,达到控制肿瘤生长的作用[10]。研究表明,同步放化疗虽然有明显的抗肿瘤作用,但在治疗过程中难免会对人体正常细胞造成一定的辐射或损伤,且化疗采用的化学药物的不良反应较多。观察组中采用的阿帕替尼是我国自主研发上市的一种抗血管生成小分子靶向药物,是继标准化治疗失败后,疗效最好且安全的单药。阿帕替尼可以抑制酪氨酸特异性蛋白激酶的生成,可以选择性与血管内皮生长因子受体2结合,来阻断信号的传导,从而抑制肿瘤组织中新血管的生成,抑制肿瘤细胞的生长与转移,最后达到治疗肿瘤,延长患者生存期的目的[11-12]。本研究结果显示,两组方案均可以抑制肿瘤细胞的增生,延长患者生存期,且治疗效果相当。
本研究结果显示,对照组中胃肠道反应,肝、肾功能损伤及脊髓抑制的发生率均比观察组高,且两组比较差异有统计学意义,说明两组患者在治疗过程中都出现不良反应,但阿帕替尼联合放疗的不良反应发生率低。分析原因为两组患者都使用了放射治疗,长时间对患者肿瘤标志物照射难免会影响其正常细胞的发育,所以会对正常细胞造成一定的损伤,引起一系列不良反应。对照组在放疗的基础上联合了化疗,化疗使用的顺铂属于抗肿瘤药物,抗肿瘤药物在杀死癌细胞的同时也会造成机体正常细胞受到损伤,引起白细胞及血小板的降低。该药主要表现为恶心呕吐、骨髓抑制、消化道反应等,长时间用药还会出现肾毒性。因此,同步放化疗不良反应的发生率会大大增加[13]。观察组在放疗的基础上使用阿帕替尼,其是一种抗血管生成靶向药物。该药可以根据患者对于本药的耐药性来调整服药剂量,控制好服药剂量,不仅可以降低不良反应的发生率,还可以使现有的肿瘤血管退化,抑制肿瘤新生血管的生成,达到治疗肿瘤的目的[14]。
综上所述,阿帕替尼联合放疗对于晚期食管癌患者而言,既可以改善血清肿瘤标志物水平,也有良好的临床治疗效果,且不良反应的发生率较低,安全性较高。
