生物酶解影响蛋白起泡特性的因素及机理研究进展
2022-05-13陈美如于一丁刘静波
张 婷,陈美如,于一丁,张 燕,刘静波
(吉林大学食品科学与工程学院,吉林省营养与功能食品重点实验室,吉林 长春 130062)
在各类食品的加工过程中,蛋白由于具有良好的起泡性、乳化性、凝胶性等功能特性,在食物的质地和结构方面发挥着重要作用。起泡性作为其中的重要特性之一,通过形成绵密细微的泡沫来赋予食品优良的质构特性和均匀细腻的口感,在许多烘焙制品、冰淇淋、啤酒、充气糖果等制作中均起到了重要作用。随着人们对泡沫型食品需求的增加,如何提高蛋白起泡性逐渐成为了研究重点。生物酶解作为食物蛋白深加工方法之一,不仅能产生具有生物活性的小分子肽,而且在一定程度上改善了蛋白的起泡特性,进一步提高了蛋白的附加值。因此,本文就近年来蛋白起泡特性的相关机理以及生物酶解影响蛋白起泡特性的因素进行综述,希望为今后食物蛋白的综合利用与深度开发提供新的思路。
1 蛋白的起泡机理及影响因素
1.1 蛋白泡沫的形成机理
泡沫是一种常见的气-液多相分散体系,大量的气体进入到连续相(通常是含有蛋白质的水溶液)中形成大小不同的气泡,这些气泡被液相薄膜所分隔,由于薄膜间的流体排水现象导致气泡逐渐靠近,从最初的球形呈现为多面体状[1]。因此,在没有蛋白质等表面活性剂稳定界面的情况下,泡沫将极其不稳定。蛋白分子具有两亲性,在分散过程中,蛋白的亲水基团进入液相,疏水基团进入气相;在搅拌过程中,由于疏水基团吸附在气-液界面上,降低了表面张力,同时因为界面处蛋白的非共价相互作用的存在形成黏弹性薄膜,有助于泡沫的形成和稳定[2],形成泡沫的相关机理示意图如图1所示。
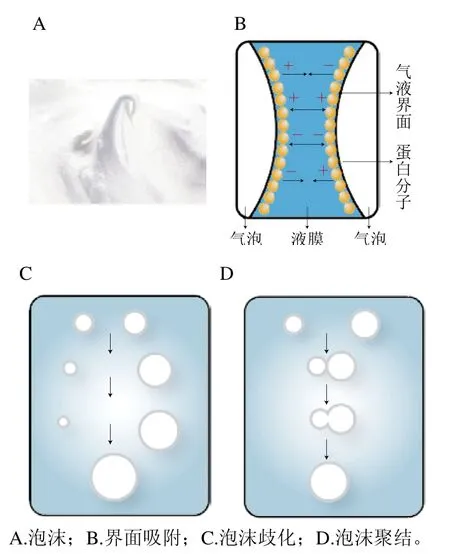
图1 蛋白泡沫形成的机理示意图[3]Fig. 1 Schematic diagram of protein foaming mechanism[3]
1.2 蛋白泡沫的界面吸附动力学
蛋白质的起泡性在很大程度上取决于蛋白分子在气液界面的吸附动力学。一般来讲,可以把蛋白的吸附动力学分为4个阶段[4]:滞后期、扩散、吸附、重排。第一阶段为滞后期,也叫滞后时间,即表面张力降至其初始值的95%时所需的时间,用来表征扩散的早期阶段,通常与蛋白分子的柔韧性和疏水性相关。Wouters等[5]在研究小麦面筋水解物部分替代蛋清蛋白时发现,对于二者的混合溶液并没有记录到滞后时间,表明蛋白几乎是瞬间吸附到界面上。类似的,Talansier等[4]研究干热处理蛋清对蛋清蛋白泡沫和界面特性的影响时也获得了一个极低值,同样说明蛋清蛋白对界面的吸附与气泡的形成是瞬时的。第二阶段是扩散阶段,即蛋白分子由液相扩散到气相的过程,主要受到界面和连续相之间的蛋白浓度梯度的影响,较高的蛋白浓度对此阶段的进行有一定的促进作用。第三阶段是吸附(渗透),即亲水基团进入水相,而疏水基团暴露于空气相,蛋白分子到达界面后进行的一系列吸附、展开、界面折叠等过程。例如Talansier等[4]发现蛋清蛋白的吸附率随着热处理强度的增加而逐渐降低。第四阶段是重排,是指蛋白分子在界面的聚集、重新排列形成界面膜,平衡表面张力的过程。值得注意的是,对于蛋白混合物,各组分蛋白在气-液界面的吸附程度主要取决于它们到达界面的顺序,且后到达的蛋白很难使已经吸附在界面的蛋白(尤其球状蛋白)解吸[6],因此考虑界面吸附动力学对于研究泡沫的稳定性和界面膜的组成具有一定必要性。
1.3 蛋白泡沫的失稳机制
泡沫的不稳定性主要归因于歧化和聚结两种失稳机制。歧化的发生是因为不同大小气泡存在的压力差导致的。当两个气泡半径相等时,接触界面为一个平面,说明界面两边压力平衡。而当两个气泡半径不等时,界面呈现曲面状,小气泡内外的压力差大于大气泡内外的压力差(小气泡的气体溶解度高于大气泡),这就导致气体从小气泡扩散至大气泡中[7]。小的气泡收缩并促使大气泡增长,最终导致泡沫的不稳定破裂。Yang Xin等[8]研究蛋清蛋白泡沫稳定性和界面特性时发现,由于歧化作用,总体气泡尺寸(平均气泡面积)会随着时间的推移而增加。为了减缓歧化作用,可以通过降低表面张力或在气泡周围形成黏弹性膜[5]的方式阻碍气体扩散。
聚结是指相邻气泡的合并。当多个气泡聚集时,接触点处的曲率较大,驱动着正常界面的液体向接触区域流动,导致液膜中的液体流失[9],液膜变得越来越薄直至达到临界厚度,不再能承受住气泡内的压力最终导致破裂。这一过程主要取决于气泡周围吸附的蛋白质层和黏弹性膜[10],也取决于气泡表面蛋白质引起的静电作用力。Wouters等[5]发现通过增强蛋白吸附层间的静电和疏水相互作用阻碍了气泡的接近,增加了对起泡聚结的抵抗力。
泡沫最终形成的大小是气泡增长与失稳现象之间相互平衡的结果[8],而这两种失稳机制又与吸附在界面上的蛋白质层有着直接关系。
1.4 蛋白起泡性的改性方法
在应用和研究过程中,通常以起泡性和泡沫稳定性作为蛋白泡沫的评价指标[11]。起泡性通常用于衡量蛋白泡沫生成的难易程度,可通过测量泡沫体积的增加量来确定。而泡沫稳定性是指维持泡沫的持久性,可通过测量一段时间内液体的排放量或泡沫体积的减少量来确定。这两个指标在食品的加工过程中对于食品的外观、质构等特征起到重要作用。影响蛋白溶液起泡性和稳定性的因素有很多,例如蛋白来源[12]、蛋白浓度[13]、蛋白溶液的温度[14]、pH值[15]、加入的各类物质(糖[16]、无机盐[17]、金属离子[18]、生物酶[19])及比例、搅打起泡的速度和时间[20]等。在实际生产中,为了能够提高蛋白的起泡性,常常会对蛋白进行改性处理。常用的改性方式主要包括物理改性、化学改性和生物酶解。
1.4.1 物理改性
物理改性主要是通过热处理、超声波、微波、高压脉冲电场、辐照处理等物理效应改变蛋白质的高级结构和分子间的聚集方式,从而改变蛋白的起泡特性。一般情况下,物理改性不会改变蛋白质的一级结构[21]。以超声为例,超声空化作用会诱导蛋白质部分解折叠[22],使位于分子内部的疏水性氨基酸暴露,提高蛋白的疏水性,从而达到改变起泡性的目的。这类改性方式具有作用时间短、无毒副产物、对食品的营养安全性小[23]等特点。
1.4.2 化学改性
化学改性是通过化学反应在蛋白分子上引入不同的功能基团(亲水亲油基团、二硫基团、带负电基团等),利用侧链基团的化学活性,选择性地转化为衍生物来改变蛋白结构,从而影响蛋白的起泡特性。常见的包括磷酸化、糖基化、酰基化、硫醇化[24]以及共价交联作用[25]等方式。以糖基化为例,与蛋白分子共价交联时提供了额外的亲水基团而提高了溶解度[26]和起泡性;又因增加了体系的黏度[27]、降低了泡沫排水的速度而增加了泡沫的稳定性。化学改性方式较为灵活且对设备的要求较低、成本低,但同时需要考虑引入的化学试剂及反应残留物的毒性等问题,需更多地考虑其在食品工业上的可应用性。
1.4.3 生物酶解
生物酶解是通过在蛋白溶液中添加生物酶,利用酶切位点将蛋白质水解成多肽、寡肽、氨基酸等物质。分子内部的疏水基团暴露,影响蛋白与蛋白分子间以及蛋白与水分子之间的相互作用[24],降低表面张力并加强与气-液界面的交联进而影响起泡性。相较于物理改性对设备成本、操作技术要求较高,化学改性具有潜在安全隐患等局限性,生物酶解的反应条件更加温和,能源消耗更低、专一性强且毒副产物产生率极低[28],一般情况下,酶解后的产物具有与母体蛋白相同的氨基酸组成[19],并且与母体蛋白相比,酶解产物的分子质量显著降低,部分典型的理化特性如溶解性、柔韧性、疏水性等得到明显改善,促进了起泡性的提升。此外,生物酶解法对于酶解过程、酶解产物都具有高度可控性,通过酶解前的预处理使分子结构松散可以提高酶解效率;通过控制酶解时的温度、pH值、酶添加量、底物浓度和酶解时间[29]等因素去调控水解程度来影响酶解产物及相关特性。通常在轻度酶解或适度酶解条件下便可对蛋白的起泡性有较显著的改善作用。酶解产物易被人体消化吸收,能产生具有特定生物活性的小分子肽。有研究表明,这些活性肽具有良好的降血压[30]、抗氧化[31]、抗凝血[32]、免疫调节[33]和防治糖尿病[34]等生理功能;从研究层面来讲,对蛋白酶解产物的研究,多围绕在各类生物活性肽的制备和作用机理方面[35],在制备高特性蛋清蛋白粉[36]、降低致敏性[28]、脱苦[19]、脱盐[37]等方面也开展了部分研究。但是,对于生物酶解改善蛋白起泡性方面的文献报道较少。因此,下文将重点介绍生物酶解影响起泡特性的因素及机理,其主要作用机制如图2所示。
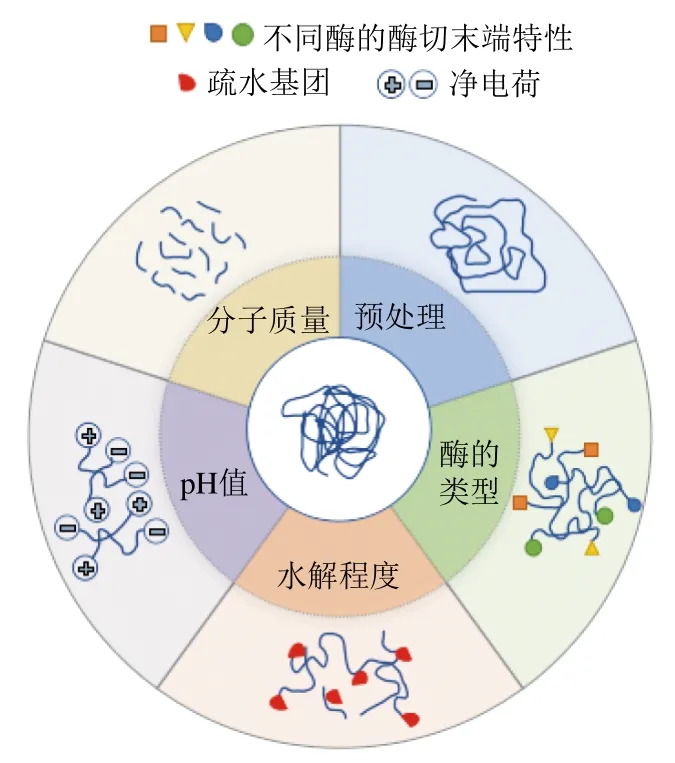
图2 生物酶解影响蛋白起泡性的5种因素及其主要作用机制示意图[5,28,38-40]Fig. 2 Schematic diagram of the major action mechanisms of five factors affecting protein foaming characteristics[5,28,38-40]
2 生物酶解影响蛋白起泡性的因素
2.1 预处理方式对起泡性的影响
紧密结合的蛋白比具有高度柔性的蛋白更耐酶的催化[41]。预处理的主要目的是让处于折叠状态的蛋白结构变得松散,加快酶促反应进程[38]。因此,酶解前底物蛋白预处理对起泡性改善效果起着重要作用。常用的预处理方式主要包括热处理和超声处理。
2.1.1 热处理
适当的高温处理会改变蛋白的结构并对其功能特性产生积极的影响[42]。高温处理可破坏天然蛋白的氢键、疏水相互作用等次级键,使蛋白分子从有序的致密结构转变为无序的松散伸展状结构,暴露出大量的酶切位点,增加了酶与底物的接触程度。王永梅等[43]研究了木瓜蛋白酶对蛋清蛋白起泡性的改善作用,发现在热处理温度90 ℃、热处理时间15 min时,与对照组相比,蛋清蛋白起泡能力提高了112.97%,泡沫稳定性提高了93.27%。Liang Guijiang等[44]在研究预热处理和酶解相结合改性的大豆蛋白水解产物的起泡性能时发现,在55 ℃下对大豆蛋白进行30 min的预热处理可以促进亲水性酸性亚基的水解并增加了伴大豆球蛋白和β-伴大豆球蛋白的比例,提高了其分子柔性和在空气-水界面的快速吸附能力,使得此预处理条件下的酶解产物具有最佳的界面特性和泡沫容量以及稳定性。利用蛋白酶酶解热处理后的蛋白质,可将体系中存在的不溶性蛋白聚集体降解为可溶性蛋白,从而提高其起泡性。另一方面,加热导致体系黏度增大,降低了泡沫排水的速度[29],从而改善了泡沫稳定性。因此,热处理目前也被广泛应用于改善动植物蛋白[45]起泡特性的研究中。
2.1.2 超声处理
与热处理相比,超声被认为是一种更加温和的蛋白处理方式。热处理会对蛋白结构造成不可逆的影响,而超声可通过空化作用[46]使蛋白结构松散,可作为改善蛋白起泡特性[47]等功能特性的辅助手段。Stefanovic等[39]研究超声预处理对蛋清蛋白酶解产物起泡性影响时发现,与未超声样品相比,在20 min的超声处理时间内,碱性蛋白酶和木瓜蛋白酶产物的起泡性均随着超声时间的延长而提高。产生这种结果的原因可能是由于超声导致蛋白和空气均匀混合,使蛋白结构松散,暴露出更多的酶切位点和疏水基团,增加了蛋白对酶解的敏感性。酶可以结合更多的蛋白酶切位点,酶解效率提高,在相同处理条件下获得产物的水解程度和形成泡沫的能力增强[40]。然而超声处理超过20 min会显著降低蛋白对酶解的敏感性,表明过长的处理时间会使分散的蛋白又重新聚集,暴露的酶切位点和疏水基团将被再次掩埋。因此,在超声预处理过程中应严格把控超声时间,避免因聚集现象导致的水解产物起泡性下降。Jain等[48]研究超声预处理对蛋壳膜(egg shell membrane,ESM)蛋白的酶促水解及功能特性的影响时发现,与只进行酶解的蛋白样品相比,经历了超声预处理的酶解产物的起泡性和泡沫稳定性均提高了10%左右。这可能是因为在超声过程中产生的剪切力和热效应导致蛋白的结构发生改变,共价键断裂,暴露疏水基团,使蛋白的柔性和溶解度增加,酶切位点更容易被酶结合。因此,适当的超声预处理对于酶解提高蛋白水解物的起泡特性具有一定的促进作用。
2.2 酶类型对起泡性的影响
不同的蛋白酶,其来源、底物特异性、活性位点和催化机理等特性各异,因此选择合适的酶水解蛋白将能生产出具有高质量功能特性的水解产物并有效地控制生产成本。目前市面上常见的蛋白酶主要包括微生物来源的蛋白酶(碱性蛋白酶、中性蛋白酶、风味蛋白酶等)、植物来源的蛋白酶(木瓜蛋白酶、菠萝蛋白酶等)和动物来源的蛋白酶(胰蛋白酶、胃蛋白酶等)。刘丽莉等[49]研究了不同蛋白酶对卵白蛋白(ovalbumin,OVA)水解度和起泡性的影响,发现碱性蛋白酶的水解能力和水解产物起泡性显著优于其他蛋白酶(P<0.05),原因可能是碱性蛋白酶的活力较高,在碱性条件下更易诱导蛋白自身的水解。此外,碱性蛋白酶作为一种典型的内肽酶,具有广泛的水解特异性,能够使隐藏在蛋白分子内部的疏水性氨基酸残基暴露出来,增强了水解产物的疏水性,对于后续的起泡性结果起到了积极的促进作用。Stefanovic[39]和Jovanovic[50]等研究了蛋白酶类型对蛋清蛋白起泡性影响,发现碱性蛋白酶的水解产物在酶解全程中表现出更好的起泡特性(P<0.05),这一结果可能是酶切割位点的特异性导致的。碱性蛋白酶优先水解包含芳香族氨基酸残基的肽键,特别是精氨酸、赖氨酸和苯丙氨酸等[51],而木瓜蛋白酶偏向于半胱氨酸和组氨酸残基。因此,由于蛋白酶底物特异性的不同,导致了水解产物的表面疏水性和电荷性质等理化性质差异,最终使得酶解产物之间的泡沫性质发生变化。
Hammershoj等[9]利用不同蛋白酶酶解卵黏蛋白时发现,风味蛋白酶的水解产物具有较好的起泡特性。风味蛋白酶是通过米曲霉的受控发酵获得的一种同时具有外肽酶和内肽酶酶解特性的混合物。在最初的酶解过程中,风味蛋白酶主要发挥内肽酶活性,缓慢增加水解体系中末端活性位点的数量;在酶解12 h后,水解体系中末端活性位点的数量积聚又激发了其外肽酶的酶解效应;获得的风味蛋白酶水解产物具有更高的表面疏水性,即疏水残基的暴露降低了产物肽中净电荷增加所产生的干扰,同时表现出良好的起泡能力。Garcés-Rimón等[52]发现食品级氨肽酶处理液态蛋清可赋予液态蛋清良好的起泡性和泡沫再塑性,其原因可能在于产物的极性、离子化基团和疏水基团等发生变化。因此,不同的酶类型主要是凭借其各自的切割位点及酶切末端特异性,影响产物的水解度及表面疏水性、电荷属性等理化性质,进而改善水解产物的起泡特性及泡沫质地。
2.3 水解程度对起泡性的影响
蛋白酶水解过程中,随着水解程度的增加,水解产物的分子质量和氨基酸残基的暴露情况会发生显著的变化。其中,水解产物的疏水性对其起泡性和泡沫稳定性有着重要的影响,在蛋白界面吸附动力学中的“滞后期”和“吸附期”阶段起着重要作用。适度的酶解可以使原本被掩埋的疏水基团暴露出来,增强蛋白对气-液界面处的吸附,降低表面张力,从而改善起泡性;同时,由于界面处蛋白吸附量增多,分子间作用力增加,有助于稳定界面黏弹性薄膜,阻碍泡沫排水现象来改善泡沫稳定性。Liu Lili等[28]通过碱性蛋白酶在适宜条件下酶解卵白蛋白,发现水解OVA的起泡性比天然OVA的起泡性有所提高,可能是由于酶解导致蛋白质的部分展开,增加了疏水区域的暴露程度,产物疏水性增强。通过紫外吸收光谱测定发现吸收峰产生了红移,且吸收强度增高,表明色氨酸残基(疏水性氨基酸)逐渐暴露于蛋白分子的表面,进一步证明了疏水性的影响。
然而,起泡性并不随着水解程度的持续增加而增加。Mohanty等[53]在研究水解程度对鱼蛋白酶解产物起泡特性的影响时发现,起泡性随着水解程度的增加而呈线性下降趋势,说明水解产物中较大尺寸的肽可能会形成更浓密的泡沫。轻度水解时,较长的多肽链可以快速在界面吸附并降低表面张力。但当水解过度时,较短的肽链或氨基酸不利于形成气-液界面稳定的薄膜,对泡沫特性存在负面影响。Hammershoj等[9]利用碱性蛋白酶和链酶E酶解卵黏蛋白时发现,酶解产物的起泡性在最初的1~2 h内逐渐增加。随着酶解时间的延长,起泡性呈现显著下降趋势。酶解24 h后,样品的起泡性已低于未酶解蛋白的起泡性。对于水解度在15%~40%之间的样品,起泡性能较佳。根据排水速率的测定,样品的泡沫稳定性与水解中段和末段的起泡性呈现出相似的变化趋势。表面疏水性实验证明,较高水解程度下的疏水性较低,是因为过度水解导致疏水区域肽裂解,肽的净电荷增加,吸附的静电屏障可能会增加,减少肽在气-液界面的吸附量,从而降低了起泡性。此外,增加的静电排斥作用可能会阻碍气-液界面上吸附的肽之间的分子间作用力,导致界面黏弹性降低,泡沫稳定性随之降低[53]。类似的,Wouters等[5]在用胰蛋白酶和胃蛋白酶酶解小麦面筋蛋白时发现,水解度为2%的水解产物的泡沫稳定性要比水解度为6%的水解产物高(P<0.05),这是由于水解程度较低的样品中特定疏水性肽的含量更高。刘丽莉等[49]利用碱性蛋白酶对卵白蛋白进行了5 h的充分酶解后,所测得的起泡性和泡沫稳定性均降低了20%左右,且水解时间越长,水解度越高,表面巯基含量越少,疏水性降低趋势越显著。其原因可能在于过度酶解破坏了疏水区域肽,同时在酶解产物制备的离心过程中存在一定疏水性多肽的损失。因此,调控酶解产物的水解程度可直接影响水解产物的分子质量和疏水性,改善界面吸附效应,进而影响蛋白的起泡特性。
2.4 pH值对起泡性的影响
pH值也是影响蛋白水解产物起泡性能的重要因素之一,主要是通过影响分子的带电性而在吸附动力学的“吸附期”发挥作用,一定程度上影响了蛋白水解产物在界面的吸附和聚集行为。Cho等[54]在测定蛋清蛋白的中性蛋白酶水解产物的起泡性时发现,酸性条件下产物的起泡性远大于中性和碱性条件。起泡性在pH值为3.6时达到最大值,且与相同pH值条件下的非水解蛋白相比,泡沫容量和泡沫稳定性显著提高,而pH值在7.6和9.0时,发泡能力趋于下降。原因可能在于pH值为3.6时更接近蛋清蛋白的等电点,蛋白水解产物表面电荷被中和,降低了分子间的静电斥力和气-液界面吸附能垒,蛋白水解产物的界面吸附速率和吸附数量增加,从而改善了蛋白水解产物的起泡性。与此同时,较低的静电斥力导致界面处分子间吸引力增加,提高了界面膜强度,改善了流变性能,减缓了液体排水,从而增加了泡沫稳定性。pH值的变化导致的酶解体系中分子带电性的差异,会进一步影响蛋白水解产物的溶解度,从而影响其起泡性能。研究表明,随着pH值的升高,蛋白水解产物溶解度呈增加趋势,起泡性也相应提升。这可能是由于蛋白水解产物在蛋白等电点处的静电斥力最小,分子最易于聚集,从而导致接近等电处的产物溶解度较低且不能快速地移动到气-液界面,影响产物的起泡性。Chen Chen等[55]研究了不同pH值条件下蛋白水解产物的起泡性差异,发现当pH值在3.0~5.0之间增加时,整个体系越来越接近蛋白等电点,蛋白水解产物溶解度逐渐降低,而起泡性逐渐增加。随着pH值的继续增加,蛋白水解产物溶解度逐渐升高,在pH 7.0时获得最大值,而起泡性显著降低。体系在pH 8.0时出现了溶解度降低和起泡性升高的现象,说明溶解度并不是影响蛋白水解产物起泡性的唯一因素。Stefanovic等[56]认为,蛋白暴露于碱性条件下可能会促进其部分结构展开,增加了疏水基团与气-液界面的可及性,从而提高蛋白水解产物的起泡性。
2.5 分子质量对起泡性的影响
分子质量对起泡性的影响主要作用在吸附动力学的“扩散期”,分子质量的大小影响着分子的界面扩散速率。有文献表明,能快速形成泡沫的蛋白,其结构特征之一就是具有低分子质量[1]。蛋白经过酶解被切割成多肽或氨基酸,蛋白的高级结构被破坏的同时分子质量降低,向界面扩散和吸附的速率提高,有利于改善其起泡性。由于大部分蛋白的优良加工特性只有在处于可溶解状态时才能展现出来,而分子质量的降低使得蛋白的亲水性提高,可提高其溶解度和柔韧性,有望改善蛋白的加工特性。Chen Chen等[55]利用胰蛋白酶酶解蛋清蛋白后,起泡性和泡沫稳定性均显著提高,说明酶解降低了蛋白的分子质量,提高了溶解性和柔韧性,促进了泡沫和界面膜的形成。Cho等[54]的研究表明,与天然蛋白分子相比,酶解后的蛋白溶液起泡性有明显改善,其原因在于蛋白水解产物分子质量的降低使其能形成更稳定的界面层,增加分子界面扩散速率。然而,分子质量过低会对泡沫稳定性产生负面影响,因为过多的低分子质量肽很难维持液膜强度,不利于泡沫的稳定。Stefanovic等[56]利用中性蛋白酶和碱性蛋白酶对蛋清蛋白进行双酶水解,发现蛋白水解产物分子质量降低,提高了溶解度和柔韧性,从而促进了界面膜的形成,提高了蛋白水解产物的起泡性。Liu Lili等[28]通过凝胶电泳实验测定了卵白蛋白酶解后的分子质量,发现水解后的蛋白分子质量主要在20.1~14.3 kDa之间,明显低于天然卵白蛋白的分子质量(大于44.3 kDa),而蛋白水解产物具有更好的起泡性。其原因可能在于,蛋白酶酶解处理可以通过切割肽键来影响蛋白质的三级和四级构象,从而产生更亲水、更易溶的较低分子质量的蛋白水解产物,提高了它们向气-液界面处的迁移速率,进而影响其起泡性。
将蛋白生物酶解过程的影响因素及机制进行总结,具体如表1所示。
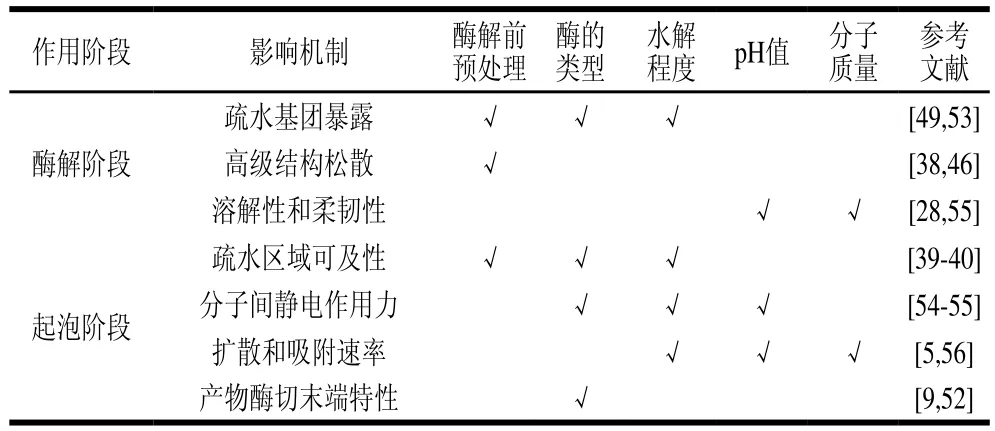
表1 生物酶解改善蛋白起泡性的作用机理分析Table 1 Analysis of the mechanism by which enzymatic hydrolysis improves protein foaming capacity
3 结 语
在蛋白的酶解过程中,预处理方式、酶的类型、水解程度、pH值以及分子质量等因素通过不同的作用机制来影响蛋白的起泡特性。但目前的研究主要围绕在生物酶解对起泡性能的影响及工艺优化等方面,对其影响机制的研究仍然亟待开展,应用领域仍待开拓。目前尚有诸多问题亟待解决:1)生物酶解后蛋白结构及理化性质的变化与蛋白起泡特性的相关性仍不够明确,对于蛋白水解产物起泡性构效关系方面的研究较为欠缺;2)相较于实际的食品加工体系,目前对于生物酶解的实验和应用环境过于简单,所考察的泡沫性质较为单一,在今后的研究中应考虑利用复杂食品介质(湿度、温度、盐、糖、脂肪等混合作用)来评估酶解产物的起泡特性;3)虽然生物酶解可有效改善蛋白水解产物的起泡特性,但随之而来的产品风味和口感变化不容忽略。蛋白酶解过程中容易产生苦味肽和游离氨基酸等风味物质,后续应研究产品风味与起泡性之间的关系。
