花色苷递送系统研究进展
2022-05-13马小强白卫滨陈嘉莉孙建霞
马小强,白卫滨,陈嘉莉,孙建霞,*
(1.广东工业大学轻工化工学院,广东省植物资源生物炼制重点实验室,广东 广州 510006;2.暨南大学理工学院,食品安全与营养研究院,广东 广州 510632)
花色苷作为植物中常见的功能色素物质[1-4],具有广泛的生理功能,如抗氧化[5]、抗癌[6]、抗肥胖[7]、预防心血管疾病[8]等。然而研究发现,花色苷稳定性较差,加工过程中容易受到温度、光照、pH值等环境因素的影响,发生不同程度的降解[9-10]。此外,有研究表明花色苷进入人体后的生物利用度较低[11-14]。花色苷的生物利用度取决于食物基质、其他食物成分以及花色苷的结构。其中,花色苷结构是生物利用度的决定性因素,如以3-羟基花色苷为基础的花色苷比B环上有更多取代基的花色苷更容易被吸收[15],而亲水性基团较多的花色苷比羟基数量较少、亲水性较低的花色苷有更高的生物利用度[16];酰化作用能够提高花色苷的稳定性,但同时会显著降低其生物利用度[17]。花色苷被人体摄入时,通常会与不同的食物基质结合,从而影响人体对花色苷的吸收[18-19]。
花色苷消化吸收过程如图1所示,从口腔开始,一部分花色苷在中性/弱碱性pH值条件下转化为查耳酮形式,并且口腔内的微生物也可以将花色苷裂解为小分子化合物,目前原儿茶酚酸和间苯三酚醛已被证实是其主要的降解产物[20]。由于食物很快被送到胃中,口腔对花色苷的降解作用可以忽略不计。当食物到达胃时,花色苷在胃中的状态是相对稳定的[21]。虽然花色苷会被部分降解,但是随着食物的摄入,花色苷含量也在增加,降解作用会被抵消,且花色苷在胃中是可以被吸收的。研究表明,花色苷可以通过不同的胃细胞模型转运,并且其吸收速率与孵育培养时间、pH值、花色苷结构以及相对分子质量有关[22]。在胃细胞模型中,随着接触时间的延长和花色苷浓度的提升,花色苷的吸收增加[23]。据报道,单体花色苷可能比其衍生物具有更高的吸收速率[22,24]。食物从胃部到达肠道后,未被胃吸收的花色苷进入小肠的碱性环境中,主要以甲醇假碱形式存在。花色苷可通过被动转运和主动转运的形式被肠上皮细胞吸收。小肠上皮细胞对花色苷的吸收受花色苷分子大小和结构影响,但糖苷部分对矢车菊素型花色苷的吸收没有影响。此外,花色苷代谢迅速,除了进入血液循环以外,还会以完整或者代谢产物的形式进入到胆汁中[25]。进入胆汁的花色苷及降解产物其中一部分被小肠重吸收,由门静脉重新回到肝脏,另一部分则进入大肠,随粪便排出。
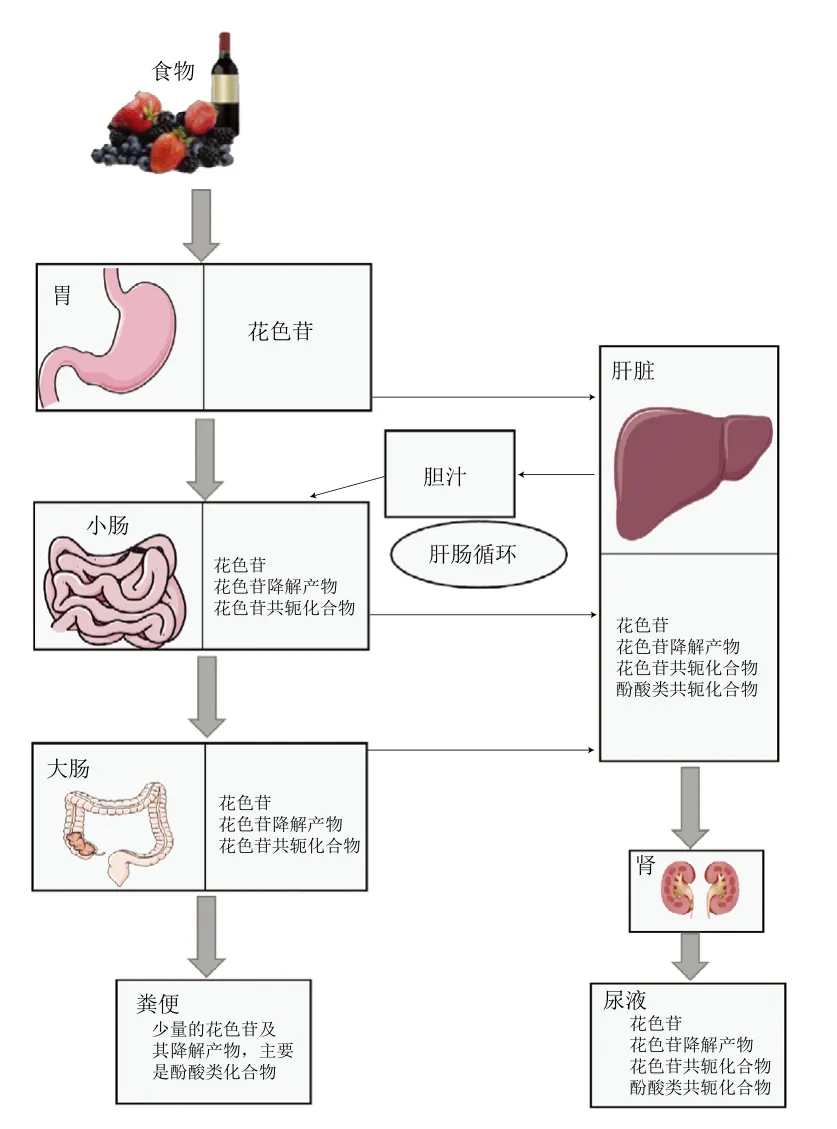
图1 花色苷在人体内的消化过程示意图Fig. 1 Schematic diagram of anthocyanins passing through the human digestive system
如何稳定花色苷结构、降低花色苷在胃肠道的降解速率、提高细胞的吸收率,成为花色苷进一步应用于食品、药品等行业亟待解决的问题。迄今为止,许多研究表明利用递送系统给药是一种有效提高花色苷稳定性和生物利用度的方法[26-27]。
递送系统是一类应用前景广阔的定向、定位、控释给药载体系统。它是将功效物质吸附、包埋或直接连接于载体,利用载体的理化性质和选择性分布特点,从而解决药物在递送过程中存在的溶解度低、稳定性差和吸收受限等问题,除此之外,递送系统还能够增加药物的溶出速率和吸收速率,提高生物利用度。总的来说,递送系统在药物输送方面具有许多优越性:1)控制药物释放、延长作用时间;2)靶向药物递送;3)在保证药物作用的前提下,减少用药剂量,减轻或避免不良反应;4)提高药物的稳定性及生物利用度[28-29]。递送系统为改善药物的稳定性等问题提供了较理想的给药手段。
近年来,研究发现利用蛋白质、多糖等天然生物大分子以及脂质等作为制备微囊、纳米颗粒、乳液、脂质体等的递送载体,具有优良的生物相容性、安全、无毒等优点[30],可用于食品功能因子的递送,对于改善功能活性物质的稳定性具有十分重要的实用价值。
常见的花色苷递送系统包括:1)蛋白质-花色苷递送系统;2)多糖-花色苷递送系统;3)脂质体-花色苷递送系统;4)复乳体系递送系统;5)复合递送系统。花色苷的缓释对于所负载生物活性物质的潜在生物活性和生物利用度至关重要,以下针对5种主要的花色苷递送系统进行介绍,以期为花色苷在食品及其他行业中的进一步应用提供参考。
1 蛋白质-花色苷递送系统
常见的蛋白质类载体材料包括动物来源的乳清蛋白、酪蛋白、明胶等,以及植物来源的大豆蛋白和玉米醇溶蛋白等。动物源性蛋白质具有良好的成膜性、较好的生物相容性等特点[31],可以迅速分散形成稳定的乳化液。植物源性蛋白因其来源丰富,所以加工成本低,并且具有较好的成膜性和一定的抗氧化性。
乳清蛋白和酪蛋白是天然乳蛋白中的主要成分,常作为壁材保护生物活性物质。乳清蛋白是一种具有较高亲水性的致密球状蛋白,酪蛋白含有较多的亲水基团和疏水基团,常以球状胶束的形式存在[32]。Liao Minjie等[33]利用酪蛋白和乳清蛋白,通过喷雾干燥技术制备了负载花色苷的微粒。花色苷和蛋白质主要多肽链中的C、N和O通过氢键结合,形成的酪蛋白和乳清蛋白微粒的包埋率分别为(49.73±0.68)%和(59.99±0.49)%。同时花色苷和蛋白质通过非共价结合改变了蛋白质的三级结构,使内源性疏水氨基酸更具亲水性。通过体外胃肠消化模拟,负载花色苷的酪蛋白和乳清蛋白在胃液中表现出稳定的蛋白质结构,有利于维持微粒的结构和保留花色苷,胃消化结束时,两种微粒的释放量远低于单体花色苷,花色苷在微粒进入肠液后得到释放。在小肠环境中,两种微粒的释放时间从180 min延长到300 min,最终释放率分别为52%和40%。Wu Yue等[34]研究了不同载体材料在体外模拟胃肠消化和结肠发酵过程中对花色苷释放和降解以及肠道菌群调节的影响。其中,大豆分离蛋白可以通过疏水作用和静态猝灭与花色苷发生相互作用,从而增强花色苷的稳定性,包埋率可以达到(91.89±1.71)%。并且在体外消化2.5 h后,经大豆分离蛋白包裹的花色苷微囊中花色苷的释放率最低,为27.1%。其次为明胶包裹的微囊,包埋率为(89.45±1.47)%,在体外消化中花色苷的释放率为28.7%;而未微囊化的花色苷释放率为70.9%,大豆分离蛋白和明胶显著降低了花色苷在体外模拟胃肠消化中的释放率,对花色苷起到了较好的保护作用。且实验结果表明微囊化增强了花色苷的结肠可及性,使花色苷更容易到达结肠,并利于肠道微生物的利用。
目前对花色苷递送系统的研究主要基于体外胃肠模拟,而关于体内吸收率和生物利用度的研究甚少。Mueller等[35]通过让志愿者摄入负载花色苷的乳清蛋白微粒,研究其尿液、血浆和肠道流出物中的花色苷及其降解产物,并与摄入花色苷志愿者的数据进行比较。结果表明,与摄入花色苷相比,摄入乳清蛋白微粒会导致尿液中花色苷及其降解产物浓度升高,可能会增加花色苷在体内的浓度和短期的生物利用度。但是,其实验结果并未表明乳清蛋白微粒可以在肠道环境中稳定花色苷,尿液中花色苷及其降解产物含量高的一个原因可能是通过乳清蛋白延长花色苷在胃中的停留时间实现的。除了传统的蛋白质类壁材,Liu Yuqian等[36]对广泛分布于植物、动物、细菌和真菌中的铁蛋白进行了综述,发现铁蛋白具有纳米级的壳状结构和可逆的自组装特性,可以达到稳定、溶解和靶向递送的目的。同时,可以利用铁蛋白的电荷特性和可被修饰的外表面从而提高铁蛋白的稳定性和花色苷的生物利用度。但其包埋率较低,并且由于铁蛋白在胃肠道中不稳定,需要利用共价作用以及非共价作用对铁蛋白外表面进行有效的修饰,从而抑制其在胃肠中的降解。Zhang Tuo等[37]利用铁蛋白的可逆解离和重组对花色苷分子进行包埋,花色苷分子与铁蛋白内表面的氨基酸残基之间有着强相互作用,一个铁蛋白壳层中负载了(37.5±4.5)个花色苷分子。这种包裹作用使花色苷分子的热稳定性和光稳定性提高了约2 倍,并且与游离花色苷相比,包裹在载铁蛋白纳米笼中的花色苷分子被Caco-2细胞吸收的速率更高,具有更高的转运效率。
2 多糖-花色苷递送系统
多糖是单糖的聚合物,可获得性广、价格低廉,并且容易进行化学修饰,此外还具有生物可降解性,因此被广泛应用于微载体药物递送系统[38]。琼脂、海藻酸盐、卡拉胶、壳聚糖、纤维素、瓜尔豆胶、果胶、淀粉和黄原胶等多糖的分子结构和功能性在很大程度上取决于它们的生物来源、提取方法和后续加工方式[39]。
壳聚糖是一种聚阳离子多糖,由天然甲壳素经碱性脱乙酰化而成,无毒并且具有较好的生物相容性和生物降解性[40]。壳聚糖已被开发出各种纳米结构,如纳米颗粒、纳米水凝胶、纳米纤维和纳米复合材料,这些纳米结构已成功应用于各种生物活性化合物的递送[41]。Sun Jianxia等[42]将壳聚糖、壳寡糖、羧甲基壳聚糖与离子交联剂γ-聚谷氨酸或氯化钙复合,制备了壳聚糖纳米粒子。与其他几种壳聚糖纳米粒子相比,花色苷-羧甲基壳聚糖-氯化钙纳米粒子具有最高的包埋率(53.88%)和载药率(5.11%),并且具有较好的粒径(最小粒径可以达到180 nm)、良好的稳定性和血液相容性。这是因为包埋率受材料的极性和花色苷作用影响。羧甲基壳聚糖是带负电荷的多糖,相比带有正电荷的壳聚糖,更容易与带有正电荷的花色苷发生作用,花色苷的羟基也会与羧甲基壳聚糖的羧基和氨基发生作用。该研究还表明花色苷-羧甲基壳聚糖-氯化钙纳米粒子是溶酶体环境中最适合调节细胞凋亡的递送系统,释放率可以高达75%。
尽管壳聚糖可以提高花色苷的稳定性,但是其在酸性条件下易发生解离,导致在胃环境中药物的快速释放,这限制了壳聚糖在口服递送系统中的应用[43]。因此,壳聚糖常和其他壁材一起用于提高整个递送系统的稳定性。Tan Chen等[44]以接骨木提取物为花色苷来源,利用壳聚糖和硫酸软骨素通过静电作用络合形成花色苷聚电解质复合物,其包埋率最高可达88%,粒径约为350 nm。多糖基聚电解质复合物的结构受pH值和多糖浓度的影响,由于花色苷在强酸性条件下更稳定,所以多糖溶液均调节到pH值为3。在此pH值条件下,硫酸软骨素中的磺酸基处于部分电离状态,并与壳聚糖中完全电离的氨基发生强烈的相互作用,形成稳定、均一的聚电解质复合物。研究还表明,与单独的花色苷相比,花色苷聚电解质复合物能够改善花色苷抗氧化活性和稳定性。Zhao Xue等[45]为了提高花色苷的稳定性,以带正电荷的壳聚糖和带负电荷的果胶为原料,采用静电自组装的方法构建花色苷纳米载体(图2)。结果表明,壳聚糖/果胶/花色苷的质量比为1∶1∶3时,纳米载体为粒径在100~300 nm之间分散良好的球形。花色苷的包埋率为66.68%。体外消化实验表明,包埋后的花色苷在胃酸环境中较稳定,在肠环境中得到缓慢释放。在体外细胞模型中,通过细胞存活率和细胞凋亡实验证明了纳米载体对丙烯酰胺诱导的细胞损伤有保护作用。运用秀丽隐杆线虫模型进行研究进一步发现,花色苷纳米载体可以延长线虫的寿命,增强线虫对氧化应激、热休克、紫外线辐射和老化等不良反应的抵抗能力。这些结果表明壳聚糖-果胶纳米颗粒可以作为载体来提高功能性因子花色苷的稳定性和生物利用度。
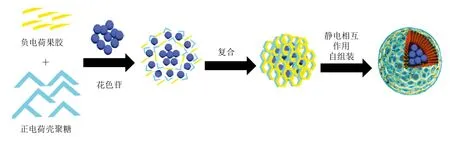
图2 果胶-壳聚糖纳米粒负载花色苷的示意图[45]Fig. 2 Schematic diagram of pectin-chitosan nanoparticles loaded with anthocyanins[45]
海藻酸盐也是一种常见的多糖类壁材,其来源丰富、无毒、可生物降解。Zou Chao等[46]的研究表明,带正电荷的花色苷和带负电荷海藻酸钠的羧基之间存在静电相互作用,同时花色苷上的羟基氢原子可以通过氢键与海藻酸钠上的氧原子成键,使得花色苷和海藻酸钠形成络合物,在模拟肠道消化中的稳定性显著提高。在模拟肠条件下30 min,花色苷的生物可及性只有大约64.2%,花色苷的生物可及性在90 min(生物可及性74.2%)和120 min(生物可及性69.5%)保持较高水平。通过小鼠模型进一步验证了海藻酸钠对花色苷的吸收促进作用。小鼠灌胃给药1 h后,测定血清和粪便中的花色苷含量。结果表明,海藻酸钠的结合作用使花色苷血药浓度提高27.40%。相反,粪便中花色苷的含量显著降低。通过其他天然聚合物与海藻酸盐结合,可以获得在酸性条件下更稳定、更好的递送系统,从而特异地在肠道中释放,并提高降解率和药物包封率。Kanokpanont等[47]制备了海藻酸钠-壳聚糖复合微粒以提高花色苷的稳定性和生物利用度。海藻酸盐与壳聚糖通过静电作用形成复合微粒,粒径大约为500 μm。结果表明,海藻酸盐微粒在质量分数0.05%壳聚糖溶液中反应而成的海藻酸盐-壳聚糖微囊体系是适合包埋花色苷的体系,能够包埋较多的花色苷,并且在模拟胃液条件下具有较高的稳定性,在模拟肠液中能实现花色苷的缓释。
卡拉胶是一种天然红藻多糖衍生物,具有形成亲水胶体、增稠、稳定分散等特点[48]。由于卡拉胶具有带负电荷的磺酸基团,可以与具有相反电荷的花色苷通过静电相互作用形成聚电解质复合物,有助于实现药物的控制释放,从而提高药物的生物利用度[49]。疏水相互作用和分子间堆积在复合物的形成中也起着重要作用。Jeong等[50]用壳聚糖和卡拉胶作为壁材负载含有花色苷的浓缩果蔬汁,并研究了其在体外胃肠模拟体系中的稳定性以及氧自由基吸收能力。壳聚糖的氨基与卡拉胶的磺酸基之间在胃的酸性条件下表现出强烈的离子相互作用,然而在肠道条件下,氨基被中和,导致两个官能团之间的离子相互作用减弱,从而使纳米颗粒膨胀,粒径增大,实现芯材的释放。与未经包埋的游离果蔬汁在肠条件下的抗氧化稳定性迅速下降相比,纳米微粒中的芯材在缓释过程中受到壁材的保护,具有相对较强的抗氧化稳定性。
3 脂质体-花色苷递送系统
脂质体递送系统已被认为是一种用来改善药物在体内递送局限性的方法,具有良好的生物利用度和治疗效果[51]。脂质体是由磷脂或合成的两亲化合物组成的双层微球形囊泡,具有疏水和亲水性区域[52]。它们是由疏水相互作用作为主要驱动力和其他分子间作用力共同作用形成[53],可以用于递送各种亲水性和疏水性物质。由于无毒、无免疫原性、生物相容性、可生物降解性和两亲性,脂质体在递送药物和食物等方面具有广阔的应用前景。
Quan Zhao等[54]通过乙醇注射法利用磷脂酰胆碱和胆固醇制备花色苷脂质体,制备的微球粒径和包埋率分别为(234.00±9.35)nm和(75.000±0.001)%。并且该学者以总抗氧化能力和丙二醛含量为指标评价花色苷脂质体的抗氧化活性,结果表明,花色苷脂质体能明显提高总抗氧化能力,降低丙二醛含量,通过激活相关的抗氧化途径保护人GES-1细胞免受H2O2诱导的胃黏膜损伤,具有良好的抗氧化和调节细胞生物活性的作用。Zhao Lisha等[55]利用超临界二氧化碳法制备了花色苷脂质体,其粒径为(159.0±0.2)nm,包埋率为50.6%。花色苷和磷脂的磷酸基团之间存在静电相互作用,同时花色苷和磷脂的羟基之间形成氢键,且随着花色苷的浓度增加颗粒的均匀性降低。脂质体中的花色苷在模拟胃液中释放缓慢,在模拟肠液中释放较快,这主要是胰蛋白酶对囊泡的降解所致。有研究通过体外体内实验发现,脂质体形式花色苷的抗糖基化活性优于游离花色苷形式,可用于糖尿病的治疗[56]。
虽然传统的脂质体在递送中有着广泛的应用,但是也存在局限性,如双层膜与血液中的循环蛋白发生相互作用,并被网状内皮系统的某些巨噬细胞摄取,从而导致血液循环时间短,并迅速从血液中排出[51]。研究人员开发出固体脂质纳米粒来改善传统脂质体的局限性。固体脂质纳米粒是由固体脂质在乳化剂的作用下稳定在水分散体中,将药物包裹于固体脂质中,减少了药物与水分散相及外界环境的接触,提高了药物的稳定性(图3)。固体脂质纳米粒可以有效地递送各种分子,包括亲脂和亲水分子。此外,固体脂质纳米粒还具有较好的生物相容性、可扩展性等优点。Ravanfar等[57]将此技术运用于花色苷递送,将花色苷负载到纳米球形颗粒中,包埋率为(89.2±0.3)%,平均粒径为(455±2)nm。此外,该学者还研究了花色苷纳米颗粒在不同pH值磷酸盐缓冲液中的体外释放情况,以及不同温度下,在pH 7.4磷酸钠-柠檬酸钠缓冲液中的短期稳定性。结果表明,固体脂质纳米颗粒可以提高花色苷在pH值和温度较高情况下的短期稳定性。关于固体脂质纳米粒应用于花色苷递送中还需要通过体外模拟体系和动物实验进一步验证。

图3 传统脂质体和固体脂质纳米粒示意图Fig. 3 Schematic diagram of traditional liposomes and solid lipid nanoparticles
4 复乳体系递送系统
复乳也称为二级乳,是在单乳基础上进一步乳化而形成的具有双层或多层乳化结构的复合体系[29]。指将简单乳液包裹于另外一种连续相中,简单地可以分为将水包油型单层乳液分散于油相中(O/W/O)、将油包水型单层乳液分散于水相中(W/O/W)、将固体分散于油相中再分散于连续的水相中(S/O/W),其中W/O/W型乳液是比较常见的类型。复乳作为载体能够保护内水相或油相物质不受外界影响,具有缓释、靶向释放、减少某些食品配料用量等优点[58]。虽然复乳体系具有巨大的应用潜力,但是因为其固有的热力学和动力学性质不稳定性,使其在食品上的应用受到限制[59]。所以研究新型复乳体系提高其稳定性是非常必要的。Teixé-Roig等[60]利用羧甲基纤维素钠提高含花色苷W/O/W型乳液的稳定性和生物可及性,并对其在模拟胃肠道条件下的行为进行了研究。结果表明,乳化剂中加入羧甲基纤维素钠后,包埋率可达90%以上,粒径小于10 μm。与花色苷提取物的水溶液相比,负载花色苷乳液的生物可及性显著提高,加入羧甲基纤维素钠稳定的W/O/W型乳液中生物可及性为(31.08±1.73)%,这可能是由于油滴在模拟胃肠液中更稳定,羧甲基纤维素钠的加入减缓了游离脂肪酸的释放,延长了对花色苷的保护时间。也有研究将酪蛋白钠溶液作为外水相制备W/O/W型乳液用来保护花色苷,结果表明在模拟胃液中花色苷得到了有效的保护,经过胃肠液消化后,抗氧化活性明显提高[61]。
近年来为了提高复乳体系稳定性,皮克林粒子常被用作稳定剂。它使用固体粒子代替表面活性剂,能够抑制液滴凝聚,利用颗粒在油滴表面的吸附来实现体系稳定的乳状液,具有较高的稳定性[58]。乳状液的稳定主要通过增加空间位阻和改变连续相的界面性质或流变性来实现,内相包裹敏感活性物质以提高稳定性和控制在胃肠中释放。与传统的W/O型乳液相比,皮克林乳液的脂肪和盐含量更低,符合现代人类饮食的趋势。Lin Xiaoying等[62]利用含辛烯基琥珀酸藜麦淀粉的去离子水作为外水相,含聚甘油蓖麻醇酸酯的大豆油作为油相制备了负载花色苷的双重皮克林乳液(图4)。皮克林粒子替换了部分的表面活性剂以稳定乳液界面,界面上的固体颗粒在毛细管力或范德华力的作用下抵抗聚结和奥斯特瓦尔德熟化。负载花色苷的双重皮克林乳液包埋率最高可以达到95.8%,平均粒径可以达到30 μm,并且在模拟胃液中消化时能保持花色苷结构的完整性和较高的包埋率。而在模拟肠液中消化后,由于淀粉水解和乳液的破坏,大部分花色苷被释放出来,从而实现肠道精准靶向递送。
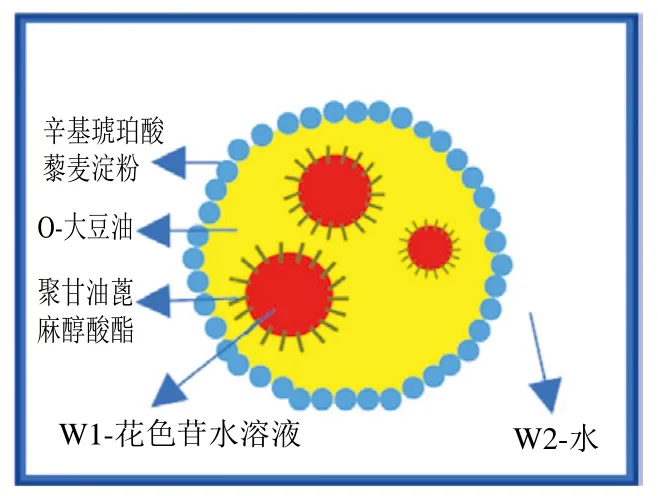
图4 辛烯基琥珀酸藜麦淀粉稳定的双重皮克林乳液示意图[62]Fig. 4 Schematic diagram of double Pickering emulsion stabilized by octenylsuccinate quinoa starch[62]
5 复合递送系统
单一的壁材并不能具备所有必需的特性,所以很多研究通过复合不同壁材之间的比例来改善包埋效果。Chotiko等[63]制备了4种不同花色苷的胶囊:包括果胶胶囊(1);覆盖玉米醇溶蛋白涂层的果胶胶囊(2);果胶-乳清分离蛋白复合胶囊(3);涂有玉米醇溶蛋白的果胶-乳清分离蛋白复合胶囊(4)。研究选用具有结肠特异性的并且带负电的果胶与带正电的乳清分离蛋白之间形成复合物以改善果胶高孔隙率的情况,并在果胶胶囊上用玉米醇溶蛋白包裹整个胶囊,结果表明,与对照相比,复合壁材(2)~(4)均提高了果胶胶囊的包埋率,其中,复合壁材(4)的包埋率最高,为(68.77±3.46)%。当胶囊暴露在胃肠模拟体系中,复合胶囊有利于保护花色苷并实现其在肠道中的缓释,但并未发现玉米醇溶蛋白对其的影响。Wang Shuo等[64]以壳聚糖盐酸盐、羧甲基壳聚糖和乳清分离蛋白为载体,将花色苷包埋在纳米复合物中,该纳米复合物具有较理想的粒径(332.20 nm)和zeta电位(+23.65 mV)以及较高的包埋率(60.70%)。经过包埋的花色苷抗氧化能力强于未经包埋的花色苷。在模拟体外消化过程中,由乳清蛋白和壳聚糖衍生物交联形成的双层涂层和花色苷之间的结合提高了花色苷在pH值较高环境下的稳定性,防止了肠道消化过程中的降解。将纳米复合物引入到咖啡饮料中,对功能饮料热处理后,保留了较高的花色苷含量,与不含花色苷的咖啡相比,该咖啡具有更高的抗氧化活性。
除了运用微载体递送系统进行递送以外,有研究者将辅色作用和微载体递送系统复合使用从而改善花色苷的稳定性。由于蛋白质-多糖壁材的众多活性基团(如巯基、氨基和羧基)在声空化过程中能够形成壳层交联的纳米胶囊包裹水相,随后通过改变pH值可以使非交联蛋白直接沉积回壁材交联表面从而形成额外的壳层,基于此,Tan Chen等[65]利用牛血清白蛋白和硫酸软骨素开发了一种稳定、高效、多功能的核-壳-壳纳米结构用于递送花色苷。双纳米壳层水核纳米胶囊的形成是由共价键和静电相互作用通过连续的交联和界面络合来驱动的,硫酸软骨素与牛血清白蛋白通过蛋白质间二硫键和酰胺键形成较强的交联,增强了交联壳层对花色苷的包埋。将辅色作用和包埋同时使用可以提高整个体系的稳定性。如图5所示,通过将花色苷与没食子酸乙酯以及硫酸软骨素辅色作用形成分子间络合物,与单独包埋花色苷的包埋率((47.4±1.6)%)相比,运用辅色作用以后包埋率可以达到(54.6±1.4)%,粒径为(147.0±0.4)nm,和单独包埋花色苷的粒径((149.4±1.2)nm)相差不大。并且这个体系对外界刺激(如pH值和氧化还原响应性释放)有很强的响应能力。
6 各种递送系统优劣势比较
花色苷作为天然着色剂,目前最大的应用瓶颈在于其稳定性。本文综述了目前研究较多的花色苷的几种递送系统,并对各种系统进行了描述和对比。各递送系统优劣势的比较如表1所示。以脂质、多糖和蛋白质等为材料制备的递送系统在提高花色苷口服过程中的稳定性和生物利用度方面效果显著,但仍存在一些问题。从已有文献报道可知,单一的多糖由于自身的局限性并不能实现很好的包埋,如壳聚糖易受到体系pH值的影响,不能在相对酸性的环境下存在,而海藻酸钠在碱性条件下稳定性较差,使负载药物易从颗粒孔隙中泄漏。多糖需要和其他材料如多糖、蛋白质、脂质体复合使用从而提高负载药物的稳定性,实现在胃肠道中的缓释。蛋白质虽然具有一定的抗氧化性,但是由于表面电荷和疏水性的作用,其对某些环境因素(pH值、离子强度、温度)的变化十分敏感[66-67]。传统的脂质体由于自身的局限,稳定性较差,长期贮存易发生聚集、磷脂氧化、药物泄漏等现象,开发新型的脂质体系统是很有必要的。复乳体系中皮克林乳液因包埋率较高,能起到缓释的作用,并且符合现代人类饮食的趋势,越来越受到人们的青睐,但热力学性质不稳定,会由于奥斯瓦尔德熟化、絮凝、聚集或重力作用而导致粒径粗化,需要寻找合适的固体粒子来稳定界面。

表1 各种递送系统优劣势比较Table 1 Comparison of advantages and disadvantages of various delivery systems
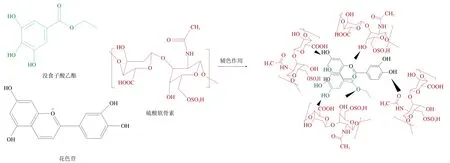
图5 花色苷共色纳米复合物形成的示意图[65]Fig. 5 Schematic diagram describing the formation of anthocyanin copigmentation nanocomplexes[65]
7 结 语
花色苷的精准靶向递送是实现精准营养干预的关键。未来,选择包埋率更高、成本更低、绿色安全环保的递送原料将成为产业追求的目标。筛选不同壁材或结合使用多种物理和化学方法提高花色苷稳定性将会是未来关注的重点。纳米技术的发展也为花色苷递送的研究提供了新的策略。值得注意的是,目前对于不同壁材构成的递送系统与花色苷之间的构效关系、花色苷与壁材的结合位点等研究较少,而对于花色苷递送系统的评价目前也主要基于体外胃肠模拟体系,未来需要进一步开展动物和人体实验,研究包埋后花色苷在体内的药代动力学,明确各种递送系统的吸收率和生物利用度,为花色苷的产品开发提供基础数据。
