苦瓜皂苷对秀丽隐杆线虫寿命的影响及其机制研究
2022-05-13张金富张佩熙何林钊武蓓琪
白 娟,张金富,张佩熙,何林钊,武蓓琪,祝 莹,李 洁,肖 香
(江苏大学食品与生物工程学院,江苏 镇江 212013)
衰老是机体的一种退化,主要表现为机体代谢功能与免疫调节能力的下降[1]。近年来,衰老相关疾病如代谢性和神经退行性等年龄相关退行性疾病,对中老年人的生活质量造成严重不良影响,给社会和家庭带来沉重经济负担[2]。合理的抗衰老措施可预防或延缓某些老年病,延长寿命。目前关于衰老机制的研究提出了多种学说,包括自由基氧化应激学说、细胞凋亡学说、端粒学说、线粒体DNA损伤学说等[3]。机制之间相互作用,特别是在代谢水平[4],但控制这些相互作用的机制在很大程度上仍不清楚。众多研究证据表明,脂质代谢的变化是健康衰老的显著特征[5]。在延缓衰老延长寿命的措施中,干预脂代谢是减缓衰老的关键组成部分。研究发现,脂质信号与衰老的相关性是一个未被充分探索的领域,具有促进健康和延长寿命的巨大可能性。
秀丽隐杆线虫(Caenorhabditis elegans)(简称线虫),是研究衰老的经典模式生物,其具有繁殖快、生命周期短、结构简单、基因组完整、发育定型和成本低廉等众多优势。线虫在进化上与哺乳动物高度保守,60%~80%以上的基因与人类疾病相关基因同源[6]。近年来,通过脂质信号分子干预线虫寿命,成为研究延缓衰老的热点。aak-2基因是线虫体内能量调控器之一,参与脂肪水解、脂肪酸氧化、多不饱和脂肪酸合成等生理过程[7]。研究表明,与野生型线虫相比,aak-2基因缺陷的线虫寿命较短[8]。胰岛素/胰岛素样生长因子(insulin like growth factor,IGF)-1信号(insulin/IGF-1 signaling,IIS)通路是无脊椎动物到哺乳动物体内公认的调控寿命与脂代谢的重要途径。其中,daf-2和age-1分别编码线虫唯一的胰岛素/IGF-1受体和磷脂酰肌醇-3-OH激酶(phosphatidylinositol 3-kinase,PI3K),这是IIS通路的两个关键上游因子[9]。daf-2的下游核转录调控因子daf-16是哺乳动物FOXO的同源基因,可调控脂肪沉积与衰老:daf-16的过表达能够促进脂质合成,诱导脂肪积累,引起线虫的高脂表型;而daf-16缺陷型线虫更易衰老,寿命短于野生型[10]。由此可知,线虫脂质代谢与寿命之间存在密切关联。
苦瓜(Momordica charantiaL.)是一种公认的药食同源食品,富含活性多糖、多肽、皂苷、类黄酮等活性成分,常被用来减肥降脂和辅助治疗糖尿病。皂苷作为苦瓜苦味成分主要来源,种类繁多,主要为三萜化合物(如苦瓜皂苷(bitter melon saponin,BMS)A、C、F1、I、K等)和类固醇类(如β-谷甾醇-β-D-葡萄糖苷、5,25-豆甾二烯醇-3-葡萄糖苷等)[11]。众多研究发现,BMS具有公认的类似胰岛素降血糖的特性[12],其调控机制主要包括激活一磷酸腺苷激活蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)和胰岛素受体-1(insulin receptor-1,IRS-1),促进下游葡萄糖转运子(glucose transporter 4,GLUT4)的转运,升高胞内糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)、细胞外信号调节激酶(extracellular-regulated kinase 1/2,ERK1/2)以及蛋白激酶(protein kinase,PK)Cζ/λ的含量等[12-13]。此外,苦瓜三萜皂苷还可通过下调3T3-L1前脂肪细胞过氧化物酶体增殖物激活受体(peroxisome proliferator-activated recep-tor,PPARγ)的表达,从而降低脂肪累积有效抑制前脂肪细胞分化并降低动物体内血脂水平,表现出明显的降脂功效[14]。因此,基于脂代谢与健康衰老紧密相关的理论基础,BMS的降脂作用是否对线虫自然寿命产生影响,有待进一步探索。
综上,本实验以线虫为模型,研究BMS对线虫生长、运动能力、脂肪沉积以及寿命的影响,通过实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)检测脂代谢相关基因的mRNA表达水平,并利用脂代谢相关基因缺失的线虫突变株,经寿命评估,建立BMS调控线虫寿命与脂代谢的相关性,为脂质代谢与寿命之间的饮食调节机制提供理论研究基础。
1 材料与方法
1.1 实验动物、材料与试剂
N2线虫和大肠杆菌OP50 东南大学王大勇老师课题组馈赠;aak-2(ok524)X、daf-16(mu86)、nhr-49(nr2041)、fat-5(tm420)V、fat-6(tm331)IV、fat-7(wa36)V、fat6(tm331)IV、fat-5(tm420)V、fat-7(wa36)、fat5(tm420)V、fat-6(tm331)IV、fat-7(wa36)V、atgl-1(tm3116)/hT2线虫突变体 美国普渡大学Keehong Kim实验室;苦瓜粉(粉体粒度≤105 μm)由江苏大学食品与生物工程学院中心实验室和镇江市爱邦电子科技有限公司制备。
油红O染色、甘油三酯(triglyceride,TG)和Bradford蛋白检测试剂盒 南京建成生物工程研究所;TaKaRa MiniBEST通用RNA提取试剂盒、Takara PrimeScript RT Master Mix试剂盒、SYBR®Premix ExTaqTM试剂盒 宝生物工程(大连)有限公司;2-脱氧-5-氟尿嘧啶核苷(floxuridine,FUDR) 上海阿拉丁生化科技股份有限公司;其余生化试剂购于国药集团上海化学试剂有限公司。
1.2 仪器与设备
JSZ6体式显微镜 江南永新光学仪器有限公司;Ci-L正置显微镜 日本Nikon公司;LRH-150生化培养箱上海一恒有限公司;FD-8真空冷冻干燥机 北京博医康有限公司;TG18G离心机 金坛市医疗仪器厂;YM50灭菌锅 上海三申医疗器械有限公司;SW-CJ-1D超净台 苏州净化设备有限公司;多功能酶标仪M200Pro上海天能科技有限公司;THZ-82B摇床 金坛市医疗仪器厂;HPBM-1行星式球磨机 长沙米淇仪器设备有限公司。
1.3 方法
1.3.1 苦瓜皂苷的制备和含量测定
称取苦瓜冻干粉100 g,按料液比1∶2(m/V)加入石油醚浸提12 h脱脂,倒去石油醚后再次按上述条件加入石油醚浸提12 h脱脂,倒去石油醚,待石油醚挥干后,加入1 L体积分数75%乙醇80 ℃回流提取两次,收集滤液,用等体积的水饱和的正丁醇萃取3次,取正丁醇相50 ℃浓缩至呈褐色黏稠状时冷却,用100 mL无水甲醇溶解后加入100 mL丙酮充分搅拌使之产生沉淀,8 000 r/min离心15 min,所得沉淀用100 mL无水甲醇溶解后加入100 mL丙酮充分搅拌使之产生沉淀,8 000 r/min离心15 min,冷冻干燥得到BMS粗提物。
BMS中皂苷含量的测定:精确称取干燥至恒质量的人参皂苷Rg1 5 mg,加甲醇定容至5 mL,摇匀,即得1 mg/mL的人参皂苷标准溶液。分别准确吸取标准溶液0.00、0.02、0.04、0.06、0.08、0.10、0.12、0.14、0.16、0.18、0.20 mL于具塞试管中,60 ℃水浴挥去溶剂,加入新制的50 g/L香草醛-冰乙酸溶液0.2 mL、高氯酸0.8 mL,摇匀,在60 ℃水浴中加热15 min,流水冷却后,加入5 mL冰乙酸,摇匀,放置20 min,测定550 nm波长处吸光度,以等体积甲醇作为空白对照。以人参皂苷Rg1质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线。将BMS用甲醇溶解成1 mg/mL溶液按同样方法测定吸光度,计算出BMS中皂苷的含量。
提取率测定:根据上述计算出BMS中皂苷的含量,占100 g苦瓜粉的比例,即为BMS的提取率(10.33%)。
1.3.2 线虫培养与BMS处理
M9缓冲液配制:分别称取磷酸二氢钾3 g、磷酸氢二钠6 g、氯化钠5 g,移液枪吸取1 mol/L MgSO4溶液1 mL至烧杯中,加去离子水定容至1 L,高压灭菌(121 ℃、20 min,后同)后分装使用。S-basal溶液配制:分别称取氯化钠5.85 g、磷酸氢二钾1 g、磷酸二氢钾6 g,加去离子水溶解,定容至1 L,高压灭菌冷却后加入1 mL质量浓度为5 mg/mL的胆固醇溶液(用乙醇溶解)。S-complete溶液配制:分别取1L S-basal溶液、10 mL 1 mol/L柠檬酸钾(pH 6)、10 mL微量金属溶液、3 mL 1 mol/L氯化钙、3 mL 1 mol/L硫酸镁混匀。线虫培养基的配制:分别称取氯化钠3 g 、蛋白胨2.5 g、琼脂17 g,加去离子水定容至1 L,高压灭菌,冷却至60 ℃后加入1 mL 1 mol/L氯化钙、1 mL 1 mol/L硫酸镁、75 mL 1 mol/L磷酸二氢钾缓冲液(pH 6.0),最后加入1 mL质量浓度为5 mg/mL的胆固醇溶液(用乙醇溶解),以上混匀后倒平板。
线虫用涂有大肠杆菌OP50的线虫培养基在20 ℃培养箱中培养。
线虫同步化处理:用2 mL M9缓冲液将处于产卵期的线虫转移至EP管中,离心(4 000 r/min、3 min,后同)弃去上清液,再加入2 mL M9缓冲液按上述方法清洗两次。洗净之后的线虫1 mL加入裂解液(0.5 mol/L NaOH溶液和质量分数2.5% NaClO),漩涡振荡。线虫裂解充分后,离心弃上清液,用2 mL M9缓冲液清洗,清洗3次后将虫卵转移至20 ℃培养箱中孵育12 h得L1期幼虫,备用。
BMS处理:根据BMS中皂苷含量,用少量甲醇复溶BMS冻干物,利用S-complete溶液配制皂苷质量浓度为10 mg/mL的母液,与大肠杆菌菌液混匀至终质量浓度为0(对照组)和50、100、200 μg/mL,涂布于L1期幼虫线虫培养基上供线虫食用,在20 ℃培养箱中培养48 h。
1.3.3 油红O染色
2 mL M9缓冲液收集BMS处理48 h后的线虫(约1 000 条),4 000 r/min离心3 min弃去上清液,再加入2 mL M9缓冲液清洗3次。加入500 μL 体积分数60%异丙醇脱水固定,4 000 r/min 离心3 min,弃上清液;接着加入500 μL油红O染色液,室温避光振荡6~18 h,4 000 r/min离心3 min,然后加入2 mL M9缓冲液清洗3次。最后加入250 μL 0.01%(体积分数)Triton-X100-M9缓冲液,立即在正置显微镜下拍照。
1.3.4 甘油三酯相对含量测定
BMS处理48 h后,用M9缓冲液洗线虫3次,自然沉降,弃上清液。加入一定量M9缓冲液重悬,超声破碎虫体,5 000 r/min离心10 min,取上清液根据TG试剂盒说明书测定TG含量,蛋白质含量根据Bradford蛋白浓度测定试剂盒测定。每组3个平行。各组TG含量与对照组的比值×100%即为TG相对含量。
1.3.5 线虫基础生理指标的测定
体长和体宽测定:BMS处理48 h后,随机挑取30 条左右线虫于500 μL M9缓冲液中,加入适量0.5 mol/L叠氮化钠,待线虫身体僵直后,盖上盖玻片。正置显微镜拍照,利用ImageJ软件测定线虫体长、体宽。
运动指标的测定:BMS处理48 h后,随机挑取30 条左右线虫于500 μL M9缓冲液中,测定头部摆动频率和身体弯曲频率。头部摆动频率:记录1 min内线虫头部摆动次数,挑取30 条左右线虫于500 μL M9缓冲液中,滴于载玻片,于显微镜下计数(1个往返为摆动一次);身体弯曲频率:记录1 min内线虫身体弯曲次数,假设以咽泵的方向规定为y轴,在爬行过程中,线虫身体沿着x轴方向完成1次正弦运动即为1次身体弯曲。每组30 条线虫。
1.3.6 寿命评估
同步化L1幼虫在线虫培养基上经BMS处理48 h后,2 mL M9缓冲液洗3 遍,转至S-complete缓冲液在Transwell培养板上中培养。加入终浓度120 μmol/L的FUDR以防线虫产卵。每组约100 条线虫,每隔2 d换新鲜培养液(含一定质量浓度BMS和120 μmol/L的FUDR的S-complete缓冲液),每隔1 d记录线虫数量,线虫存活数量与初始线虫总数的比值×100%即为线虫存活率。采用OASIS(https://sbi.postech.ac.kr/oasis2/surv/)在线分析程序对寿命曲线进行统计分析,得到线虫的最长寿命,P值采用log-rank(Mantel-Cox法)确定。
1.3.7 实时荧光定量PCR
采用TaKaRa MiniBEST通用RNA提取试剂盒提取线虫总RNA(每组约2 000 条)。利用Takara PrimeScript RT Master Mix试剂盒反转录生成cDNA,根据SYBR®Premix ExTaqTM试剂盒说明书进行实时荧光定量PCR操作,按照2-ΔΔCT方法处理数据,以act-1基因作为内参。引物由上海生工生物工程股份有限公司按标准设计并合成,引物序列如表1所示。

表1 线虫脂代谢相关基因的引物序列Table 1 Primer sequences used for amplification of genes involved in lipid metabolism in C. elegans
1.4 数据统计与分析
实验结果用平均值±标准差表示。采用DPS软件进行统计分析,采用单因素方差分析进行显著性分析;用t检验比较组间差异,P<0.05表示差异显著。
2 结果与分析
2.1 BMS对线虫脂肪沉积的抑制作用
为了确证本研究中BMS在线虫体内抑制脂肪沉积的作用,首先通过油红O和TG试剂盒检测BMS对线虫整体脂肪含量的影响。如图1所示,与对照组相比,除50 μg/mL BMS处理外,100、200 μg/mL BMS处理均能明显降低线虫整体脂肪含量,使TG相对含量分别显著降低28.60%和33.02%(P<0.05)。体内外研究已指出,BMS具有明显的降脂效果,如有效抑制前脂肪细胞分化、降低动物体内血脂水平[14-15]。其机制可能通过下调PPARγ的表达抑制3T3-L1前脂肪细胞的分化,降低脂肪酸脱饱和酶基因fat-5、fat-6、fat-7表达水平,抑制线虫脂肪合成[16]。
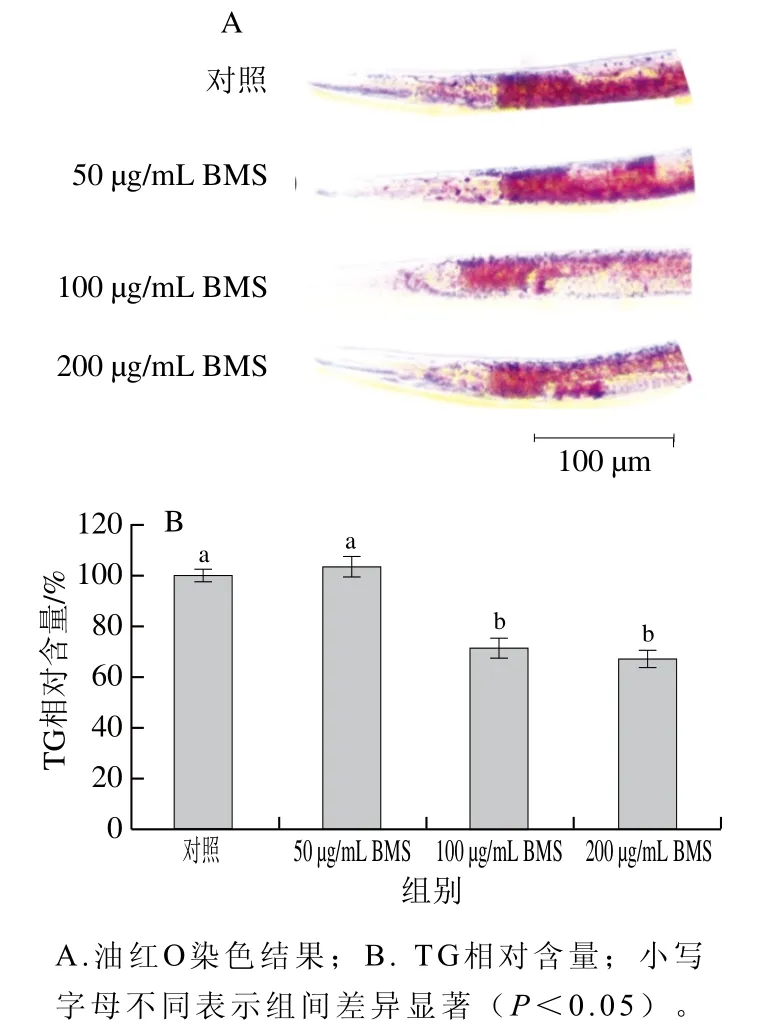
图1 不同质量浓度BMS对线虫TG相对含量的影响Fig. 1 Effect of BMS at different concentrations on the relative content of TG in C. elegans
2.2 BMS对线虫体长、体宽和运动能力的影响
在确证100、200 μg/mL BMS对线虫脂肪沉积的抑制作用后,需进一步评估该质量浓度作用下是否对线虫体长、体宽和运动能力等基础生理指标有不利影响。由表2可知,BMS对线虫头部摆动频率和身体弯曲频率无明显的改变,表明100、200 μg/mL BMS不影响线虫的运动能力(P>0.05)。研究表明,运动能力一定程度上反映能量消耗[17]。并且,BMS对线虫的体长体宽基础生理指标也无显著影响(P>0.05),说明BMS对线虫的生长无抑制作用。由此可推断,BMS缓解线虫的脂肪累积并非通过抑制线虫的生长发育,其机制可能与调节线虫脂肪合成或脂肪酸氧化途径密切相关[18]。
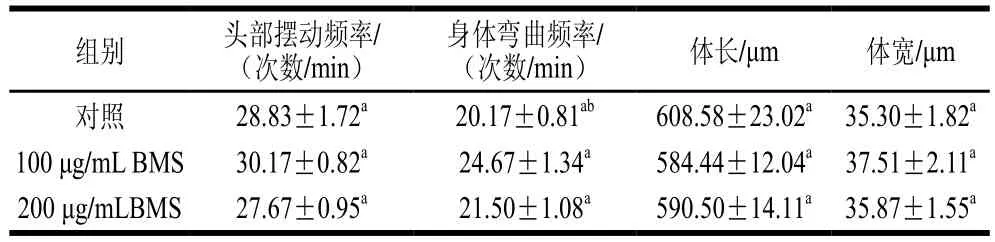
表2 BMS提取物对线虫基础生理指标的影响Table 2 Effect of BMS on basic physiological activities of C. elegans
2.3 BMS对野生型线虫自然寿命的影响
为测定BMS对线虫自然衰老的作用,本实验采用液体培养法对线虫寿命进行评估。由图2和表3可知,与对照组(平均寿命为(21.14±0.35)d)相比,100、200 μg/mL BMS处理后的线虫平均寿命分别为(23.39±0.33)d和(23.16±0.33)d,均能高度显著延长野生型线虫的寿命(P<0.000 1),延缓其衰老。基于100 μg/mL和200 μg/mL BMS均有降脂和延长寿命的作用,因此,选取100 μg/mL BMS用于后期突变体的验证实验。已有大量研究发现,食品功能成分如白皮杉醇依赖IIS通路中核转录因子daf-16延长线虫寿命[19];菊苣酸通过抗氧化因子skn-1介导的分子途径延缓线虫的衰老[20];三七多糖和齐墩果酸均可通过降低活性氧氧化应激延长线虫平均寿命[21-22]。并且,最新研究报道表明,BMS可通过上调线虫skn-1及其下游抗氧化基因(sod-3、sod-5、clt-1和clt-2)的表达,提高线虫体内抗氧化活性,从而延长氧化应激下的寿命[23]。根据以上研究可知,现有的关于食品功能因子延寿抗衰老的机制研究主要集中在线虫经典的IIS通路或抗氧化角度。然而,由于脂质代谢与寿命密切相关,BMS是否可通过抑制脂质沉积延长线虫自然条件下的寿命,仍需进一步深入研究。
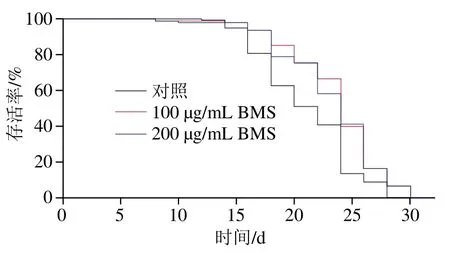
图2 不同质量浓度BMS对线虫寿命的影响Fig. 2 Effect of BMS at different concentrations on the lifespan of C. elegans
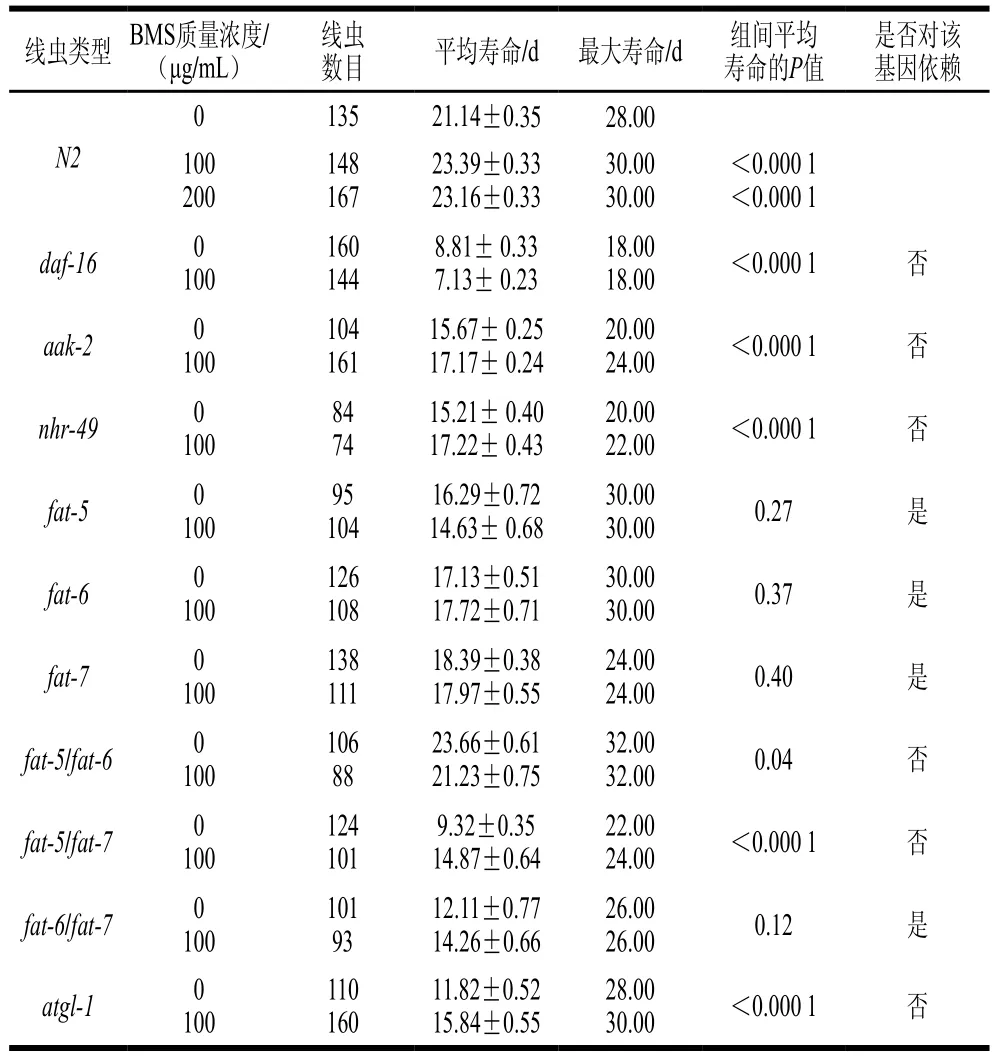
表3 BMS对野生型和突变型线虫平均寿命的影响Table 3 Influence of BMS on survival rates of wild-type and mutant C. elegans
2.4 BMS延长线虫自然寿命对IIS通路的依赖性
线虫脂质代谢涉及的通路主要包括IIS通路和脂肪酸氧化、脂肪酸合成、脂肪分解通路等。本实验采用实时荧光定量PCR技术分别对上述通路中关键基因的表达水平进行测定,筛选出BMS调控脂代谢的关键基因,为研究BMS延长寿命的机制提供实验基础。IIS通路参与调控线虫体内能量稳态,其中daf-2是IIS通路中的上游分子,daf-2的激活诱导age-1的表达,继而阻止daf-16的核易位,导致daf-16的磷酸化和失活[24]。如图3所示,BMS对daf-2和daf-16基因表达均无显著改变(P>0.05),表明在转录水平BMS对IIS通路中关键因子daf-2和daf-16无明显作用。
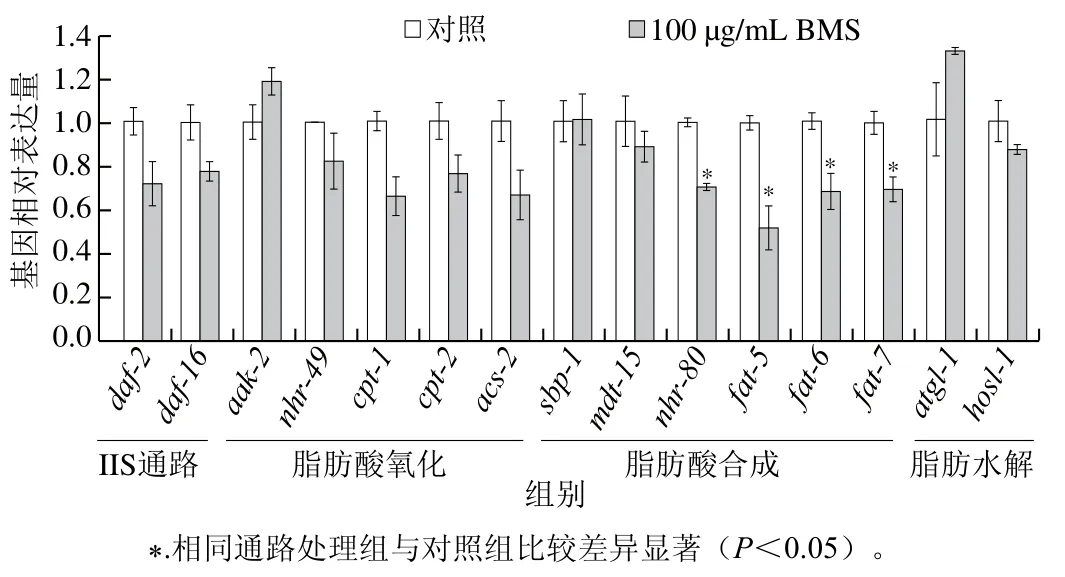
图3 BMS对线虫脂代谢调控基因表达的影响Fig. 3 Effect of BMS on expression levels of genes involved in lipid metabolism in C. elegans
由于分子调控过程包括转录、转录后以及翻译水平的调控,因此本实验利用daf-16基因缺陷型线虫突变体,验证BMS延长线虫自然寿命对IIS通路的依赖性。由图4A和表3可知,在daf-16突变体中,BMS并不能明显延长突变体自然寿命,反而缩短了突变体的平均寿命(P<0.000 1)。结合daf-2和daf-16基因的mRNA表达水平结果可得,BMS延长野生型线虫的自然寿命不依赖于daf-16介导的胰岛素信号通路。Peng Ye等也发现,菊苣酸具有延长野生型线虫寿命的功能,而在摄食量相关基因eat-2突变体中却表现出缩短线虫寿命,表明菊苣酸延长寿命的作用不通过调节饮食的摄入量[20]。
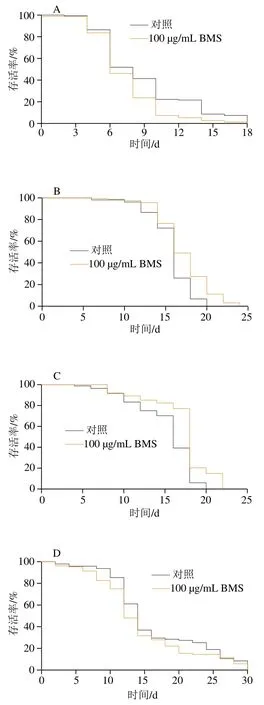
2.5 BMS延长线虫自然寿命对脂肪酸氧化通路的依赖性
在线虫中,AMPK的亚基由aak-1和aak-2编码,是细胞中的能量感受器,维持体内能量平衡。研究指出,AMP与ATP比例的增加可激活线虫内一磷酸腺苷激活蛋白激酶(AMP-activated kinase-2,AAK-2),使得脂质代谢中关键酶磷酸化,从而促进脂肪分解代谢(脂解和脂肪酸氧化)或抑制脂肪酸、TG或胆固醇的合成代谢[25]。aak-2的下游基因主要参与脂肪酸氧化、脂肪合成与分解生理过程。从脂肪酸氧化角度,BMS略微增加aak-2和降低核转录因子nhr-49的基因表达量(图3,P>0.05),且对下游基因肉毒碱棕榈酰转移酶cpt1/cpt2、乙酰CoA合成酶acs-2的表达均无显著改变,初步表明BMS可能对脂肪酸氧化通路无调控作用,但其确切的调控作用仍需在蛋白水平进一步明确。并且,在aak-2和nhr-49基因缺陷型突变体中,依然维持延长线虫寿命的特性(图4B、C和表3,P<0.000 1)。结合两部分结果显示,BMS延长线虫寿命与脂肪酸氧化通路无相关性。
BMS具有公认的类似胰岛素降血糖的特性。Han等发现BMS组分可降低糖尿病小鼠血糖,其机制可能与BMS组分中三萜类化合物激活脂肪细胞AMPK通路,从而促进葡萄糖吸收有关[12]。且其他相关研究也指出,BMS是潜在的AMPK激动剂[26]。然而,本研究结果显示,BMS对aak-2/AMPK的mRNA表达无影响。考虑到转录后调控的作用,BMS可能对线虫AAK-2蛋白的表达有影响,而本实验未涉及到BMS降脂机制的深入研究。且围绕本实验的主题,aak-2基因的缺失确实不改变BMS延长寿命的功效,由此确证aak-2在BMS延寿过程中无调控作用。与Lin Chunxiu等的研究结果类似,BMS也对nhr-49下游乙酰CoA合成酶acs-2的表达无显著改变,显示BMS可能不通过脂肪酸氧化途径调节脂代谢[16]。
2.6 BMS延长线虫自然寿命对脂肪酸合成通路的依赖性
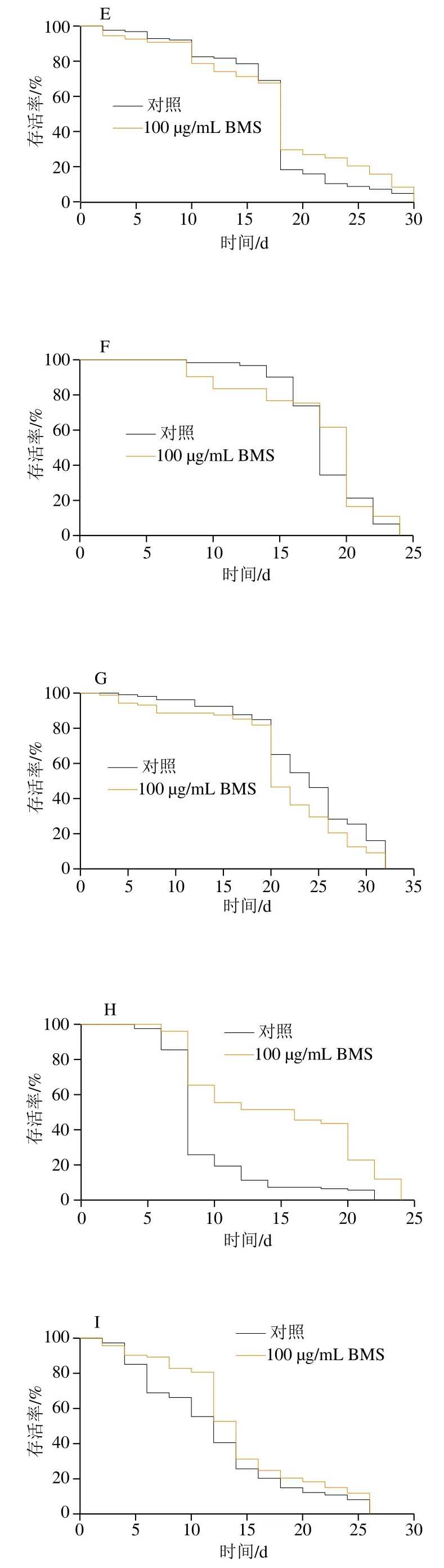
线虫主要从其食物——大肠杆菌中外源性获取脂肪酸,或者通过乙酰CoA内源性从头合成脂肪酸,即乙酰CoA在各级脂肪酸合成酶催化下逐步转化为磷脂酸、二酰基甘油,最终转化为TG[27]。线虫体内脂肪合成的关键步骤是单不饱和脂肪酸(monounsaturated fatty acids,MUFAs)的合成,其中Δ9脂肪酸脱饱和酶(fatty acid desaturase,FAT)中的FAT-5、FAT-6和FAT-7发挥极为重要的作用。实时荧光定量PCR结果显示(图3),BMS显著下调脂肪酸合成途径中fat-5、fat-6和fat-7,以及调控Δ9脂肪酸脱饱和酶的核转录因子nhr-80的基因表达水平,提示BMS降脂的机制与抑制脂肪合成途径密切相关。同样,sbp-1与mdt-15也是fat-5、fat-6和fat-7的上游调控因子,但BMS对sbp-1与mdt-15的表达无显著影响。基于此,本实验着重采用编码Δ9脂肪酸去饱和酶的基因缺陷型线虫,包括单突变体与多突变体,探究BMS延长线虫自然寿命是否依赖性于Δ9脂肪酸去饱和酶介导的脂肪酸合成途径。结果发现,在单基因缺陷型fat-5、fat-6和fat-7突变体,以及其双突变体中,除fat5/fat6和fat5/fat7双突变体外,BMS不能显著延长线虫自然寿命(图4D~I和表3,P>0.05),表明编码Δ9脂肪酸去饱和酶的基因是BMS延寿作用中的必要基因。
FAT-5去饱和酶特异性作用于棕榈酸(C16:0),而FAT-6和FAT-7主要使得饱和硬脂酸(C18:0)脱饱和,从而合成MUFAs。fat-5、fat-6或fat-7基因表达水平与TG水平呈正相关[28]。研究表明,参与脂肪酸去饱和过程的基因包括一些转录调节因子上调,如sbp-1(哺乳动物中SREBP-1的同源基因)、daf-16(IIS通路中daf-2的下游转录因子)、nhr-49和nhr-80(核激素受体基因)以及与nhr-49或sbp-1相结合的亚基mdt-15[29-30]。结合本实验结果,在这些转录因子中,BMS仅对核激素受体nhr-80显著下调,提示nhr-80在BMS调控脂肪酸合成中起关键作用。研究发现,nhr-80基因缺陷型突变体会显著降低fat-5和fat-7的表达,并伴随脂肪酸组成的变化,如18∶0与18∶1Δ9的比例。近期有研究报道称,线虫可通过fat-7提高不饱和脂肪酸(unsaturated fatty acids,UFAs)与饱和脂肪酸(saturated fatty acids,SFAs)的比例,增强线虫在寒冷刺激下的耐受力,延长寿命。由此表明,Δ9脂肪酸脱饱和酶在维持线虫UFAs与SFAs的平衡中发挥重要作用,并对线虫寿命具有调控作用。因此在本研究中,BMS很大程度依赖Δ9脂肪酸去饱和酶介导的脂肪酸合成途径,延长线虫的自然寿命。其中,结合双突变体寿命的验证发现,仅fat-6/fat-7双突变体在BMS的处理下寿命未延长,表明相比于fat-5,fat-6和fat-7在BMS延寿功效中的作用更加明显,但其确切的作用机制可进一步通过脂质组学分析各类不饱和脂肪酸水平来验证。
2.7 BMS延长线虫寿命对脂肪分解通路的依赖性
脂质代谢过程主要包括脂肪的合成与分解。脂肪水解在提供能量方面起重要作用,涉及到复杂的信号级联和连续酶激活反应。线虫体内,脂肪甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)-1是脂肪水解过程中的关键脂肪酶。此外,激素敏感脂肪酶(hormonesensitive lipase homolog,HOSL)-1是多功能脂肪酶,能够水解多种酰基酯,包括TG、二酰基甘油和单酰基甘油[31]。线虫的脂肪水解过程中,ATGL-1和HOSL-1可水解90%以上的TG,且以ATGL-1为主。实时荧光定量PCR结果显示,BMS对两种脂肪酶的mRNA水平均无明显的改变。并且,在atgl-1突变体内,BMS的延寿作用依然存在,表明ATGL-1的缺失对BMS延长线虫寿命作用无影响。间接说明BMS延寿作用很大程度不依赖于ATGL-1介导的脂肪水解过程。
研究显示,ATGL-1也被鉴定为应对禁食的关键脂肪酶。课题组前期研究发现,酯酰辅酶A∶胆固醇酰基转移酶1(acetyl-CoA acetyltransferase 1,ACAT1)抑制剂Avasimibe,可通过ATGL-1促进线虫在禁食条件下的脂肪水解提供能量,从而延长线虫在禁食刺激下的寿命[6]。本研究表明,BMS延长线虫自然寿命的作用与脂肪水解过程无相关性,可能缺失间歇或长期禁食的刺激。
3 结 论
本研究表明BMS在不影响线虫生长发育前提下,具有缓解线虫脂肪沉积,并延长自然寿命的功效。基于脂质代谢与寿命间的紧密联系,本研究发现BMS的延寿作用很大程度上依赖于Δ9脂肪酸去饱和酶介导的脂肪酸合成途径,继而从脂代谢角度阐明了BMS延长线虫自然寿命的分子机制。本研究结果可为BMS功能因子的研究和开发提供可靠的理论依据,但寿命调控机制错综复杂,仍有待继续深入探究。
