加工工艺对酱牛肉蛋白质结构和水分分布的影响
2022-05-13王守伟吴倩蓉臧明伍张顺亮乔晓玲潘晓倩刘博文
李 素,王守伟,朱 宁,吴倩蓉,陈 松,臧明伍,赵 冰,3,张顺亮,乔晓玲,*,潘晓倩,刘 梦,刘博文
(1.中国肉类食品综合研究中心,北京 100068;2.河南双汇投资发展股份有限公司,河南 漯河 462000;3.北京食品科学研究院,北京 100068)
酱牛肉是我国重要的传统肉制品,此类产品具有风味独特、高蛋白、低脂肪的特点,同时含有丰富的矿物质,营养价值较高。加工工艺的差异会影响酱牛肉的营养成分和质构特性等食用品质,而二次杀菌后产品品质劣变更为严重,比如生成高温蒸煮味和组织质地变差等。为改善酱牛肉产品食用品质,探究其品质劣变机理,国内外学者开展了部分研究。陈立业等[1]发现定量卤制工艺的酱牛肉食用品质优于常规煮制的酱牛肉;有学者发现超声波辅助腌制可有效地提升酱牛肉的食用品质[2-3]。经查阅资料发现,针对酱牛肉产品风味成分分析的相关研究较多,Zou Yunhe等[4]研究了超声辅助腌制对辣牛肉风味物质的影响;吴倩蓉等[5]研究了加工工艺对酱牛肉中蛋白质降解及风味物质的影响;Zang Mingwu[6]等对7种典型五香酱牛肉的挥发性风味进行了研究。高温杀菌技术可以有效延长产品货架期,不同的杀菌条件可以影响产品的风味、质构、营养等特性[7-9],也会对蛋白质及产品结构造成较大程度的破坏。蛋白质是肉制品中主要的营养物质之一,肉品中蛋白质特性对肉制品的食用品质有重要影响[10-11]。为深入了解加工工艺对蛋白质影响机理,国内外学者开展了一些研究,其中,Sharedeh等[12]对滚揉腌制促进肉的盐分渗透效果进行了评估;Deb-Choudhury等[13]分析了pH值、温度和时间对食品中蛋白质品质特性的影响;康怀彬等[14]以牛背最长肌为研究对象,发现高温加热能显著改变牛肉蛋白质的化学作用力及肌原纤维蛋白的结构。但是,经查阅资料发现,鲜有针对酱牛肉产品从蛋白质结构变化角度开展的加工工艺影响其品质的机理研究。此外,肌肉的微观结构由肌纤维、水分、蛋白质等组成,肉制品水分分布情况也会影响蛋白质结构[15]和产品的食用品质[16],因此,低场核磁共振弛豫测量法也被广泛用于肌肉和肉中水分分布和流动性变化分析。
酱牛肉加工过程中会发生质量损失、蛋白变性、质构、风味变化等一系列物理化学变化[17-18],部分变化会使得产品品质发生劣变。蛋白质是酱牛肉中的主要成分之一,深入分析加工过程中产品蛋白质结构变化,有助于明确酱牛肉品质形成机理,也可以为其他牛肉类高温产品生产加工提供参考。鉴于鲜有针对传统酱牛肉产品开展的从原料至最终产品水分分布和蛋白结构变化的研究,本研究以酱牛肉为研究对象,选取原料肉和滚揉腌制、卤制及不同二次杀菌温度(90、100、110、120 ℃)样品,对其蛋白质浊度、相互作用力、结构变化和水分分布的规律进行研究,为酱牛肉产品品质精细化调控提供理论支撑。
1 材料与方法
1.1 材料与试剂
牛腱 河北福成五丰食品股份有限公司;磷酸二氢钠、磷酸氢二钠、Tris、KCl、尿素、NaOH、β-巯基乙醇国药集团化学试剂有限公司。
1.2 仪器与设备
M2e多功能酶标仪 德国MD公司;Sorvall LYNX4000高速离心机、Nicolet iS10傅里叶变换红外光谱仪 美国赛默飞世尔科技公司;LGJ-30D冷冻干燥机北京四环科学仪器厂有限公司;SU8020场发射扫描电子显微镜 日本Hitachi公司;NMI20-040-I核磁共振分析仪 上海纽迈电子科技有限公司。
1.3 方法
1.3.1 样品制备
参照文献[19]中方法进行酱牛肉加工,其中滚揉腌制用水量为牛肉质量的10%。依次对酱牛肉加工过程中原料肉、滚揉腌制样品、卤制样品取样,卤制后产品采用4种温度(90、100、110、120 ℃)杀菌20 min,杀菌完成后分别取样。所选取7个取样点的牛肉样品(原料肉、滚揉腌制样品、卤制样品、90 ℃杀菌样品、100 ℃杀菌样品、110 ℃杀菌样品、120 ℃杀菌样品)依次编号为A、B、C、D、E、F、G。
1.3.2 蛋白质提取
参考Visessanguan等[20]的方法并适当调整,取适量不同加工点的样品绞碎,按1∶20(m/V)加入冷却磷酸盐缓冲液(15.6 mmol/L Na2HPO4、3.5 mmol/L NaH2PO4),10 000 r/min匀浆2 min,然后离心(4 ℃、8 000 r/min,7 min),收集上清液为肌浆蛋白溶液;沉淀部分继续加入20 倍体积的冷却提取液(15.6 mmol/L Na2HPO4、3.5 mmol/L NaH2PO4、0.7 mol/L NaCl),10 000 r/min匀浆2 min,4 ℃静置过夜后离心,上清液为肌原纤维蛋白溶液。将制备的两种蛋白溶液经冷冻干燥得到蛋白质冻干粉,采用二喹啉甲酸(bicinchoninic acid,BCA)蛋白含量测定试剂盒测定蛋白含量,以牛血清白蛋白作为标准物质绘制标准曲线,在562 nm波长处测定吸光度,取3次测定结果的平均值,蛋白质冻干粉密封后-20 ℃下贮藏备用。
1.3.3 浊度的测定
取各样品蛋白质冻干粉,参照文献[21]中方法测定浊度,平行测定3次,以350 nm波长处吸光度A350nm表示浊度。
1.3.4 相互作用力相对含量的测定
参考文献[20]的方法并适当调整,结果取3次测定结果的平均值。
溶液配制:配制6 mol/L的KCl溶液为S1反应液;配制20 mmol/L Tris溶液调节pH值至8.0为S2反应液;配制pH 8.0、含1%(质量分数)的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)的20 mmol/L Tris溶液,调节pH值至8.0即S3反应液;配制pH 8.0、含1%(质量分数)SDS和8 mol/L尿素的20 mmol/L Tris溶液,即S4反应液;配制pH 8.0、含1%(质量分数)SDS、8 mol/L尿素和2%(体积分数)β-巯基乙醇20 mmol/L Tris溶液,即S5反应液;0.5 mol/L NaOH为S6反应液。
样品处理:取牛肉样品各2.00 g,分别加入20 mL上述反应液于室温下振摇4 h,其中加入S5反应液的样品需先沸水浴2 min。样品振摇结束后以6 000 r/min离心10 min,取上清液4 mL转移至10 mL离心管中,加入体积分数50%三氯乙酸(trichloroacetic acid,TCA),使TCA终体积分数为10%,样品于4 ℃下静置18 h后离心(4 ℃、3 000 r/min,3 min),弃去上清液,向沉淀中分次加入0.5 mol/L NaOH,转移至10 mL容量瓶定容,采用双缩脲试剂法测定蛋白质量浓度,即不同反应液中蛋白质溶解度,以S1~S5反应液中蛋白质溶解度占S6反应液中蛋白质溶解度的百分比分别表征静电相互作用力、范德华力、氢键、疏水相互作用力和二硫键相对含量。
1.3.5 扫描电子显微镜观察微观结构
取各样品蛋白质冻干粉粘贴于样品铜台,进行真空离子溅射喷金处理,电压为3 kV,镀膜2~3 min后进行扫描电子显微镜观察,放大倍数为5 000 倍,电子显微镜图比例尺为10 μm。
1.3.6 二级结构的测定
利用傅里叶变换红外光谱仪测定蛋白质冻干粉的二级结构的变化。1 600~1 639 cm-1波段代表β-折叠结构;1 640~1 650 cm-1波段代表无规则卷曲结构(C=O与水形成氢键);1 651~1 660 cm-1波段代表α-螺旋结构;1 661~1 700 cm-1波段代表β-转角结构,根据峰面积计算各二级结构的相对含量。
1.3.7 水分分布的测定
将牛肉样品切成长宽高约1 cm×1 cm×2 cm的肉块,置于核磁共振成像仪永磁场中心位置的射频线圈中心,进行磁共振波谱测定,共振频率18 MHz,磁体强度0.5 T,线圈直径为40 mm,磁体温度为(32.00±0.01)℃。采用核磁共振分析软件中的CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定样品中的横向弛豫时间T2,CPMG脉冲序列参数为:主频23 MHz、偏移频率286.781 3 kHz、90°脉冲时间17 μs,180°脉冲时间35 μs;采样点数54 996;重复时间3 000 ms;累加次数4次;回波数2 000。结果取3次样品测定的平均值。
1.4 数据处理与分析
利用Excel 2010软件进行数据处理,采用Orign 8.0软件进行绘图,利用SPSS 21.0软件进行单因素方差分析,采用Duncan检验进行显著性差异分析,P<0.05表示差异显著,利用Peakfit v4.12软件分峰拟合,计算蛋白质二级结构相对含量。
2 结果与分析
2.1 蛋白质浊度变化
吸光度可以用来反映蛋白质聚集的程度,吸光度增加表示形成了大的聚合物。浊度可以反映蛋白质溶液中悬浮粒子的大小及数量,蛋白分散时悬浮颗粒直径小,浊度低;蛋白聚集后,悬浮颗粒直径变大,浊度也对应升高[22]。本研究用A350nm表征体系浊度。从图1中可看出,酱牛肉加工过程中肌浆蛋白及肌原纤维蛋白的浊度变化趋势接近,原料肉质中蛋白质浊度较高,说明原料肉中蛋白质处于聚集状态,悬浮颗粒直径较大。滚揉工艺可以使蛋白质浊度显著降低(P<0.05),说明通过滚揉过程蛋白质结构被打散,溶解度增加,从而获得较低的浊度。经热加工后浊度增高,说明热处理致使蛋白大量发生聚集、交联、絮凝等变化,从而使蛋白溶液浊度上升。经过二次杀菌后蛋白质浊度呈波动变化趋势,其中,90 ℃杀菌样品与110 ℃杀菌样品浊度较高,100 ℃杀菌样品和120 ℃杀菌样品浊度较低,随杀菌温度升高,样品浊度变化无明显规律,说明不同杀菌温度条件下蛋白质内部基团暴露程度可能有所不同,主要相互作用力也不同,从而影响了蛋白聚集体的差异。马海霞等[23]对乌贼肌原纤维蛋白不同加热温度下的浊度变化进行了研究,也发现随着温度升高浊度升高,但达到一定温度后浊度开始有所降低。
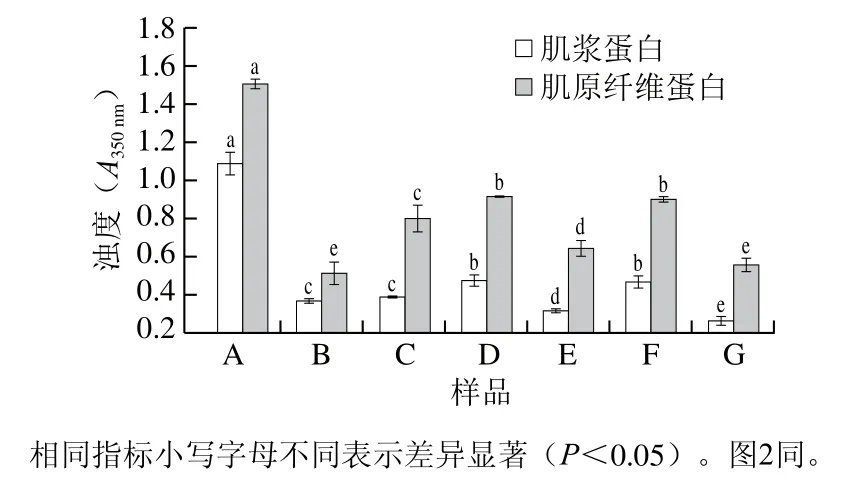
图1 酱牛肉样品蛋白质浊度变化Fig. 1 Changes in turbidity of sarcoplasmic and myofibrillar protein from spiced beef
2.2 蛋白质相互作用力的变化
相互作用力可以影响蛋白质在不同溶剂中溶解度,酱牛肉加工过程中蛋白质分子间相互作用力会发生不同程度变化,进而影响其品质和加工性能。从图2可以看出,样品熟制前S1反应液中蛋白质溶解度较高,说明蛋白质间相互作用力主要是静电相互作用力,且滚揉工艺显著加强了蛋白质间的静电相互作用力(P<0.05),熟制后蛋白质溶解度显著降低(P<0.05),说明热处理可以削弱蛋白质间的静电相互作用力,不同温度二次杀菌后样品中蛋白质溶解度无显著差异(P>0.05)。S2反应液用于提取水溶性蛋白质,S2反应液中变化趋势与S1反应液类似,即熟制前溶解度较高,熟制后溶解度降低,且滚揉工艺可以增加其溶解度;经煮制及杀菌等热处理后溶解度降低,说明蛋白质多肽链发生伸展和去折叠,改变了蛋白质的天然结构,使其发生变性和聚集[24-25],从而溶解度降低。原料肉中蛋白在S3反应液中溶解度最高,说明氢键是原料肉中主要相互作用力,且滚揉工艺显著增加了蛋白质间氢键相互作用力(P<0.05),经熟制后蛋白质在S3反应液中溶解度明显降低,说明高温使氢键发生了断裂,致使其含量急剧减少,这与其他学者研究结果[14,26]一致,但本研究中不同杀菌温度处理后氢键含量无显著差异(P>0.05)。S4反应液体系中的蛋白溶解度体现蛋白质间疏水相互作用力,原料肉中疏水作用力最低,经滚揉加工后疏水相互作用力增加,说明滚揉工艺可以促进疏水基团的暴露,促进疏水相互作用力提升,经卤制工艺后疏水相互作用力大幅降低,可能是由于较高的加热温度使得疏水基团周围的水分子有序度降低[27];经二次杀菌的样品,随温度升高,疏水相互作用力有缓慢降低的趋势(P>0.05),也可能是由于杀菌过程中压力的增加使得蛋白质凝胶网状结构逐步加强,蛋白质的三维结构被改变[28]。蛋白质在S5反应液中溶解度均处于较高水平,用于表示蛋白质间的二硫键,研究发现,原料肉中二硫键含量较低,经滚揉和热处理后其含量显著升高(P<0.05),可能是蛋白质溶解度增高,蛋白质结构展开,暴露的巯基通过二硫键形成聚集,有研究表明热处理可以促进蛋白质分子内二硫键的生成[29]。不同二次杀菌温度对二硫键无显著影响(P>0.05)。
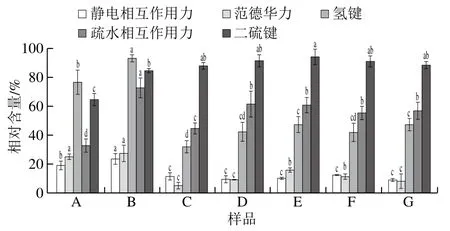
图2 酱牛肉样品中蛋白质分子间相互作用力变化Fig. 2 Changes of protein-protein interactions in spiced beef
2.3 蛋白质扫描电子显微镜观察结果
酱牛肉加工过程中蛋白质会发生不同程度变性,致使蛋白质结构遭到破坏。加工过程中肌浆进行观察蛋白及肌原纤维蛋白的微观结构采用扫描电子显微镜进行观察。在不同的加工步骤下,肌浆蛋白及肌原纤维蛋白的结构有很大的不同,随着加热工艺的进行,蛋白质结构逐渐变得紧密,蛋白质之间的连接增强,孔洞数目增多,孔径减小,微观结构更加均匀细腻。
由图3可知,原料样品肌浆蛋白颗粒结构完整,表面比较平滑,聚集度较好,质地圆润,饱满且结构紧密。经滚揉工艺加工后肌浆蛋白结构发生变化,开始出现孔洞,蛋白质质地及光泽度也开始下降。经卤制后蛋白质结构进一步遭到破坏。样品经二次杀菌后其蛋白质结构被破坏程度更高,蛋白质颗粒破碎的更小、更细,此时,肌浆蛋白大部分变性,形成一种致密的结构,杀菌温度越高,肌浆蛋白质变性程度越高。
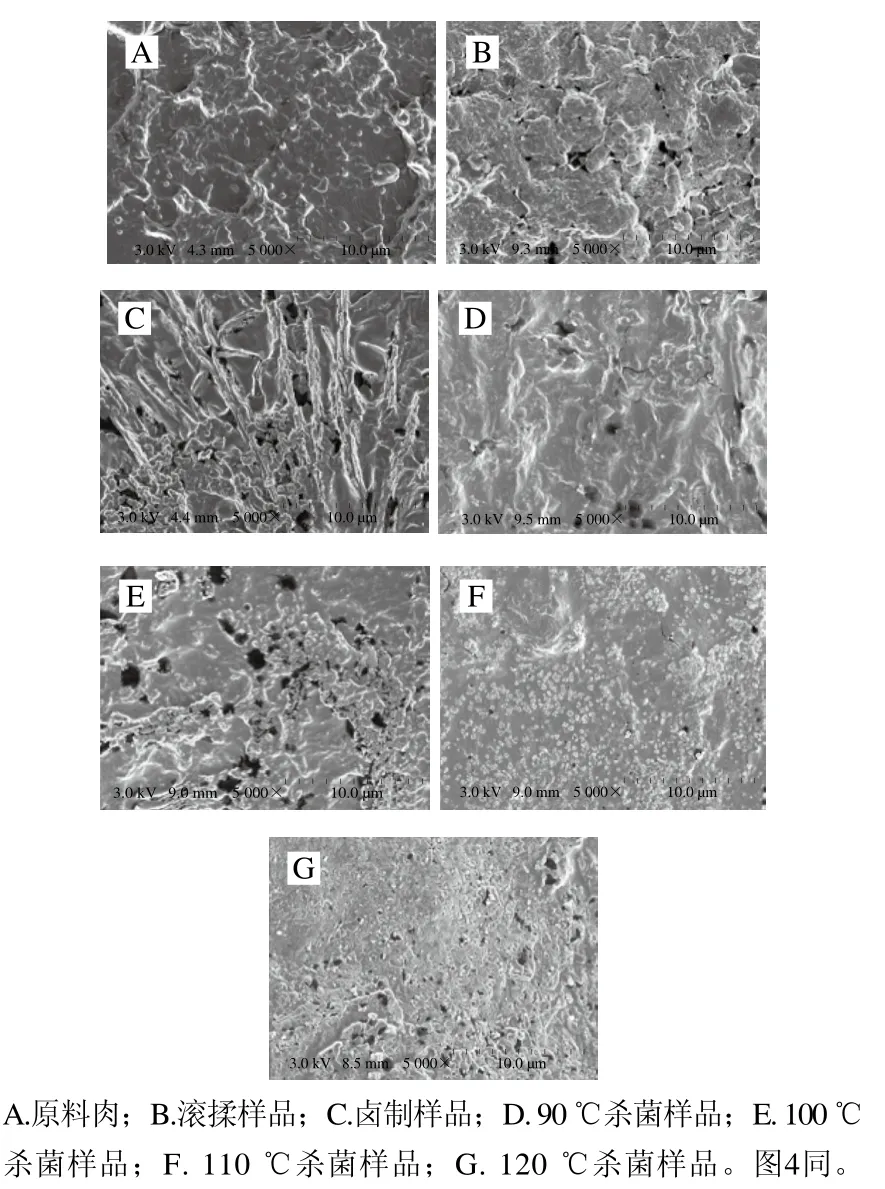
图3 酱牛肉样品肌浆蛋白扫描电子显微镜图Fig. 3 Scanning electron microscopic images of sarcoplasmic proteins in spiced beef
从图4中可以看出,原料样品肌原纤维蛋白结构比较完整,经滚揉工艺后肌原纤维蛋白开始断裂,出现不规则孔洞。样品经卤制后蛋白的网状结构开始变得粗糙,边缘不规则,有明显的断层感。样品经二次杀菌后蛋白结构再次发生变化,经90 ℃杀菌样品中蛋白从各个方向进行交联,网状结构逐渐开始变得致密,随着杀菌温度逐渐升高,肌原纤维蛋白开始形成规则形状,分布也逐渐变得均匀,无明显孔洞,网络结构变得更加致密均匀。
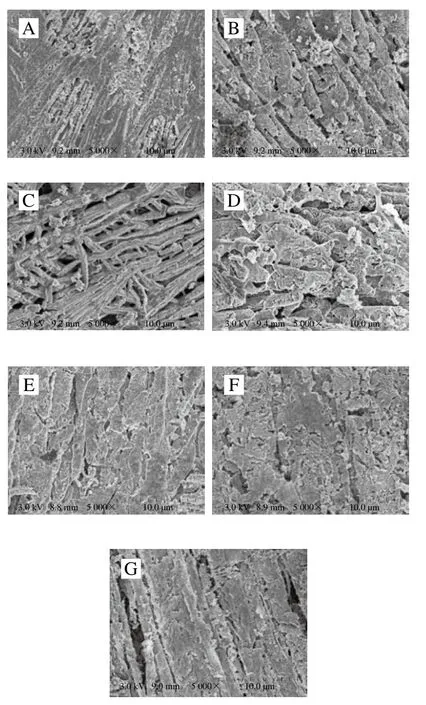
图4 酱牛肉肌原纤维蛋白扫描电子显微镜图Fig. 4 Scanning electron microscopic images of myofibrillar proteins in spiced beef
2.4 蛋白质二级结构变化
酱牛肉加工过程中肌浆蛋白和肌原纤维蛋白的傅里叶变换红外光谱如图5所示。不同样品的红外吸收光谱呈现显著差异。样品在红外区出现多个特征吸收峰,肌浆蛋白和肌原纤维蛋白在酰胺I带(1 660 cm-1附近)、酰胺II带(1 300 cm-1附近、1 570 cm-1附近)、酰胺A带(3 300 cm-1附近)等处均有吸收峰出现。与原料肉相比,滚揉腌制工艺降低了肌浆蛋白中酰胺A带的峰值,但增加了肌原纤维蛋白中酰胺A带的峰值;卤制工艺同时增加肌浆蛋白和肌原纤维蛋白酰胺A带的峰值。随着二次杀菌温度的升高,肌浆蛋白酰胺A带峰值呈现先增加后降低的趋势,而肌原纤维蛋白酰胺A带峰值呈现先降低后增加的趋势,说明酱牛肉加工过程中肌浆蛋白和肌原纤维蛋白的氢键伸缩振动发生变化。1 900~1 200 cm-1波段不同样品间吸光度差异较大,说明滚揉腌制、卤制、二次杀菌工艺对蛋白质中双键的伸缩振动影响不同,1 650 cm-1处吸收峰的差异主要是由C=O造成的,这可能与C=O结构的改变,包括羰基的氧化等有关。
蛋白质的二级结构反映了其主链原子的空间排布情况,不包括侧链的构象变化。通常采用α-螺旋、β-折叠、β-转角、无规则卷曲这4种结构的变化表征蛋白质的二级结构变化[30]。红外光谱图酰胺I带的峰主要是由羰基的伸缩振动造成的[31],可直观反映蛋白质构象变化,因此可以通过蛋白质二级结构所占比例分析蛋白质变性情况,从而确定酱牛肉加工工艺对蛋白质二级结构的影响。
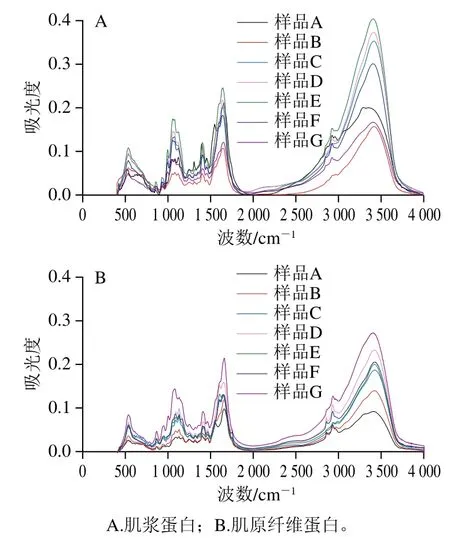
图5 酱牛肉肌浆蛋白和肌原纤维蛋白傅里叶变换红外光谱Fig. 5 Fourier transform infrared spectra of sarcoplasmic and myofibrillar proteins in spiced beef
由表1可知,原料肉中肌浆蛋白的无规卷曲相对含量最低,为7.85%。样品经过滚揉腌制后,肌浆蛋白中α-螺旋、β-转角相对含量显著下降(P<0.05),β-折叠、无规卷曲相对含量显著增加(P<0.05);卤制后其二级结构的相对含量与滚揉样品相比无显著变化(P>0.05);二次杀菌后样品中肌浆蛋白的α-螺旋相对含量再次下降,无规卷曲相对含量整体上升,β-折叠、β-转角相对含量也发生变化。以上变化说明滚揉工艺使蛋白质的有序结构被破坏,其结构稳定性降低,卤制工艺未对其二级结构形成进一步的破坏作用,二次杀菌处理后,维持α-螺旋稳定的氢键继续发生断裂,随杀菌温度升高,α-螺旋、β-折叠总相对含量呈逐渐降低趋势,说明肌浆蛋白结构的稳定性破坏程度逐渐增高,无序性增加。
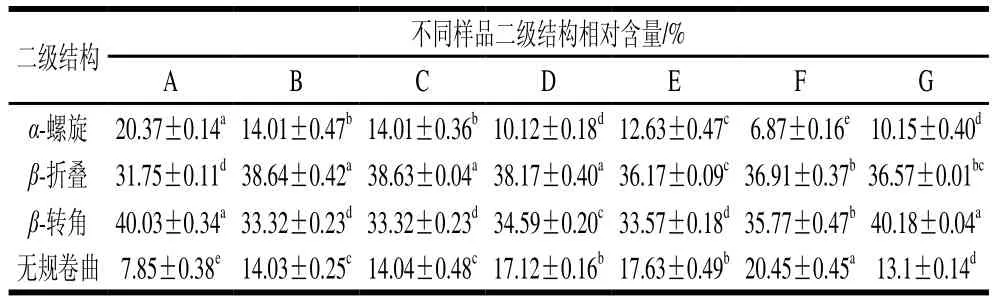
表1 肌浆蛋白二级结构相对含量Table 1 Proportion of secondary structures in sarcoplasmic proteins
由表2可知,原料肉中肌原纤维蛋白的无规卷曲相对含量(8.98%)较低,样品经过滚揉腌制后,各二级结构变化趋势与肌浆蛋白中各二级结构变化趋势一致,即α-螺旋、β-转角相对含量显著下降(P<0.05),β-折叠和无规卷曲相对含量显著增加(P<0.05);与滚揉样品相比,卤制后样品中β-折叠、无规卷曲总相对含量显著降低(P<0.05);二次杀菌样品中随着杀菌温度的升高,各二级结构相对含量呈现波动变化趋势,与肌浆蛋白中二级结构变化趋势不一致,说明不同蛋白质可能具有不同的特征结构和作用位点,加工工艺的改变对不同蛋白质的影响可能存在差异。
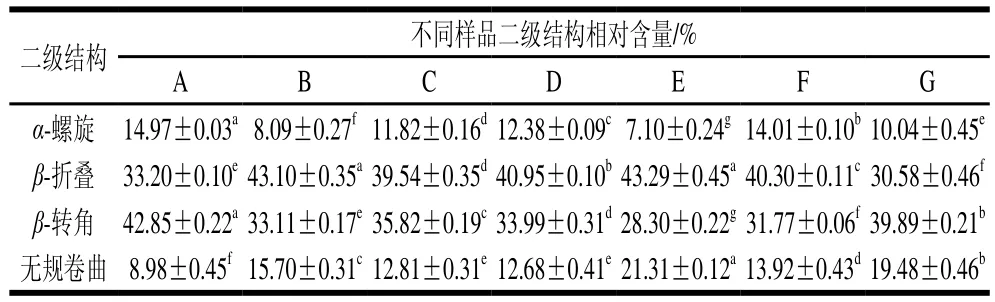
表2 肌原纤维蛋白二级结构相对含量Table 2 Proportion of secondary structures in myofibrillar proteins
2.5 酱牛肉不同状态水分分布
采用核磁共振对酱牛肉样品中水分的变化进行检测分析,采用CPMG序列和T2反演软件得到酱牛肉的T2图谱。表3是酱牛肉加工不同工艺点T2图谱的具体数值,T21为结合水弛豫时间(0.1~10.0 ms),T22为束缚水弛豫时间(10~100 ms),T23为自由水弛豫时间(>100 ms),分别将不同弛豫时间范围内的峰面积(A)进行归一化处理来表征不同状态水分含量。T21代表与酱牛肉中大分子紧密结合的水,T22代表与酱牛肉中大分子结合比较紧密的水(束缚水),T23代表在酱牛肉中亚显微结构之间的自由水。酱牛肉中A22在A总中的占比最大,说明水分主要以束缚水状态存在。T2可反映不同状态水分的流动性,T2越短,水的流动性越差,相同状态水分的弛豫时间越长,说明水与肌肉结合状态越松散[15]。由表3可知,原料肉经滚揉工艺后,样品T22显著增加(P<0.05),T23无显著变化(P>0.05),但A23显著增加(P<0.05),说明滚揉工艺使肌肉中束缚水流动性增加,即滚揉增强了样品的保水性,而自由水流动性不变,但自由水含量增加。卤制后,样品A21、A22显著减小(P<0.05),A23、T23显著增加(P<0.05),说明束缚水和结合水含量均减少,自由水含量和流动能力增加,可能是加热使蛋白质空间构象发生变化,改变了束缚水和结合水与蛋白质的结合能力。不同二次杀菌温度样品间A21差异显著(P<0.05),100 ℃杀菌样品中结合水含量最低;90、110、120 ℃二次杀菌处理组A22差异不显著(P>0.05),100 ℃杀菌样品中束缚水含量最低,自由水含量最高;经二次杀菌后,酱牛肉样品总峰面积差异不显著(P>0.05),100 ℃杀菌样品中总水分含量最高。
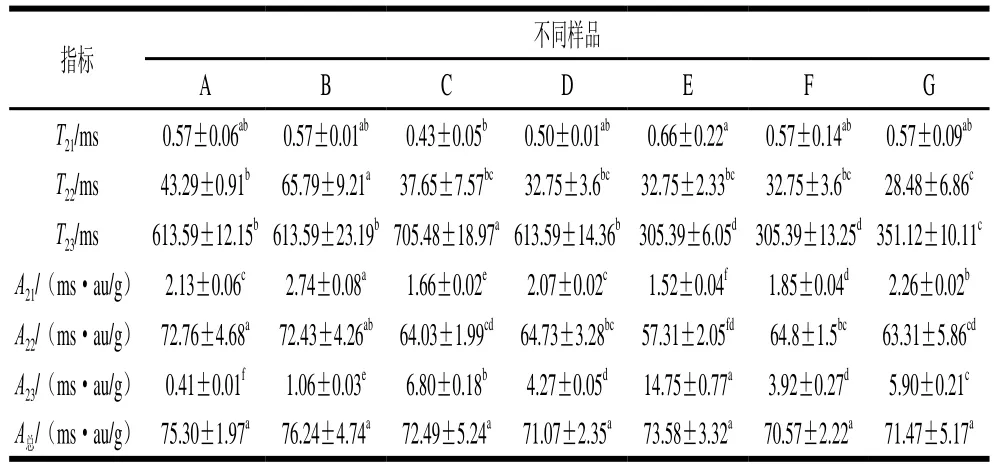
表3 酱牛肉样品水分分布状态Table 3 Water distribution in spiced beef
3 结 论
酱牛肉加工过程中肌浆蛋白及肌原纤维蛋白的浊度变化趋势接近,原料肉中蛋白浊度最高,滚揉工艺可以将蛋白质结构打散,使浊度降低,经热加工后浊度会逐渐增高。滚揉工艺可以提高加酱牛肉蛋白质间的相互作用力,提高其稳定性,热处理前氢键、二硫键是主要作用力,热处理后,稳定蛋白质的作用力主要是氢键、疏水相互作用和二硫键,且二硫键在整个加工过程中均对蛋白质的稳定具有较高的贡献度,不同二次杀菌温度对氢键、疏水相互作用力、二硫键无显著影响(P>0.05)。从电子扫描显微镜结果可知,酱牛肉加工过程中滚揉、卤制及杀菌工艺均会破坏蛋白质的结构,工艺过程增多,蛋白质结构被破坏越严重,二次杀菌温度越高对其网状结构破坏越严重。滚揉腌制、卤制工艺可显著影响酱牛肉样品中肌浆蛋白和肌原纤维蛋白的二级结构,不同二次杀菌温度处理后对各二级结构影响不同。酱牛肉样品经滚揉工艺后束缚水流动性增加,自由水含量也增加;卤制后束缚水和结合水含量减少,自由水含量和流动能力增加;随着二次杀菌温度的升高,总水分含量变化不显著(P>0.05)。
