花生高亲和硝酸盐转运蛋白基因家族生物信息学分析
2022-05-13王娟石大川陈皓宁吴丽青闫彩霞陈静赵小波孙全喜苑翠玲牟艺菲单世华李春娟
王娟,石大川,陈皓宁,3,吴丽青,闫彩霞,陈静,赵小波,孙全喜,苑翠玲,牟艺菲,单世华*,李春娟
(1.山东省花生研究所,山东 青岛, 266100;2.山东省青岛市农业科学研究院,山东 青岛, 266100;3.中国海洋大学食品科学与工程学院,山东 青岛, 266000;4.山东省菏泽市农业科学研究院,山东 青岛, 274000)
氮素在植物体内参与了蛋白质、核酸等生物大分子的合成,对其产量和品质的影响较大[1]。同时,提高氮素利用效率(NUE,nitrogen use efficiency)也是发展绿色生态农业的热点问题。近年来,为了稳产增产,过量施用氮肥导致花生(Arachis hypogaeaL.)自身固氮能力下降,还造成一系列的环境污染问题,如土壤酸化、板结、水体污染、温室气体排放等[2]。因此,从生理与分子角度揭示相关基因功能及其分子作用机制,通过遗传改良提高花生氮素利用效率,在增加花生产量的同时减少施肥对环境造成的压力,对绿色生态农业的实现具有重要的理论及生产意义。
土壤中,植物所利用的氮素形式分为铵态氮(NH4+)和硝态氮(NO3-)。多种旱地作物(烟草、小麦、大豆、油菜、木薯、白菜等)氮吸收的相关研究表明,硝态氮(NO3-)是旱地作物吸收利用的主要氮源。植物从土壤中吸收硝态氮的能量主要来源于质子电化学势梯度:NO3-浓度高于1 mmol/L时,其吸收主要依靠低亲和转运系统(the low-affinity transport system,LATS)完成;NO3-浓度低于1 mmol/L 时,其吸收主要依靠高亲和转运系统(the high-affinity transport system,HATS)完成,分别由硝酸盐转运蛋白(NRT)的NPF(NRT1/PTR)和NRT2两大转运蛋白家族负责执行。NPF 家族除了转运硝酸盐,还可以转运氨基酸、多肽、硫配糖体、生长素以及脱落酸等[3],而NRT2 转运蛋白是位于原生质膜上的膜蛋白,具有典型的跨膜转运蛋白结构[4,5]。所有的NRT2 均为高亲和性的转运体,且只把硝酸盐作为特异性底物[6]。
目前,就植物高亲和硝酸盐转运蛋白(NRT2)基因家族鉴定方面,在模式植物拟南芥(Arabidopsis thaliana)中发现了7 个NRT2 基因家族成员[7~9]。作物中,水稻(Oryza sativa)挖掘到5 个NRT2 成员[10];大麦(Hordeum vulgare)通过基因克隆到4 个NRT2成员[11];谷子(Setaria italica)中发现了7 个NRT2 成员;高粱(Sorghum bicolor)中检测到4个NRT2 成员;玉米(Zea mays)中找到了3 个NRT2 成员。豆科植物中,蒺藜苜蓿(Medicago truncatula)中发现了3 个NRT2 成员[12,13];大豆(Glycine max)中发现了3 个NRT2 成员。但是,花生NRT2家族基因相关研究尚未见报道[14]。
栽培种花生除了根瘤菌固氮,通过根系吸收土壤中的硝酸氮也是氮素利用的重要方式。栽培种花生全基因组以及转录组等数据的释放为重要性状基因的鉴定和发掘提供有利条件[15~18]。本研究前期通过全基因组水平的关联分析(nenome wide association study,GWAS)与QTL 定位(QTL mapping)的联合分析对花生产量性状相关基因进行锚定。在参考水稻、大豆等作物产量性状基因验证结果的基础上,从数目庞大的候选基因中筛选出花生高亲和硝酸盐转运蛋白基因为产量性状相关候选基因[19]。在此,以高亲和硝酸盐转运蛋白(NRT2)基因家族为研究对象,通过生物信息学揭示NRT2 基因家族特征及表达模式,为进一步研究花生NRT2 基因家族成员的生物学功能奠定基础。
1 材料与方法
1.1 数据来源
以栽培种花生(Arachis hypogaeaL.)为研究对象,NRT2基因序列信息来源于花生基因组数据库Peanutbase(https://peanutbase. org/)及NCBI 数据库(http://www.ncbi.nlm.nih.gov/)。
1.2 方法
1.2.1 NRT2 蛋白基因家族的查询和确认 在花生基因组数据库以“Nitrate transporter 2”为关键词,搜索得到花生NRT2 基因家族在A.duranensis、A.ipaensis及栽培种花生(A. hypogaeaL.)的所有候选成员序列,将其在花生基因数据库Peanutbase(https://www. peanutbase. org/)和NCBI 数据库(http://www.ncbi. nlm. nih. gov/)中进行Blastp 检索(e 值≤10-15)。然后在NCBI(https://www.ncbi. nlm. nih. gov/)以拟南芥NRT2 基因家族7 个成员序列对比以上花生NRT2基因进行序列同源性对比[7,8],去除冗余成员后,作为基因家族候选成员。
通过Pfam 在线软件(http://pfam.janelia.org/)的sequence search 功能[20]与SMART 在线软件的normal model P 模块(http://smart.embl-heidelberg.de/)进行NRT2基因家族蛋白结构域预测[21]。该家族属于MFS(major facilitator superfamily)超家族成员之一,由此对获得的蛋白序列进一步确认,筛除不具有典型结构域(PLN00028 super family)的基因,得到了花生NRT2的基因家族成员。
1.2.2 基因特性分析及染色体定位分析 通过Peanutbase 数据库里花生基因组的gff3 文件中提取NRT2 基因家族的染色体起始、结束位置以及基因长度;利用NCBI 在线Blast 工具搜索获得拟南芥NRT2 蛋白的同源信息。利用ExPASy-ProtParam(http://web. expasy. org/protparam/)线 上 分 析 花 生NRT2基因家族成员的分子量、等电点等理化性质。利用MapInspect 在线软件(http://www. plantbreeding. wur. nl/UK/soft-ware_mapinspect. htm)进行染色体物理分布图的绘制,获得NRT2 基因家族成员的染色体物理位置信息。
1.2.3 基因进化分析 利用花生NRT2 基因家族成员与大豆、苜蓿、水稻及拟南芥等物种NRT2 基因家族成员的蛋白序列,在MEGA v7.0 上对NRT2基因家族进行序列比对,采用邻接法(Neighbor-Joining,NJ)构建系统发育进化树,采用Bootstraping 法对进化树进行评估与分组得到花生与各物种间亲缘关系。校验参数:no of different,重复5000次。
1.2.4 基因结构及保守基序分析 Peanutbase 数据库可获得花生NRT2基因的核苷酸全长及CDS 区域在基因结构预测。通过可视化工具Gene Structure Display Server 2.0(http://gsds. cbi. pku. edu.cn/),利用Sequence(FASTA)格式绘制基因结构图。利用在线软件MEME Suite 5.1.0(http://meme.nbcr.net/meme/cgi-bin/meme.cgi)根据基因家族成员的氨基酸序列预测花生NRT2 基因家族保守基序,参数设定为classic mode,motif数目为10。
1.2.5 不同组织的基因表达量分析 在花生全生育期22 个不同发育时间不同组织中基因表达情况转录组数据基础上[22],提取的花生NRT2基因的FPKM(fragments per kilobase of exon model pre million mapped reads)数值通过Excel进行log2的数据转化,利用热图制作软件HemI 进行Hierarchical clustering(HCL)聚类绘制热图来展示花生NRT2基因表达量情况。根据花生NRT2基因在不同组织不同发育时期的基因表达量,预测不同NRT2基因的表达水平。
2 结果与分析
2.1 花生NRT2基因家族成员的鉴定和染色体分布
通过对NRT2基因典型结构域筛选,人工去除不完整序列或较短序列的基因,最终确定了10个花生NRT2基因。与二倍体野生种花生相比,A. dura⁃nensis中发现有5 个NRT2基因,A. ipaensis含有12个NRT2基因。为了更加直观地了解NRT2基因家族在染色体上的位置信息,我们绘制了栽培种花生及二倍野生花生的染色体分布图(图1),显示该基因家族成员分布不均匀。A. ipaensis基因组上分布有12 个NRT2基因,其家族成员分布密度最高。四倍体栽培种花生A 基因组与A. duranensis基因组相比,有三对基因(Chr01:AhNRT2.6c/AdNRT2.4d;Chr03:AhNRT2.5c/AdNRT2.4a; Chr06:AhNRT2.7b/AdNRT2.2a)存在同源关系;四倍体栽培种花生B 基因组与A. ipaensis有五对基因(Chr11:AhNRT2.6a/Chr01:AiNRT2.2b; Chr12:AhNRT2.6b/ Chr02:Ai⁃NRT2.6b; Chr13:AhNRT2.5b/ Chr03:AiNRT2.4d;Chr16:AhNRT2.7a/ Chr06:AiNRT2.2a; Chr20:AhNRT2.5a/ Chr10:AiNRT2.4f)存在同源关系。栽培种花生全基因组上,3 号(AhNRT2.5c)和13 号(AhNRT2.5b)染色体,6 号(AhNRT2.7b)和16 号(AhNRT2.7a)染色体上的基因存在同源关系。
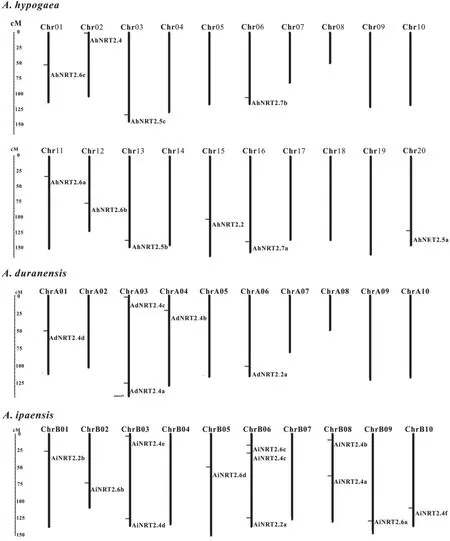
图1 栽培种花生NRT2基因在染色体上的分布Fig.1 Distribution of NRT2 genes on chromosomes in peanut
2.2 花生NRT2 基因家族蛋白序列进化关系及理化性质分析
利用MEGA v7.0 将栽培种花生的10 个NRT2蛋白序列与7 个拟南芥(At)NRT2 蛋白序列,3 个大豆(Gm)NRT2 蛋白序列,4 个水稻(Os)NRT2 蛋白序列以及3 个苜蓿(Mt)NRT2 蛋白序列等进行多重序列比对并构建系统进化树。以与其它物种NRT2 序列的相似性高低与基础,将这些NRT2 分为5 支,分别命名Clade 1,2,3,4,5(图2)。除Clade 4 外,花生NRT2 蛋白序列并未因物种差异而单独聚类。Clade 1,栽培种花生AhNRT2.4 与大豆GmNRT2.4亲缘关系较近;Clade 2,栽培种花生AhNRT2.5b,AhNRT2.5c 与苜蓿MtNRT2.7c 聚为一小支;Clade 3,栽培种花生AhNRT2.7a 和AhNRT2.7b 与拟南芥AtNRT2.7 及水稻OsNRT2.4 聚为一支; 最后以AhNRT2.6c单独为一支。
根据基因注释与ProtParam 进一步分析,我们发现这10 个NRT2 编码蛋白中,大部分成员编码的蛋白氨基酸长度在69~553 aa之间。其中,AhNRT2.5a基因的转录本2 编码最短,仅为69 个氨基酸,其分子量为7.8 kD,序列不完整;AhNRT2.5b 编码最长,氨基酸长度为553,分子量为55.24 kD。具有10~12个跨膜区的家族成员有5 个,分别是AhNRT2.4,AhNRT2.5b,AhNRT2.5c,AhNRT2.7a 和AhNRT2.7 b。除AhNRT2.6c 外,各成员等电点在8.52~9.85之间,变化幅度较小。花生NRT2 蛋白基因家族的理化性质与其他物种NRT2 蛋白家族的理化性质基本一致。
2.3 花生NRT2基因家族保守结构域及其基序分析
基于花生NRT2基因家族10 个氨基酸序列及CDS 序列文件,利用MEGA 7.0、GSDS 2.0 与MEME在线软件构建了花生NRT2 基因家族进化树、保守结构域与保守基序结构图(图3)。在GSDS 在线软件上通过CDS 序列与基因序列比对可得到CDS 序列中各外显子在基因上的定位信息。结果表明花生各个NRT2 基因家族成员之间结构相似,大致可以分成五类。不同类型间保守基序分布顺序不同,保守基序也各有不同。在线软件MEME Suite 5. 1. 0 可以预测基因保守基序,对花生NRT2 基因家族10 个成员保守基序分析结果显示共存在10 种保守基序。花生NRT2基因家族分为4个亚组,基序分析结果显示,组内具有相似或相同的基序类型和排序顺序。Group A 和Group C 的组内基因家族成员的各保守基序分布顺利和类型完全一致,但内含子长度有所差异;Group B 的基序分布类型相似,但基序数目有差异,分布有2~5 个基序;Group D 仅包含1个成员,有3个保守基序。

图3 栽培种花生NRT2基因结构及保守基序分析Fig.3 Genic structure and conserved motifs analysis of NRT2 genes in peanut
2.4 NRT2基因表达模式分析
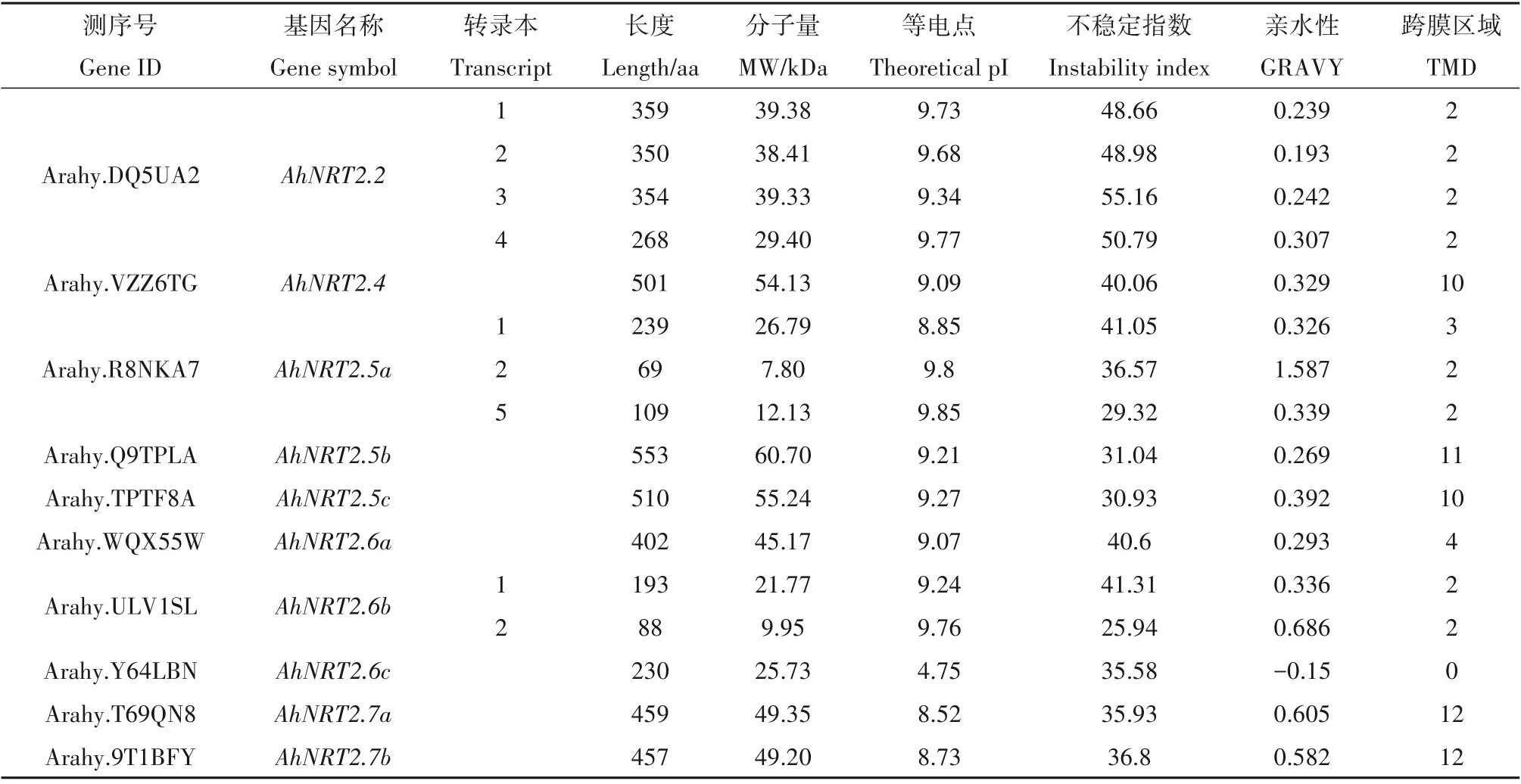
表1 花生NRT2基因家族成员信息Table 1 Identification of NRT2 gene family in peanut
以栽培种花生22 个组织中基因表达数据为基础[22],提取NRT2基因相关数据进行组织表达模式分析,利用HemI 软件将数据进行聚类分析和可视化处理。热图表明:在不同组织中和发育时期的表达具有明显的组织特异性(图4)。AhNRT2.5a基因在花生22个组织中整体表达量偏高;而AhNRT2.6b和AhNRT2.2整体表达量偏低。AhNRT2.6a仅在主茎叶片和根中有少量表达,同样,AhNRT2.6c在叶、茎、花、种子等组织某些部位不产生表达。其它基因表达量因组织、发育时期表达量有差异,相比之下基因表达量居中。硝酸盐转运蛋白与氮转运相关的有四个基因AhNRT2.4、AhNRT2.5a、AhNRT2.5b和AhNRT2.5c,在组织根中表达量相对较高,表明它们在根的氮吸收中发挥重要作用。
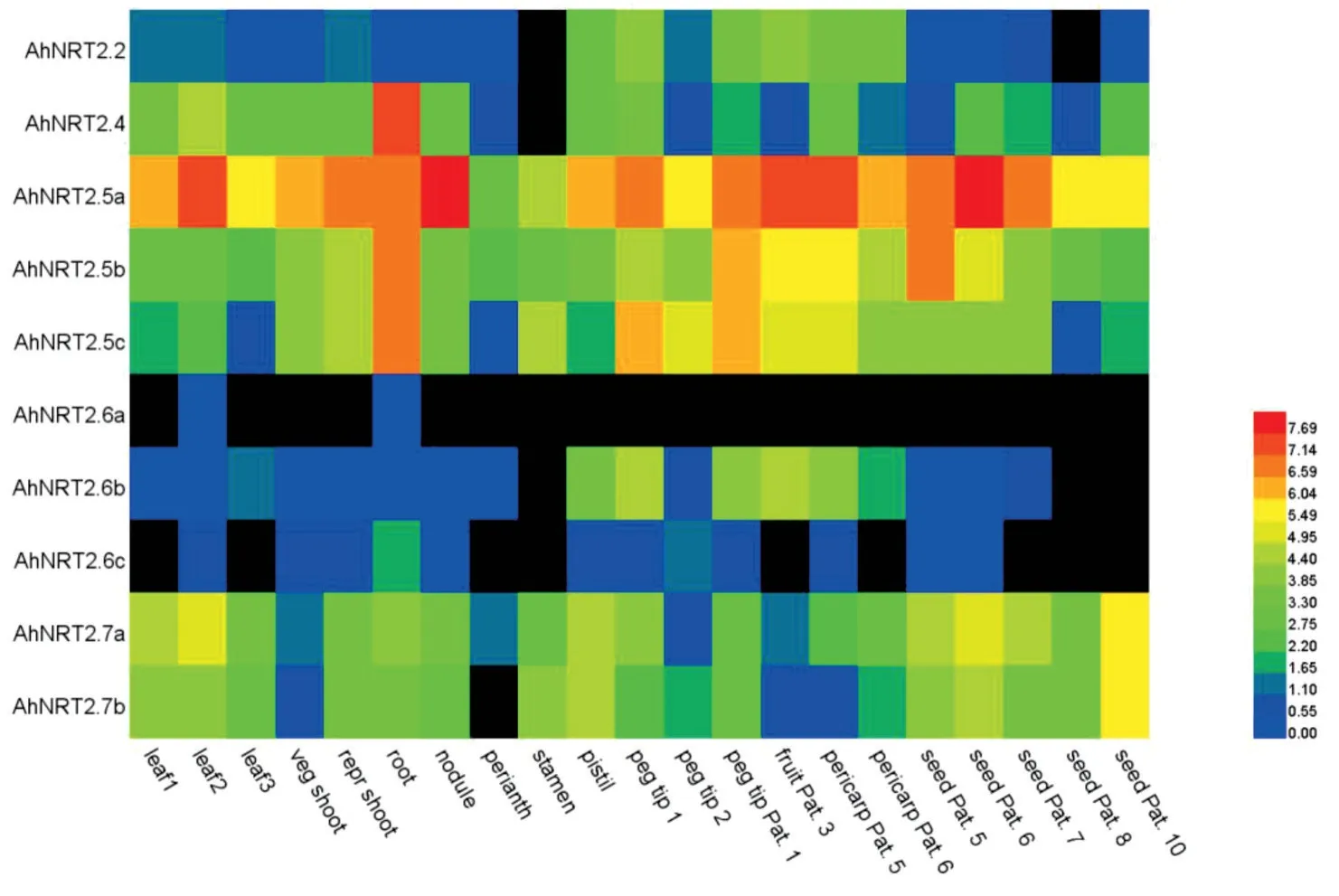
图4 花生NRT2基因组织特异性表达分析Fig.4 Tissue-specific expression of NRT2 in peanut
3 讨论与结论
氮素利用效率影响着花生的产量。同时,提高氮素利用效率也有助于推动绿色生态农业的发展。硝酸盐转运蛋白有NPF(NRT1/PTR)和NRT2 两大转运蛋白家族,分别在低亲和以及高亲和转运系统中负责硝酸盐的吸收。钱瑜等[14]通过对8 种经过全基因组测序的物种(大白菜、大豆、杨树、葡萄、玉米、水稻、高粱、二穗短柄草)NRT2 的同源基因分析,表明大白菜NRT2 家族经历了基因组三倍化及基因片段丢失事件。花生以上两大基因家族的相关研究,仅检索到孔伟伟等[23]从花生基因组中找出37 个NRT1(NPF)基因,不同组织中的表达具有明显的组织特异性,而NRT2 基因家族的研究未见报道。
本研究利用花生基因组数据库Peanutbase 及NCBI 数据库搜索,鉴定到10 个栽培种花生NRT2基因,分别位于9个染色体上。与野生二倍体NRT2基因家族成员的分布比对指出,3 号和13 号染色体,6号和16 号染色体上的NRT2基因分别存在同源关系。所构建的花生NRT2 基因家族进化树可分为五个分支,各分支包含NRT2 家族成员,这说明该家族成员并未因物种差异而单独聚类。各分支的内含子数量及基因结构相似,保守基序的排序和类型保持高度的一致性,这与水稻[10]、大豆[24]、苜蓿[13,14]等作物NRT2 基因家族的结构和特征相似。花生NRT2基因在各个组织不同时期表达量存在较大差异。其 中,AhNRT2.4,AhNRT2.5a,AhNRT2.5b和AhNRT2.5c四个基因在根中有较高表达量,推测这些NRT2基因在根系的硝酸盐吸收和转运中发挥重要作用。值得注意的是,AhNRT2.5a还在根瘤、叶、繁殖性茎尖、果柄形态、果壳形态、种子形态各组织中某个时期表达量水平均高,这说明它在花生多个生物学过程起着重要的基础作用。另外,预测到AhNRT2.4、AhNRT2.5b和AhNRT2.5c的 跨 膜 区 有10~12 个,属于典型的跨膜蛋白,这是参与氮转运的前提,可作为后续功能研究的重点对象。
目前,硝酸盐转运蛋白基因的功能研究仅在拟南芥、水稻、烟草等模式植物中有较为深入的研究[25,26]。例如,Fan 等[27]水稻pH 值依赖的高亲和硝酸转运基因OsNRT2.3过表达时,能够提高氮固定效率,增加水稻产量。Tang[28]通过结合三年产量表型数据的全基因组关联分析,经过表达和基因敲除等功能验证,克隆了双亲和硝酸根转运子OsNPF6.1,发现OsNPF6.1 的优异单倍型增强氮素吸收和提高氮素利用效率从而提高水稻在低硝酸盐浓度下的产量。花生功能基因的研究,相对于水稻、大豆、油菜等作物研究较为滞后。随着栽培种花生全基因组测序数据释放和共享,花生重要性状相关候选基因陆续被发掘和验证[16,17]。例如,Zhao 等利用3 个粉红种皮与深紫色种皮花生杂交的分离群体,通过全基因组重测序方法发现深紫色种皮性状是由单基因AhTc1控制的,该基因属于R2R3-MYB转录因子,在烟草中过量表达该基因能够增加转基因烟草花青素的积累[29]。同时,随着实验技术手段的不断创新,花生遗传转化体系和基因编辑技术也有了进展。花生NPF/NRT2 基因家族作为氮转运重要基因,其功能研究还有待于在此基础上深入,本研究为后续研究提供了一定的参考依据。
