大豆花叶病毒病转基因抗性研究进展
2022-05-13高乐李志强李凯智海剑
高乐,李志强,李凯,智海剑*
(1.北京农业职业学院园艺系,北京 , 102442;2.南京农业大学国家大豆改良中心/农业农村部大豆生物学与遗传育种重点实验室/作物遗传与种质创新国家重点实验室,江苏 南京, 210095)
大豆[Glycine max(L.)Merr.]是世界上最重要的豆类作物,是人类饮食中优质植物油和蛋白质的主要来源,富含异黄酮、维生素、矿物质、磷脂、皂素等活性成分,对人类健康极为有益[1]。大豆在生长发育过程中容易受到多种病原物的侵害,包括卵菌、线虫、真菌、细菌、病毒等,其中大豆花叶病毒(soybean mosaic virus,SMV)引起的病毒病是大豆上最为流行的病害,严重影响大豆的产量和品质[2~5]。
SMV属于马铃薯Y病毒科(Potyviridae),马铃薯Y 病毒属(Potyvirus),基因组为线性单链正义[ss(+)]RNA,全长约10 kb,编码11 种多功能蛋白,从5'N 端到3'C端依次为P1、HC-Pro、P3、P3N-PIPO、6K1、CI、6K2、VPg、NIa-Pro、NIb、CP(图1)[4,6]。根据病毒分离物在大豆鉴别寄主上的症状反应和致病性差异,中国、美国、日本分别将SMV 划分为22 个株系(SC1~SC22)[7]、7 个 株 系(G1~G7)[8]、5 个 株 系(A~E)[9]。SMV 以种子带毒作为初侵染源,被30 多种蚜虫非持久性传播,造成田间病害流行[4,10]。大豆感染SMV 后,会产生花叶和坏死等症状,造成植株光合面积减少和光合能力降低,生长量下降,植株矮化,籽粒出现褐斑,通常造成大豆减产8%~35%,严重时产量损失在50%以上甚至绝收[2~6,10]。
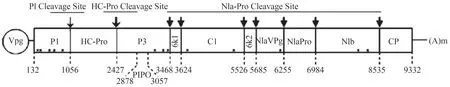
图1 大豆花叶病毒(SMV)基因组结构和蛋白切割位点[6]Fig.1 Genome organization and cleavage sites of soybean mosaic virus(SMV)[6]
目前尚无有效的化学药剂可以防治大豆花叶病毒病,培育抗病大豆品种是最经济、安全、有效的途径[11,12]。然而,传统的抗病育种周期漫长,育成品种的抗谱较窄且抗性容易因病毒的变异而丧失[13,14]。转基因技术可以挖掘跨物种基因资源,或通过基因编辑技术创造出新的基因,从而拓宽遗传基础,这些优势使其成为大豆抗病毒研究的有力手段,为大豆抗病育种提供重要的理论依据。这些技术的有关报道包括:过量表达SMV 抗病基因,可以诱导大豆产生正向抗性;应用RNA 干扰(RNA interference,RNAi)技术沉默寄主感病因子,可以诱导大豆产生负向抗性;过量表达SMV CP 外壳蛋白或是应用RNAi 技术靶向SMV 基因组,可以诱导大豆产生病原物诱导的抗性,等等(表1)。

表1 大豆花叶病毒病(SMV)转基因抗性的研究报道Table 1 Reports of transgenic resistance to soybean mosaic virus disease
1 大豆对SMV的正向抗性
在寄主体内过量表达内源或外源抗病基因,可以诱导寄主产生对病毒的正向抗性。例如将天然的SMV 抗病基因导入大豆,抗病基因所编码的蛋白质能够识别特定的病原物效应子(无毒基因),刺激相关的激素信号传导途径并激活防御反应机制,从而以“基因对基因”的方式抵御病毒入侵。Liu 和Whitham[15]在本氏烟叶片中瞬时表达了一个含有III型DnaJ 结构域的大豆基因GmHSP40.1,植株发生过敏性坏死反应,说明该基因与抗病相关;应用病毒诱导的基因沉默技术(virus-induced gene silencing,VIGS)沉默GmHSP40.1增强了大豆对SMV的敏感性,进一步证实了该基因在大豆抗病中的关键作用[15]。Zhou 等[16]将大豆钾离子(K+)通道相关基因GmAKT2导入栽培大豆品种Williams 82 中,转基因大豆植株对SMV 的抗性得到了显著提高,说明改变K+转运蛋白的表达水平是提高大豆SMV 抗性的一种新型有效的方法。Zhou 等[17]将钼辅因子生物合成蛋白相关基因GmCnx1导入大豆中,促进了硝酸还原酶(nitrate reductase,NR)和乙醛氧化酶(aldehyde oxidase,AO)的上调表达(分别增加了2.6 倍和3.9 倍),提升了转基因大豆的生理和抗逆作用,从而增强了SMV 抗性。马露萍[18]将促丝裂原活化蛋白激酶相关基因GmMAPKKK导入大豆中,提高了大豆对SMV 的抗性和耐受力,通过检测发现相关防御基因得到了上调表达,推测这可能是通过刺激水杨酸(salicylic acid,SA)信号传导途径实现的。He等[19]分别对抗、感大豆品种接种SMV,在转录组水平上比较分析了品种间的基因表达差异,发现赤霉素刺激转录的一个亚基因组在感病品种中被下调,而在抗病品种中没有变化;序列比对和系统发育分析表明,其中一个基因GmSN1与马铃薯抗病基因Sna⁃kin-1密切相关,并且在大豆中过量表达GmSN1能够显著增强转基因大豆对SMV 的抗性水平,作者推测GmSN1最有可能通过影响信号转导和免疫响应相关基因的表达水平来增强植物的抗病性。Xun等[20]在大豆中过表达了一个TIR-NBS-LRR 型抗病基因GmKR3,发现转基因大豆对多个SMV株系的抗性均显著提高;进一步研究发现,转基因大豆中脱落酸(abscisic acid,ABA)分解代谢相关基因下调表达,且ABA 响应基因上调表达,推测这种增强的SMV 抗性至少部分是通过ABA 信号途径实现的。牛陆等[21]和Yang 等[22]利用核糖核酸酶PAC1 能够识别和降解植物RNA 病毒复制过程中产生的双链RNA(double-stranded RNA,dsRNA)这一特性,将来源于粟酒裂殖酵母菌(Schizosaccharomyces pombe)的PAC1基因导入Williams 82 中,显著抑制了大豆体内SMV 的积累以及症状的发展,增强了转基因大豆对多个SMV 株系的抗性水平。Ishibashi等[23]图位克隆了SMV 广谱抗性基因Rsv4,该基因编码具有dsRNA 降解活性的RNase H 家族蛋白,能够在病毒复合物组装过程中进入病毒复制室降解病毒的dsRNA,并且通过转化感病大豆品种进一步明确了该基因的抗病功能。
2 大豆对SMV的负向抗性
沉默寄主内源感病因子,可以诱导寄主产生对病毒的负向抗性。例如应用RNAi 技术沉默大豆感病因子,感病基因编码的蛋白质在SMV 的侵染循环中是必不可少的,因此一个或多个感病因子的缺失或突变可以阻断病毒与寄主因子的相互作用,限制病毒的繁殖、复制和运动,激活防御反应机制,从而产生负向抗性,即“感病性丧失”诱发的抗性。Liu等[24]利用VIGS 技术沉默大豆内源基因GmMPK4,显著上调了SA 信号途径中参与防御反应基因的表达水平,增加了SA 和H2O2的积累量,从而增强了对SMV 的抗性;而与生长发育有关基因的表达水平显著下调,表明该基因负向调控寄主抗病防御反应且正向调控寄主的生长发育。Liu 等[25]利用VIGS 技术沉默大豆内源基因GmMPK6,导致叶片发育迟缓和细胞程序性死亡,这是激活防御反应的典型表现,从而增强了寄主对SMV 的抗性。Gao 等[14]发现接种SMV 后,感病大豆品种的真核翻译起始因子GmeIF4E的表达水平明显上调,而抗病品种的GmeIF4E变化不显著,说明感病品种的GmeIF4E参与了SMV 的侵染过程;进一步利用RNAi 技术创制了沉默GmeIF4E的转基因大豆材料,通过抗病鉴定证实该转基因材料对多个SMV 株系都具有良好的抗性,为培育SMV 广谱抗病大豆提供了新方法。Luan 等[26]前期利用酵母双杂交系统筛选到一个能够与SMV高度互作的大豆感病因子GmVma12,之后应用RNAi技术将该基因的反向重复序列(invertedrepeat sequence,IRS)导入到大豆中,抑制了GmV⁃ma12的表达水平,从而诱导了大豆对SMV 的抗性。Zong 等[27]利用二代测序技术证实SMV CP 蛋白和大豆的一个DnaJ 型蛋白存在互作,进而利用VIGS 技术沉默该大豆蛋白的编码基因GmCPIP,发现病毒的积累量显著下降,增强了大豆对SMV的抗性。
3 病原物诱导的SMV抗性
将病原物自身的基因序列导入寄主,能够诱导寄主产生对该病原物的抗性,即病原物诱导的抗性。例如在大豆体内过量表达SMV CP 外壳蛋白或是应用RNAi 技术靶向SMV 基因组,均可以诱导大豆产生SMV 抗性。Wang 等[28]通过农杆菌介导法将SMV 外壳蛋白CP基因和3'-UTR 转入大豆中,在获得的转基因材料中鉴定到两个SMV 高抗家系,这是诱导大豆产生病原物诱导抗性的首个报道;该研究团队在后续的试验中进一步评估了转基因大豆品系的田间表现,分析了SMV 的时空动态变化,结果证明病原物诱导的抗性可以有效减少转基因大豆中病原体的传播[29]。Furutani 等[30,31]通过基因枪轰击法将SMV 减毒分离株的CP基因导入大豆品种Jack 的体细胞胚中,获得了三个对SMV 具有高强度抗性的家系,并最终证实虽然采用过表达SMVCP基因的手段,但诱发了RNAi 介导的抗性。Zhang等[32]利用单个转基因元件同时表达几个短的IRS,每个IRS 都包含一种病毒的高度保守序列,最终以这种策略获得的转基因植株对包括SMV 在内的三种病毒均表现出强大的系统抗性。章洁琼等[33]利用RNAi 技术靶向SMVCP基因,获得了单拷贝插入、外源基因能够稳定遗传的转基因植株,抗病鉴定实验证明该转基因材料对SMV具有良好的抗性。Kim等[34,35]利用RNAi 技术分别靶向SMVCP和HC-Pro基因,获得的转基因植株表现出良好的SMV 抗性,并且在抗性植株中消除了种皮斑驳的现象。Gao等[13]利用RNAi 技术,将含有SMVHC-Pro基因片段的IRS 导入到多个栽培大豆品种中,获得了大量的转基因材料,并且诱发了高强度、稳定遗传的SMV抗性。杨向东等[36]利用RNAi 技术靶向与SMV 运动和寄主范围有关的P3基因,获得了单拷贝整合形式的转基因大豆植株,显著提高了转基因材料对SMV的抗性水平,并且抗性可以稳定遗传。Yang 等[37,38]从SMV SC3 株系中分别克隆了P3和NIb的基因片段,利用RNAi 技术获得的转基因大豆家系在连续三年的田间试验条件下对多个SMV 株系表现出稳定、高强度的抗性。
4 大豆对其他病毒的转基因抗性
除了SMV 以外,菜豆荚斑驳病毒(bean pod mottle virus,BPMV)、苜蓿花叶病毒(alfalfa mosaic virus,AMV)、菜豆普通花叶病毒(bean common mosaic virus,BCMV)、西瓜花叶病毒(watermelon mosaic virus,WMV)也能够经常在大豆田中检测到,当这些病毒复合侵染寄主并进行协同作用时,会进一步加剧大豆产量的损失[13,14,22,32,37,38,41]。此外,SMV 与其他Potyvirus成员之间存在着频繁的种间遗传物质交换:Chen 等[42]从天南星科(Araceae)植物半夏(Pinel⁃lia ternata)中分离出一种类似于SMV 病毒的分离物,测序结果显示它是由SMV 和芋花叶病毒(dasheen mosaic virus,DsMV)重组产生的,这是SMV 自然侵染天南星科植物的首次报道;近年来发现一种新型SMV 重组株系,广泛流行于中国大豆种植区,它是由SMV 和BCMV 或类似于BCMV 的病毒重组产生的[43~46];Jiang等[47]报道了一个由SMV和WMV重组产生的SMV 分离物,能够在大豆和本氏烟中引发不同类型的症状。上述报道说明大豆田间的病毒病害具有复杂性和潜在的不确定性,对大豆的生产实践提出了严峻的考验,因此在防治SMV 的同时,也要警惕其他病毒的协同危害。
近年来,研究人员利用转基因技术成功培育出兼抗多种病毒的转基因大豆品系:Zhang等[32]分别克隆了AMV、BPMV、SMV 高度保守的短序列(小于150 bp),并且串联组装成单个转基因元件,最终获得的转基因大豆能够同时抵御这三种病毒的侵染,展现出强大的系统抗性;Yang等[37,38]和Gao等[14]分别利用RNAi技术靶向沉默SMVNIb/P3基因和大豆翻译起始因子GmeIF4E基因,成功诱导转基因大豆产生对SMV、BCMV、WMV 的高强度抗性;Xun 等[20]和Yang 等[22]分别过表达大豆内源抗病基因GmKR3和粟酒裂殖酵母菌PAC1基因,均发现转基因大豆植株对SMV、BCMV、WMV、BPMV具有良好的抗性。
5 展望
传统的大豆育种技术在SMV 抗病育种中仍占据主要地位,但其育种周期漫长且依赖于优良的抗源,然而SMV 存在复杂的株系分化,大豆抗源对SMV 的抗性又具有株系专化性,因此传统方法很难在短期内培育出对SMV 具有广谱抗性的大豆新品种。此外,SMV 具有较强的变异性,育成大豆品种容易因SMV 株系的突变而丧失抗性,由于常年推广种植抗病大豆品种,对SMV 产生了强大的定向选择压,导致“抗性-打破”型SMV 株系频繁出现,最终造成品种的抗性丧失[6,39,40]。
转基因技术可以打破物种间的屏障,挖掘跨物种基因资源或通过基因编辑技术创造出新的基因,在较短时期内完成抗病基因的定向改造、重组、转移,从而拓宽遗传基础并为大豆抗病育种提供重要的理论依据,缩短优良抗病品种的选育进程,为培育广谱、持久抗性的转基因大豆新品种提供了新的方法策略。近年来,大豆对SMV 转基因抗性的研究取得了重要进展(表1),涵盖正向抗性、负向抗性、病原物诱导的抗性,为转基因大豆抗病育种提供了坚实的理论基础。然而,尽管已经挖掘出了一定数量的SMV 抗病基因,也获得了一些转基因大豆抗病材料,但这些抗病基因和转基因材料均未应用于生产实践,因此转基因大豆抗病育种还没有取得实质的发展,商业化种植道路还十分遥远。造成上述原因的根源在于转基因技术的商业化发展受限于不同国家的管控政策以及大众对该项技术的接受程度。因此,需要在传统转基因的基础上引入新的技术手段,以期改变转基因技术商业化发展难的问题。
近年来兴起的CRISPR/Cas 基因组编辑技术是一种高效、精准、特异的基因组靶向修饰技术,相比于传统的转基因方法,该技术能够利用序列特异性核酸酶实现DNA 特定位点的插入、缺失、突变或替换以及RNA 特定位点的靶向切割,该项技术已成为科研领域的热门,为基因功能的研究和作物农艺性状的定向精准改良提供了新的手段,将作物育种带入了5G 时代[48],同时也为改良植物的抗病性、加速抗病育种提供了新的思路[49]。目前已开发出不同类型的Cas 蛋白变体,其中SpCas9(Streptococcus pyo⁃genes)能够靶向双链DNA 结构[50],FnCas9(Francisel⁃la novicida)[51]、LshCas13a(Leptotrichia shahii)[52]、Cas-Rx(Ruminococcus flavefaciens)[53]能够靶向单链RNA结构,这分别为防治植物DNA 病毒和RNA 病毒开辟了新的途径[49,54~56]。迄今为止,CRISPR/Cas 系统已被成功应用于不同种类的植物抗病毒研究中,包括本氏烟(Nicotiana benthamiana)[57~67]、拟南芥(Ara⁃bidopsis thaliana)[59,62,64,68-71]、番 茄(Solanum lycopersi⁃cum)[63]、大麦(Hordeum vulgare)[72]、黄瓜(Cucumis sa⁃tivus)[73]、木 薯(Manihot esculenta Crantz)[74]、水 稻(Oryza sativa)[67]、马铃薯(Solanum tuberosum)[75]、大豆(Glycine max)[76]。综上表明,CRISPR/Cas 技术与传统的转基因技术相辅相成,在植物抗病毒研究领域蕴藏着巨大潜力[77],为加速改良大豆的抗病性提供了全新的育种策略,对开展大豆基因编辑抗病育种具有深远意义。
