一个调控大豆根瘤数量的GmWUS2基因功能研究
2022-05-13韩露渠可心傅永福陈庆山武小霞张晓玫
韩露,渠可心,傅永福,陈庆山,武小霞*,张晓玫*
(1.东北农业大学/东北农业大学农学院大豆遗传改良实验室,黑龙 江哈尔滨, 150030;2.中国农业科学院作物科学研究所,北京 , 100081)
大豆是共生固氮类植物的典型代表,其根部可与根瘤菌共生并产生根瘤。根瘤具有固氮能力,在自然界氮素的循环中起着重要的作用[1]。结瘤的数量影响植物的固氮能力。结瘤由多种过程控制,包括外部环境和结瘤内部的自动调节机制等[2,3]。结瘤的自动调节通过涉及叶片的系统过程,来控制每株植物的根瘤数量。叶组织感知来自根部早期结瘤事件的信号,然后产生新信号并传递到根,进一步限制根瘤的发生和发育[4]。
在植物器官发生过程中,分生组织细胞的有序分化和增殖依赖于其不同器官、不同组织区域细胞间的信号交流[5]。拟南芥AtWUS基因在茎端分生组织中心表达,其基因功能缺失突变体植株茎端分生组织不能有序维持,植株的地下部发育也受到影响[6~9]。在拟南芥中,AtWUS 和AtSTM 蛋白发生直接的相互作用,共同结合到AtCLV3基因的启动子上并激活其表达,从而调控茎端分生组织干细胞的活性[10~12]。当CLV3 蛋白积累到一定量之后会反过来抑制AtSTM基因与AtWUS基因的表达[13]。这样,At⁃WUS、AtSTM和AtCLV3共同维持茎端分生组织中干细胞的数量[14~15]。由于根瘤菌对根的侵染,诱导根生成一种多肽(CLV3),通过植物的传导系统向地上运输[16~19],介导合成与根瘤有关的信号因子,通过传导系统向下传至根部,从而调控根部结瘤的数量和发生位置[20]。CLV3 蛋白的积累量会影响WUS基因的表达[1,21~24]。但大豆中WUS基因是否介导结瘤有关的信号分子,从而调控根部结瘤的数量和发生位置尚不清楚。
为探究GmWUS2基因在大豆结瘤过程中的作用,本实验利用CRISPR/Cas9 基因编辑和发根转化等技术[25],分析GmWUS2基因对大豆结瘤过程的影响。研究结果为阐明GmWUS2基因对根瘤发育的调控机制及其在农业生产上的应用奠定良好基础。
1 材料与方法
1.1 材料
实验所用的大豆(Glycine max(L.)Mer.)为大豆品种天隆1 号。实验中所用大肠杆菌(Escherich⁃ia coli)菌株为DH5α;发根农杆菌(Agrobacterium rhizogenes)为菌株K599;快生根瘤菌(Sinorhizobi⁃um fredii)菌株为HH103。植物表达载体Fu76,Fu28,Fu79,表达载体pSoy10 均由本实验室构建。主要试剂:所有连接酶、限制性内切酶、DNA 连接酶购自TaKaRa。Gateway® LR Clonase® II enzyme mix 购自Invitrogen。试剂盒及其他试剂:质粒小提试剂盒购自北京博迈德公司;琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司;EasyPure®Plant RNA Kit 购自北京全式金生物技术公司。PCR扩增引物合成及DNA 序列测定由北京睿博兴科有限公司完成。
1.2 方法
1.2.1 序列分析 利用Phytozome 网站的BLAST工具,将拟南芥AtWUS 蛋白氨基酸序列与大豆蛋白比对,寻找同源基因GmWUS2(Glyma. 11G07650 0)。将所得数据在MEGA 5.05 软件中分析Gm-WUS2 氨基酸序列的相似性及绘制进化树。
1.2.2 启动子扩增和相关载体的构建 采用CTAB 法提取天隆1 号基因组DNA。根据Phytozome 基因组文库中GmWUS2基因的转录起始位点(TSS)上游3000 bp 片段,设计扩增引物(表1),扩增GmWUS2启动子(GmWUS2pro)序列。以大豆天隆1 号DNA 为模板进行扩增。利用1.5% 的琼脂糖凝胶检测扩增序列。将扩增出来的GmWUS2启动子片段,分别用XhoI 和BamH I 克隆位点连接到入门载体Fu76 上。连接产物转化大肠杆菌DH5α感受态,通过菌液PCR 筛选阳性入门载体克隆Fu76-GmWUS2pro。通过LR反应(Invitrogen),将入门载体Fu76-GmWUS2pro和另一个入门载体Fu79-GUS与双元载体pSoy10 在LR 酶的作用下,产生GmWUS2pro:GUS表达载体(表2)。通过电转法将该表达载体转化农杆菌K599 感受态,获得相对应的阳性农杆菌。

表1 实验所需扩增引物Table 1 A list of primers required in this study
1.2.3 构建CRISPR/Cas9 突变载体 通过CRISPR工具设计GmWUS2基因的靶位点序列sgRNA。每个靶位点序列挑选2个评分高的,距离较近,均在外显子区域的靶序列为编辑位点。然后合成两个靶序列片段,并分别用BsaI 和BspQ I 酶切连接到Fu79-sgRNA。 将 Fu76-Cas9、 Fu79-sgRNA与pSOY10,通过LR 反应将sgRNA 表达框和Cas9 表达框克隆到pSOY10 上(表2)。通过电转法将表达载体转化发根农杆菌K599 感受态,获得相对应的农杆菌。
1.2.4 过表达载体构建 将GmWUS2基因的编码区序列利用XbaI 和SphI 克隆位点,酶切连接至入门载体Fu28 上与GFP 标签融合,然后通过LR 反应将其与Fu76-35S一起构建至pSOY10 上(表2)。通过电转法将表达载体转化发根农杆菌K599 感受态,获得相对应的农杆菌。

表2 本文中所构建的载体信息Table 2 Vector information in this study
1.2.5 发根转化 将GmWUS2pro:GUS表达载体、35Spro:GmWUS2:GFP表达载体和大豆基因编辑载体Cas9:GmWUS2分别导入发根农杆菌K599 菌株中用于大豆毛状根转化。大豆种子用氯气熏蒸法灭菌16 h,取出置于超净台吹净剩余氯气后,再用灭菌的超纯水浸泡17 h 备用。将含有目标载体的K599农杆菌,挑单克隆鉴定,活化后用培养基振荡培养至菌液OD600值在1.0~1.1 之间。菌液在22℃,4000g下离心10 min 后,菌块重悬于LCCM 培养基(1/10×Gamborg B5 盐,30 g/L;蔗糖(3.9 g/L);0.59 g/L MES pH5.4;灭菌后加入40 mg/L 乙酰丁香酮),获得重悬液。将浸泡好的大豆胚根切掉,留下靠近子叶节的下胚轴和子叶为外植体。将外植体浸于重悬菌液中浸泡30 min 完成侵染。取出外植体,在滤纸上吸干重悬液。将侵染后的大豆外植体置于共 培 养 基(1/10 × Gamborg B5 盐;30 g/L 蔗 糖(3.9 g/L);0.59 g/L MES; 4.25 g/L 琼脂;pH5.4;灭菌后加入Cysteine(400 mg/L);二硫苏糖醇(154.2 mg/L)和40 mg/L 乙酰丁香酮)上,避光培养3 d。将共培养后的大豆外植体的下胚轴垂直插入发根诱导培养基(1 × Gamborg B5 盐;30 g/L 蔗糖;0.59 g/L MES;7 g/L 琼 脂;pH5.7;灭 菌 后 加 入100 mg/L Timentin;100 mg/L Cefotaxime)中,置于16 h/8 h 光暗下培养12 d。待在靠近子叶节的下胚轴处诱导生成毛状根生长至2 cm 时,取出洗净培养基。置于根瘤菌HH103 悬浮液中浸染30 min,完成根瘤菌接种。把整个植株移至蛭石中培养。培养14 d 后可见幼嫩根瘤,取材用于后续实验。
1.2.6GmWUS2基因在大豆各组织的表达分析取大豆的茎、叶、花、荚、果实、根和根瘤为实验材料,用全式金EasyPure®Plant RNA Kit 提取大豆各组织的总RNA。使用Prime ScriptTMRT reagent Kit反转录试剂盒合成cDNA,将cDNA 用RNase free H2O 以1:3 的比例稀释,并且以此作为模板。使用Primer 5 软件设计GmWUS2基因的荧光定量PCR 引物(表1)。以大豆GmUKN2为内参基因[26]。在荧光定量PCR 仪上进行qRT-PCR,两步法反应运行程序为:95℃30 s;95℃10 s,60℃30 s,40 个循环。基因表达分析通过2-△△CT方法计算。
1.2.7 GUS 染色 GUS 表达的组织化学分析主要参考Jefferson 等方法进行[27],并稍作修改。将接种HH103 根瘤菌的发根植株在蛭石中生长14 d 后取出,在流水下轻柔清洗洗净根和根瘤上残留的蛭石。在距离根瘤着生处的上下各1 cm 的位置剪断,获取根瘤及根瘤附近根新鲜组织为材料。将新鲜材料在预先冷却的90%丙酮中真空固定5 min, 在冰上放置20 min,用冷水冲洗5 min,加入冷却的GUS染液(50 mmol/L Sodium phosphate buffer,0.2% Triton-X-100, 5 mmol/L K4Fe(CN)6,5 mmol/L K3Fe(CN)6,1~2 mmol/L X-gluc),使用真空浓缩机抽真空10 min,并在37℃下过夜。再浸泡在不同浓度下的乙醇(50%和75%)中梯度脱水。将样品材料放置在在4℃下保存或在显微镜下观察染色结果。
1.2.8 大豆结瘤实验 结瘤实验主要参考Kereszt等的方法[28]。在荧光显微镜下观察植株的毛状根是否具有RFP标记基因片段的红色荧光。将成功转化35Spro:GmWUS2:GFP表达载体、大豆基因编辑载体Cas9:GmWUS2或对照的发根植株,分别接种根瘤菌HH103:即将植物根部浸泡在根瘤菌重悬液中30 min 完成根瘤菌侵染。然后将植株移栽到装有蛭石、含有营养液的盆中,放置在温室(短日照8 h/16 h光暗)正常培养。
培养根瘤菌HH103 的TY 培养基配方为:3 g/L酵母提取物, 5 g/L Tryptone, 0.4 g/L CaCl2, pH 7.0。植物营养液配方:1 mmol/L KNO3, 1 mmol/L CaCl2,10 µmol/L Fe-citrate,0.25 µmol/L MgSO4, 0.25µmol/L K2SO4,1µmol/L MnSO4,2µmol/L H3BO3,0.5µmol/L ZnSO4, 0.2 µmol/L CuSO4,0.1 µmol/L Co-SO4,0.1 µmol/L Na2MoO4,KH2PO4,pH 5.8。在接种根瘤菌28 d 后取材,分析大豆根和根瘤的表型。根瘤的数目为单株(发根遗传转化材料)为单位的总的根瘤数。
2 结果与分析
2.1 基因序列分析
在Phytozome 数据库中找到与AtWUS(AT2G179 50)同源性较高的两个基因,位于1 号染色体上Gm⁃WUS1(Glyma. 01G166800)和位于11 号染色体上的GmWUS2(Glyma. 11G076500)。氨基酸序列相似性比对如图1所示,GmWUS1和GmWUS2 与AtWUS相似度都较高。在相关网站(http://plants. ensembl.org/)选取同源性评分在190 左右的序列,再用相关软件生成植物WUS 转录因子的进化树,发现大豆GmWUS2 与苜蓿MtWUSL1 进化关系最近,相比较而言,与GmWUS1 进化距离相对较远。大豆的两个GmWUS基 因 与 水 稻OsWOX1、OsWOX2和 拟 南 芥AtWUS进化关系远,而与苜蓿MtWUSL2、MtWUSL3、MtWUSL4、MtWUSL5和MtWUSL6进化关系更远。因此,本文克隆GmWUS2基因并对其在植株根和根瘤发育中的作用进行初步分析。
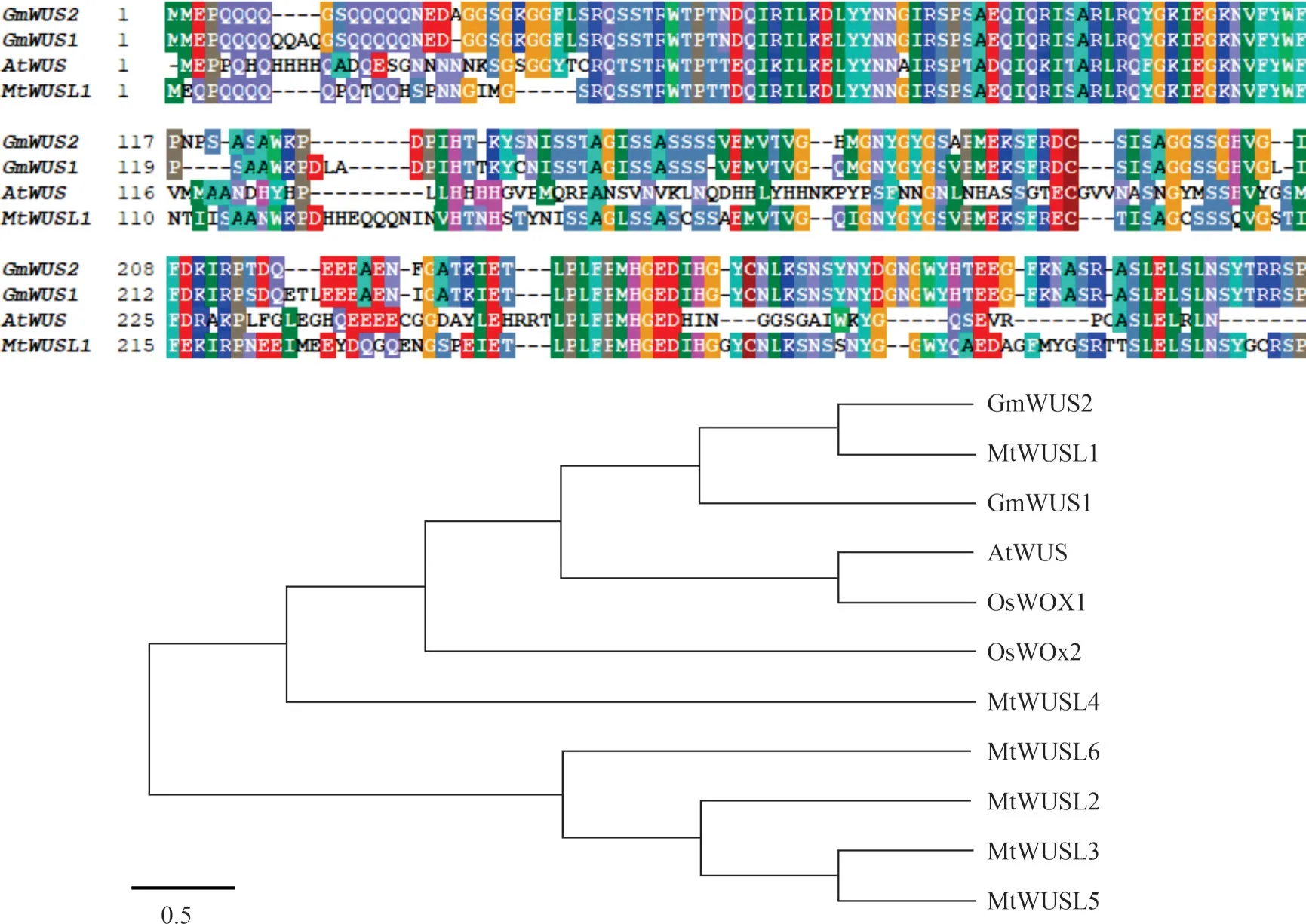
图1 植物WUS氨基酸序列比对及进化树分析Fig.1 Alignment of plant WUS amino acid sequence and an evolutionary tree
2.2 克隆GmWUS2启动子及构建相关载体
以大豆天隆1 号叶片DNA 为模板进行扩增,扩增获得GmWUS2基因转录起始位点上游3000 bp 的启动子序列GmWUS2pro。利用1.5%的琼脂糖凝胶检测扩增序列并回收扩增片段构建相应载体。序列通过测序分析确定。
2.3 启动子活性分析
通过qPCR 检测结果显示GmWUS2基因在大豆的各个组织都有所表达(图2A),其中在花中的表达量最高,其次是在根瘤中。分生组织在植物的个体发育过程中具有非常重要的作用,植物体所有器官均来自于分生组织内细胞的分裂和分化活动,因此检测分生组织基因在植物根和根瘤中的表达模式非常重要。将含GmWUS2pro:GUS的转化发根植株移栽到蛭石中生长14 d 后,取其根和根瘤进行GUS染色。如图2B、C、D 所示,GmWUS2pro:GUS在根的维管组织、侧根原基、根尖和根瘤中都可见GUS 信号。结果说明,GmWUS2启动子在大豆根部和根瘤中均能驱动GUS基因表达,即该基因可能在这些组织中发挥作用。
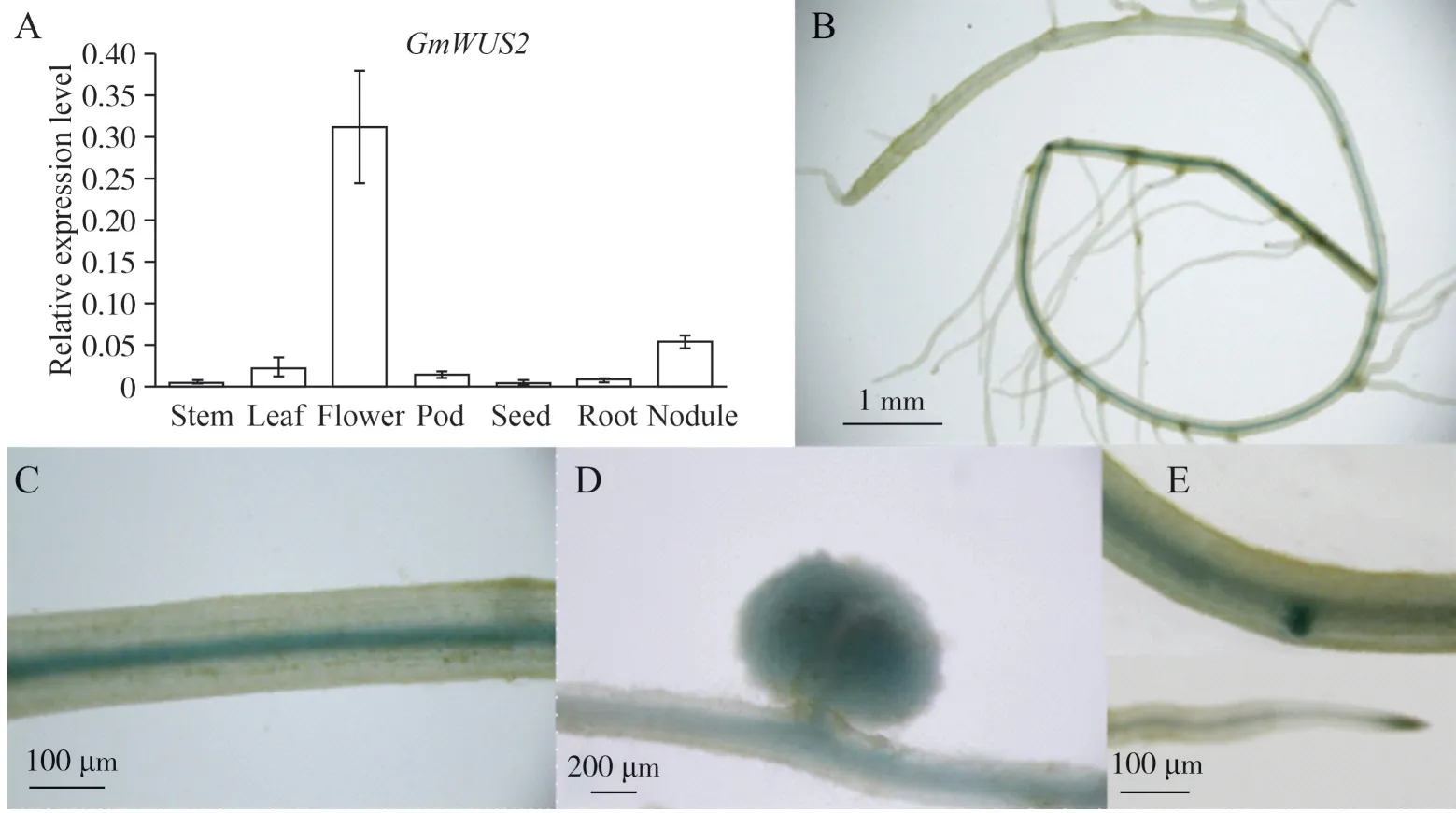
图2 GmWUS2pro:GUS在大豆根和根瘤中的表达模式Fig.2 GmWUS2pro:GUS expression pattern in soybean roots and nodules
2.4 突变体分析
2.4.1 敲除植株发根RFP基因的检测 为了确保CRISPR/Cas9 敲除载体成功导入大豆根部,进行如下实验验证。通过大豆发根实验,将构建好连接有目的基因靶位点的CRISPR/Cas9载体与空载体分别导入大豆毛状根。由于pSoy10 载体中带有RFP标记基因片段,所以阳性大豆毛状根具有红色荧光。在接菌28 d 后取Cas9 敲除载体和对照发根植株,在荧光显微镜下观察,可以看到植株根部的红色荧光清晰明亮(图3),说明CRISPR/Cas9敲除载体和对照植株的空载体都成功被导入到了大豆的再生根部。
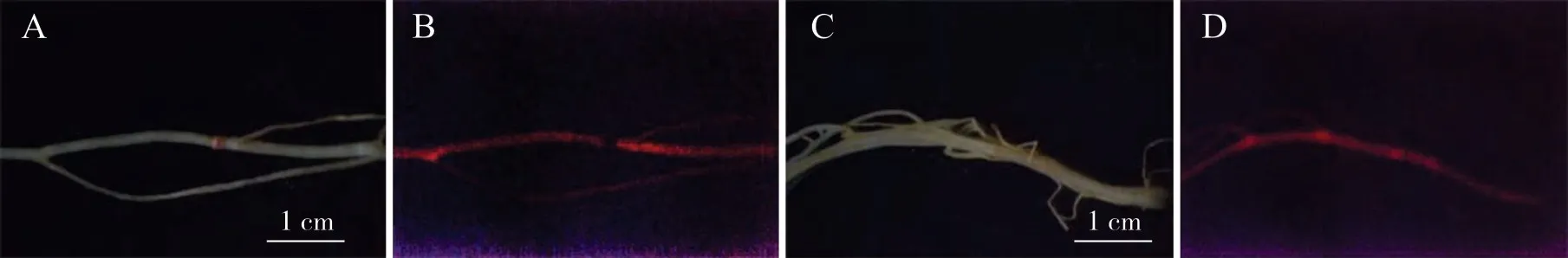
图3 转基因发根的鉴定Fig.3 Confirmation of transgenic hairy roots
2.4.2 靶基因的敲除位点检测 为了验证Cas9 敲除载体的靶位点是否有效,进行如下实验验证。在接菌28 d 后,取敲除发根用CTAB 法提取发根基因组DNA。以DNA为模板,进行PCR扩增,1.5%琼脂糖凝胶电泳检测阳性克隆。切胶回收目的条带,送交公司测序。通过测序结果显示编辑后的基因缺失1200 bp碱基(图4),证明靶位点有效。
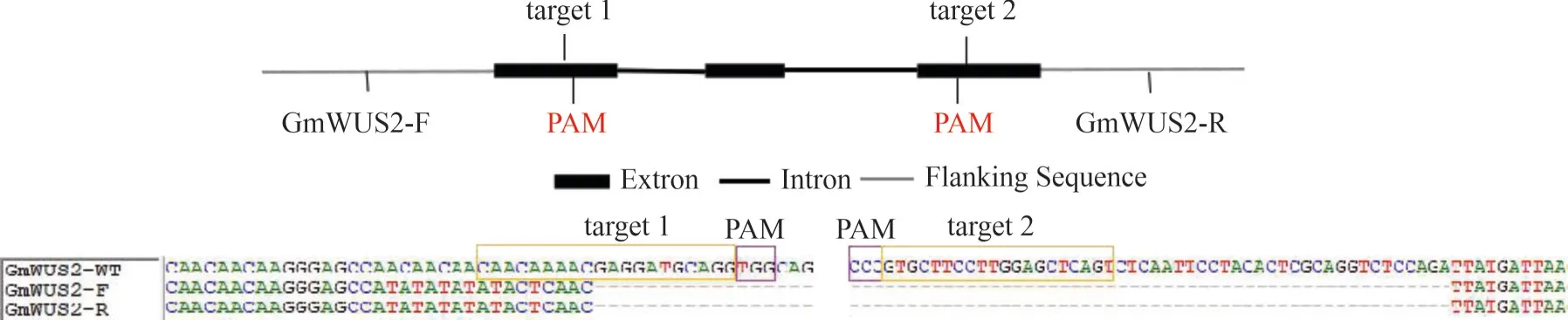
图4 突变发根的基因编辑结果分析Fig.4 Analysis of the GmWUS gene editing in mutated hairy roots
2.5 转基因植株的表型分析
接菌28 d 后对植株的地上部和地下部进行表型观察。发现Gmwus2突变体植株的叶片明显要比GmWUS2过表达植株(图5B)和对照组植株(图5C)的叶片更大、更绿,而过表达植株的叶片较小而且出现黄化现象(图5)。然后,分别统计10 条根上的平均结瘤情况(图6),将三次重复数据进行统计分析。结果显示,Gmwus2突变体植株(图6B)上的平均结瘤数为99.78 个,对照植株(图6A)的平均结瘤数53 个,而GmWUS2基因过表达植株(图6C)的平均结瘤数为35.33个。说明Cas9突变体植株上的结瘤数目要多于GmWUS2过表达植株和对照植株,而GmWUS2过表达植株的结瘤数目也明显少于对照植株的结瘤数目,过表达植株上的根瘤数是最少的(图6)。因此,GmWUS2基因对大豆根瘤形成具有抑制作用,根瘤的多少影响植物的固氮效率,从而对植物地上部(叶片)生长也具有间接的调控作用。

图5 接菌后28天Gmwus2突变体和35Spro:GmWUS2叶片对比Fig.5 Leaf comparison of Gmwus2 mutants and 35Spro:GmWUS2 in 28 days after inoculation
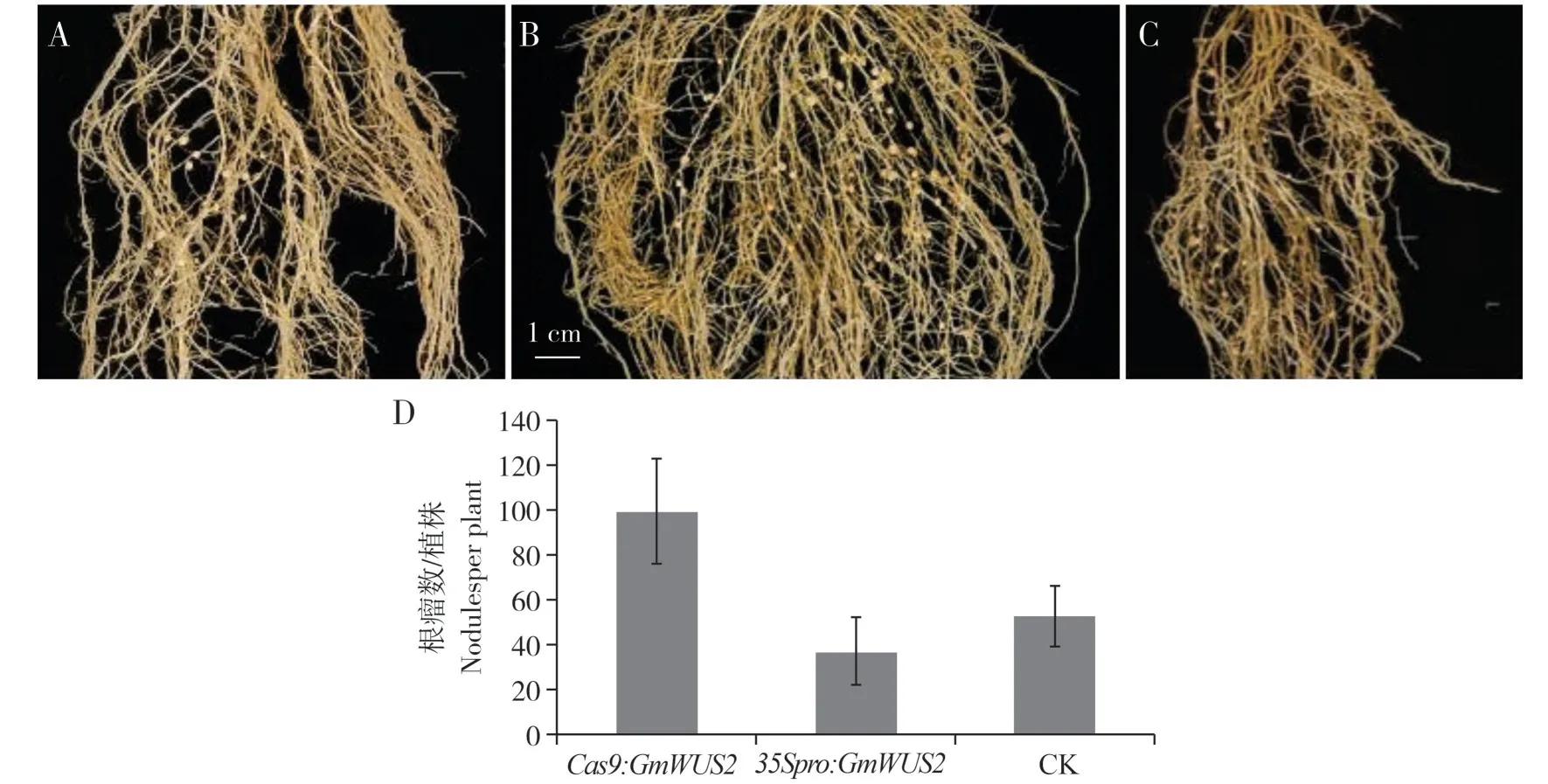
图6 Gmwus2突变体和35Spro:GmWUS2根瘤对比Fig.6 Gmwus2 mutant and 35Spro:GmWUS2 nodule comparison
3 讨论与结论
WUS与CLV3和STM等分生组织特异的关键基因相互协同作用,调控分生组织细胞的分裂和分化[29]。大豆CLV3基因已经被报道具有调节根瘤发生的功能,该基因的突变导致根瘤的大量发生[20]。本研究对大豆WUS同源基因GmWUS2基因在根瘤发育中的潜在作用进行初步探讨发现,GmWUS2与拟南芥的AtWUS基因序列高度相似,但是更接近于苜蓿的WUS同源基因MtWUSL1,显示豆科植物WUS基因功能的潜在相似性。GmWUS2基因主要在大豆根的维管组织、侧根原基、根尖和根瘤表达。Gm⁃WUS2过表达导致植株结瘤数减少,而基因突变会增加根瘤数,说明GmWUS2基因作为一个负调控因子对根瘤具有负向调控作用,这与GmCLV3基因的功能类似。但是,GmCLV3编码蛋白作为可移动信号从地上部被运输到地下部发挥作用,而WUS基因在根瘤中的功能尚未见报道。因此,GmGUS2基因作为负调节因子调节根瘤发生的详细机制有待进一步研究。
根瘤的发生和功能与整个植株的生长发育密切相关。根瘤的数量与植株的固氮能力密切相关,根瘤往往会促进地上部的发育[30]。本研究通过构建稳定的Gmwus2突变体和GmWUS2过表达材料进一步证实这一理论,即Gmwus2突变体的叶片比野生型大而绿,过表达GmWUS2基因则抑制叶片生长,叶片较黄。GmWUS2在大豆的根与根瘤的各个位置均有表达,说明该基因在其他器官发育过程具有潜在功能。这对于解析大豆根瘤在其它器官发育中发挥的作用机制及其在提高大豆固氮效率上都具有重要意义。
WUS基因主要在分生组织中发挥功能。本研究证实GmWUS2参与大豆根瘤发育的调控,而且暗示该基因还可能在其他器官中有功能,研究结果丰富了分生组织基因功能。此外,大豆遗传转化相对较难、更花时间和人力。本研究结果说明,与根部相关的基因功能,可以通过发根转化系统对基因功能进行快速分析,筛选出参与根或根瘤相关的功能的目标基因,然后进行深入研究。
