基于15N 示踪法的双根大豆系统氮素吸收和分配特性研究
2019-12-13马春梅吕晓晨龚振平
马春梅,王 晶,夏 玄,王 畅,吕晓晨,李 莎,2,程 娟,龚振平*
(1 东北农业大学农学院,哈尔滨 150030;2 东北农业大学资源与环境学院,哈尔滨 150030)
大豆是重要的粮油兼用作物,其根瘤中的根瘤菌能够高效地固定空气中的氮气,且高产大豆往往有较高的根瘤固氮量[1]。而单纯依靠大豆的根瘤固氮无法达到大豆高产的目标,许多学者研究表明,适量的施氮能够提高大豆产量[2-6],然而施氮却会抑制根瘤的生长及根瘤固氮[7-17]。Gan 等[18]研究发现,在水培条件下,给大豆分别施加不同浓度的NO3-和NH4+,施用高浓度肥料氮能明显抑制大豆根瘤数量、干重及根瘤固氮。作物利用的氮素主要有NO3-和NH4+,而NO3-和NH4+对根瘤的抑制作用也不尽相同,多数学者认为豆科作物根瘤生长对NO3-比NH4+更为敏感[7-10]。而Dazzo 等[11]分别用不同浓度的NH4+和NO3-处理三叶草,发现16 mmol/L 的NO3-与1 mmol/L 的NH4+对结瘤的抑制相同,表明结瘤过程对NH4+的敏感性大于对NO3-的敏感性。Fujikake等[19]研究发现,在水培条件下施加NO3-后,大豆根瘤直径的增长完全停止,而未加NO3-时,根瘤的生长迅速回到原来的正常速率。由此证明NO3-引起的抑制根瘤的生长是可逆的。但也有少数学者认为,施加少量氮会促进结瘤并提高根瘤固氮酶活性[18,20]。Xia 等[21]利用大豆双根系统,在砂培条件下,一侧施加高浓度氮,另一侧不施氮,研究发现施加高浓度氮侧的根瘤量减少,而不施氮侧根瘤量均增加,表明高浓度氮对根瘤的形成及生长的抑制作用有局部接触效应。另外,在水培条件下,利用大豆分根系统,一侧施NO3-,另一侧不施氮,研究发现供氮侧的根瘤生长会受到抑制,当供给高浓度的NO3-时,不施氮侧的根瘤数量不变但重量减小,这可以解释为根瘤生长受到非局部性的抑制[22-23]。Daimon 等[16]则认为,长期施加NO3-,对花生结瘤和根瘤活性的抑制作用是系统性的。施氮导致根瘤的系统性抑制的机制有可能与氮的分配及转运有关。因此研究氮的分配及转运可能为解析根瘤的系统性抑制提供理论参考。Tanaka 等[12]利用大豆分根系统,一侧施15NO3-,一侧不施氮,发现15N 标记出现在不施氮侧的根及根瘤中,说明一侧的根吸收的NO3-会转移到另一侧的根中。Oghoghorie等[24]在水培条件下,将豌豆的根分为上下两个部分并且隔开,在根的上部施加15N2,发现除了地上部能检测到15N 标记,在根的下部及根瘤中也检测到了15N 标记;同样在根的上部施加15NO3-,发现地上部、根的下部及根瘤中均检测到了15N 标记,表明由根吸收的氮或由根瘤固氮运输到地上部的氮素会有一部分返回到根及根瘤中。
有许多学者认为,作物体内除了会发生碳的循环[25],也会发生氮的循环,即氮的分配与再分配,而对于氮的转运量的研究较少。本试验利用嫁接方法制备出大豆的双根系统,在砂培条件下施用15N 标记NO3-和NH4+,对R1 期 (始花期) 和R5 期 (始粒期) 的大豆植株干重、氮含量、15N 丰度进行测定与分析,对大豆不同时期各组织的氮素来源 (肥料氮和共生固氮) 进行量化,并构建了计算大豆地上部向根及根瘤转移氮量的方法。系统研究了大豆对不同氮形态的吸收、分配及再分配特点,为解析肥料氮和根瘤固氮的互作机制及大豆根瘤形成的系统性调控提供参考。
1 材料与方法
1.1 试验设计
试验于2016 年在东北农业大学校园内进行,在砂培条件下,利用嫁接方法制备出双根大豆植株,并施用15N 标记的NO3-和NH4+为氮源进行研究。15NO3-或15NH4+的15N 丰度均为3.63%。
1.1.1 双根材料制备 选用直径0.3 m、高0.3 m 的塑料桶,插入与桶内部形状契合的定制PC 塑料板,在塑料桶中间位置用胶固定密封,形成两个相等且独立的空间,塑料板高度低于桶沿2 cm,在桶底分别钻1 cm 直径的排水孔,于桶底每个圆孔上方放入一块纱网,防止江砂堵塞圆孔,再将洗净的江砂装入桶中,总装砂量为20 kg,用于培养双根大豆材料。
大豆双根植株制备方法:参考Xia 等[21]的大豆双根植株制备方法。将大豆 (品种为‘垦丰16’) 种子播于细砂中,播深2 cm,置于培养箱中30℃培养3 天,当大豆子叶着生处至根尖长约7~10 cm 时,用蒸馏水冲出幼苗根系,取大豆幼苗用灭菌刀片在两株幼苗胚轴中间偏上的位置,向上或向下划0.5~1.0 cm 长切口 (不切断),一个大豆幼苗由子叶向根部方向豁开 (图1A),另一个大豆幼苗由根部向子叶方向豁开 (图1B),然后将两株幼苗的切口相互插入 (图1C) 后用嫁接夹夹好,再将两幼苗的根分别栽植于桶内隔板两侧的细砂内,嫁接部位恰好处于隔板正上方,将嫁接苗放于防雨棚中,一周后去掉嫁接夹,剪掉图1A 中接口以上部分,只留下接合部位及其下部,使幼苗成为包含两个根和一个地上部的幼苗。图1D 是取样时的双根大豆植株。
1.1.2 试验处理 试验设置NO3-和NH4+两种氮源,供氮浓度均为50 mg/L。试验设置两组试验:试验Ⅰ中一侧施加15N 标记的氮,标记为A 侧;另一侧不施加氮,标记为B 侧。试验Ⅱ中一侧施加15N 标记的氮,标记为A 侧;另一侧施加相对应的14N 的氮(A、B 两侧施相同形态氮),标记为B 侧。每个处理5 次重复,试验处理见表1。
不含氮营养液的组成为:KH2PO4136 mg/L、MgSO4240 mg/L、CaCl2220 mg/L、MnCl2·4H2O 4.9 mg/L、H3BO32.86 mg/L、ZnSO4·7H2O 0.22 mg/L、CuSO4·5H2O 0.08 mg/L、Na2MoO4·H2O 0.03 mg/L、FeSO4·7H2O 5.57 mg/L、Na2EDTA 7.45 mg/L。营养液参考Hoagland 等[26]及董守坤等[27]的配制方法,略有改进。含NO3-的营养液是在上述不含氮营养液的基础上添加KNO3360.7 mg/L,含NH4+的营养液是在上述不含氮营养液的基础上添加 (NH4)2SO4235.7 mg/L。
自幼苗对生真叶完全展开前每日浇1 次蒸馏水,每次每侧浇250 mL。对生真叶完全展开后每日浇1 次配制的营养液,每次每侧250 mL 对应营养液,直至R1 期 (始花期);R1 期后每日浇2 次配置的营养液,早晚各1 次,每次每侧250 mL 对应营养液,至R5 期 (始粒期) 试验结束。当大豆对生真叶完全展开时全部根均接种根瘤菌,其方法是将上年冷冻保存的田间大豆根瘤,清洗研碎后加到营养液中,每升营养液中约含5 g 根瘤,连续接种5 天。

图 1 双根大豆植株Fig. 1 Soybean plant with dual root systems

表 1 试验处理Table 1 Experiment treatments
1.2 取样方法
于始花期和始粒期取样两次,将植株分为A 根、B 根、A 侧根瘤、B 侧根瘤、茎、叶片、叶柄、荚等部位,105℃杀青30 min 之后,65℃烘干,样品用于测定15N 丰度、干重和氮含量等指标。
1.3 测定分析
植株氮含量测定:以K2SO4和CuSO4为催化剂,浓硫酸消煮后,采用B324 全自动凯氏定氮仪测定。
15N 丰度测定:先用凯氏定氮法测定植株氮含量,然后将凯氏定氮滴定后的样品溶液浓缩,在冷冻真空条件下与次溴酸锂反应产生氮气,用同位素比率质谱仪 (Thermo-Fisher Delta V Advantage IRMS)采用双路 (DI) 测量方式测定15N 丰度。
1.4 相关计算
试验采用砂培,没有土壤因素,因此植株的两个氮素来源是源于施加15N 标记的肥料氮比例,和源于施加14N 肥料氮或根瘤固氮的比例 (后者在试验Ⅰ中为源于根瘤固氮的比例,在试验Ⅱ中为源于施加的14N 肥料氮+根瘤固氮的比例)。

源于15N 标记的肥料氮的比例,即:

由公式 (1) 和 (2) 可推导出源于15N 标记的肥料氮的比例:

1.5 数据分析
采用SPSS22.0 软件进行方差分析。
2 结果与分析
2.1 大豆对肥料氮与根瘤固氮的吸收及分配
2.1.1 大豆各组织中15N 丰度变化 表2 是试验Ⅰ和试验Ⅱ双根大豆植株中各营养器官的15N 丰度。试验Ⅰ,大豆植株中氮来源为A 根吸收的15NO3-或15NH4+、A 侧根瘤固氮、B 侧根瘤固氮。试验Ⅱ,大豆植株中氮来源为A 根吸收的15NO3-或15NH4+、B 根吸收的14NO3-或14NH4+、A 侧根瘤固氮、B 侧根瘤固氮。

表 2 大豆各组织中15N 丰度 (%)Table 2 15N abundance of the soybean tissues
由表2 可知,NO3-和NH4+两种氮源的试验Ⅰ在R1 期A 根的15N 丰度为2.21%和2.30%,在R5 期为1.9 7% 和2.2 0%;在R 1 期B 根的15N 丰度为0.97%和0.91%,在R5 期为0.85%和0.84%,15N 丰度均高于自然丰度 (0.365%),且小于肥料的15N 丰度(3.63%),表明B 根中的氮除了来自根瘤固氮外,一定有A 根吸收的15N 标记的肥料氮转移到B 根中。在R1 期的A 侧根瘤的15N 丰度为0.78%和0.80%,在R5 期为0.70%和0.70%;在R1 期的B 侧根瘤的15N 丰度为0.60% 和0.59%,在R5 期为0.53% 和0.53%,15N 丰度均高于自然丰度 (0.365%),说明根瘤的氮除了来自根瘤固定的氮外,一定有A 根吸收的15N 标记的肥料氮运输到A 侧及B 侧根瘤中。
在试验Ⅱ中,A 根及根瘤、B 根及根瘤、地上部 (茎、叶片、叶柄、荚) 中的15N 丰度与试验Ⅰ变化规律基本一致,说明两侧根都施氮的条件下,两侧根吸收的肥料氮和两侧根瘤固氮仍然是可以相互转移的。在NO3-和NH4+两种氮源的试验Ⅱ中,R1 期A 根的15N 丰度为2.10%和2.25%,在R5 期为1.87%和2.18%;R1 期B 根的15N 丰度为0.76%和0.70%,R5 期为0.73%和0.67%。R1 期A 侧根瘤的15N 丰度为0.74%和0.79%,R5 期为0.67%和0.70%,R1 期B 侧根瘤的15N 丰度为0.53% 和0.54%,R5 期为0.51% 和0.51%。R1 和R5 期的茎、叶、叶柄的15N 丰度没有显著性差异,说明根系吸收的肥料氮和根瘤固氮对茎、叶、叶柄三个部位的营养作用相同;地上各部分15N 丰度均高于自然丰度 (0.365%),且小于施加的肥料氮的15N 丰度 (3.63%),说明A 和B 两侧根吸收的肥料氮和A 和B 两侧根瘤固氮都会按一定的比例运输到地上部。试验Ⅰ、Ⅱ的R5 期植株各器官的15N 丰度均低于R1 期,说明在R5 期根瘤固氮对植株的贡献大于R1 期。
2.1.2 大豆植株吸收肥料氮和根瘤固氮比例 由表2中的15N 丰度数据,计算出各器官的氮来源于15N 和来源于根瘤固氮或来源于14N 与根瘤固氮的比例 (表3和表4)。

表 3 试验Ⅰ中大豆各组织中氮来源于15N 和根瘤固氮的比例 (%)Table 3 Proportions of nitrogen from 15N fertilizer and nodule fixation of soybean tissues in experiment Ⅰ

表 4 试验Ⅱ中大豆各组织中氮来源于15N 及14N+根瘤固氮的比例 (%)Table 4 Proportions of nitrogen from 15N and 14N+nodule fixation of soybean tissues in experiment Ⅱ
由表3 可知,试验Ⅰ中植株有三个氮源,分别为A 根吸收的15N 标记肥料氮和A 侧根瘤固定的氮及B 侧根瘤固定的氮,但由于A 和B 两侧根瘤固定的氮无法区分,所以表中列出了两个来源,分别为A 根吸收的15N 标记的肥料氮和A、B 两侧根瘤固定的氮。由表3 可知,NO3-和NH4+两种氮源的试验Ⅰ在R1 期A 根的氮来源于A 根吸收肥料氮占56.57%和59.26%,来自于A 根和B 根的根瘤固氮占43.43%和40.74%,R5 期分别为49.13%、56.29% 和50.87%、43.71%;在R1 期,B 根的氮来源于A 根吸收肥料氮占18.53% 和16.83%,来自于A 根和B 根的根瘤固氮占81.47%和83.17%,R5 期分别为14.79%、14.54%和85.21%和85.46%,说明施氮的A 根氮大部分来自A 根吸收的肥料氮,少部分来自根瘤固氮;不施氮的B 根氮大部分来自根瘤固氮,少部分来自A 根吸收的肥料氮。在R1 期,A 侧根瘤的氮来源于A 根吸收肥料氮占12.81%和13.33%,来自于A 根和B 根的根瘤固氮为87.19%和86.67%,R5 期分别为10.20%、10.13%和89.80%、89.87%;在R1 期,B 侧根瘤的氮来源于A 根吸收肥料氮占7.20%和6.89%,来自于A 根和B 根的根瘤固氮为92.80%和93.11%,R5 期分别为5.17%、5.16%和94.83%、94.84%,说明根瘤中的氮绝大多数来自根瘤固氮,少部分来自根系吸收的肥料氮。在R1 期,茎的氮来源于A 根吸收肥料氮占27.85%和31.11%,来自于A 根和B 根的根瘤固氮为72.15%和68.89%,叶片是30.69%、29.72%和69.31%、70.28%,叶柄是29.34%、30.30%和70.66%、69.70%。在R5 期,茎是22.17%、25.07%和77.83%、74.93%,叶片是25.70%、23.63% 和74.30%、76.37%,叶柄是27.44%、25.59% 和72.56%、74.41%,荚是20.46%、23.73%和79.54%、76.27%。可以看出茎、叶片、叶柄三个部分的氮来源比例几乎相同,说明根部吸收的肥料氮和根瘤固氮会按一定的比例运输到地上部分,且对茎、叶片、叶柄三个部分几乎没有差异。
试验Ⅱ中有4 个氮来源,分别为A 根吸收的15N 标记的肥料氮、A 侧根瘤固氮、B 根吸收的14N 肥料氮、B 侧根瘤固氮,由于A 和B 两侧根瘤固定的氮和B 根吸收的14N 肥料氮无法区分,所以表中列出了2 个来源,分别为A 根吸收的15N 标记的肥料氮和B 根吸收的14N 肥料氮及A、B 两侧根瘤固定的氮(表4)。
由于试验Ⅱ中A 和B 两侧根施加的肥料氮只有15N 丰度不同,其他均相同,可以认为两侧根及根瘤所处的营养环境相同,即A 根源于A 侧根吸收的15N 标记的肥料氮等于B 根源于B 侧根吸收14N 的肥料氮,B 根源于A 侧根吸收的15N 标记的肥料氮 (15N)等于A 根源于B 侧根吸收的14N 肥料氮,A 和B 两根源于双侧根瘤固定的氮无法区分,因此可以区分出A 和B 两根的三个氮来源。即A 根氮来源于三个部分 (表4):1) A 根吸收的15N 标记的肥料氮比例;2) A 根源于B 根吸收的14N 肥料氮比例等于B 根源于A 根吸收的15N 标记分肥料氮比例;3) A 根源于A 和B 两侧根瘤固氮的比例等于1 减去上面两个比例。B 根氮来源于三个部分 (表4):1) 源于A 根吸收的15N 标记的肥料氮比例;2)B 根源于B 根吸收的14N 肥料氮比例等于A 根源于A 根吸收的15N 标记分肥料氮比例;3)B 根源于A 和B 两侧根瘤固氮的比例等于1减去上面两个比例。同理可知根瘤的三个氮来源。
地上部的氮来源于A 侧根吸收15N 标记的肥料氮等于来源于B 侧根吸收的14N 肥料氮,源于双侧根瘤固定的氮无法区分,也可以区分出地上部的三个氮来源。如以茎为例,1) 茎源于A 根吸收的15N 标记的肥料氮的比例 (表4);2) 茎源于B 根吸收的14N 肥料氮的比例等于茎源于A 根吸收的15N 标记的肥料氮的比例 (表4);3) 茎源于A 和B 两侧根瘤固氮的比例为1 减去上面两个比例。由此可计算出A 根、B 根、A 侧根瘤、B 侧根瘤、茎、叶片、叶柄、荚的三个氮素来源比例 (表5)。
由表5 可知,NO3-和NH4+两种氮源的试验Ⅱ在R1 期A 根的氮来源于A 根吸收肥料氮为53.15%和57.70%,来源于B 根吸收的肥料氮为12.21% 和1 0.4 0%,来源于A 和B 两侧根瘤固定的氮为34.64%和31.90%,R5 期分别为45.88%和55.64%、11.31%和9.41%、42.81%和34.95%。进一步证明A 根中的氮除了来自A 根吸收的肥料氮,还有来自B 根的肥料氮及根瘤固氮。在R1 期,A 侧根瘤的氮来源于A 根吸收肥料氮为11.64%和13.12%,来源于B 根吸收的肥料氮为5.00% 和5.30%,来源于A 根和B 根的根瘤固氮为83.36%和81.58%,R5 期分别为9.2 2% 和1 0.2 2%、4.4 3% 和4.4 5%、86.35%和85.33%。进一步证明了根瘤中的氮主要来自根瘤固氮,有一少部分来自本根系吸收的肥料氮。在NO3-和NH4+两种氮源条件下,在R1 期,茎的氮来源于A 和B 两根吸收肥料氮的比例为45.80%和61.26%,来自于A 和B 两侧根瘤固氮的比例为54.20% 和38.74%,叶片是43.36%、58.30% 和56.64%、41.70%,叶柄是48.86%、53.18% 和5 1.1 4%、4 6.8 2%。在R 5 期,茎是4 3.9 0%、46.58% 和56.10%、53.42%,叶片是42.00%、44.72% 和58.00%、55.28%,叶柄是46.96%、47.54% 和53.04%、52.46%,荚是36.44%、43.84%和63.56%、56.16%。

表 5 试验Ⅱ中大豆各组织中氮来源于15N、14N、根瘤固氮的比例 (%)Table 5 Proportions of nitrogen from 15N, 14N and nodule fixation of soybean tissues in experiment Ⅱ
2.2 大豆始花期~始粒期地上部向根及根瘤的氮转移量
由表3、表4 可知,双根系统中两个根系吸收的氮可通过地上部相互转移,但这种转运不是简单的过程,而是反映地上与根系和根瘤的相关性。试验中大豆植株各部15N 丰度不同 (表2),将B 根和地上部看做一个系统,对B 根而言,地上部是其15N 供给源,R1~R5 期,B 根增加的15N 量可以用R5 期积累的15N 量减去R1 期积累的15N 量求得,其应等于R1~R5 期由地上部转移下来的15N 量,加上R1~R5期B 根自身吸收自然丰度的15N 量 (试验Ⅰ为根瘤固氮,试验Ⅱ为根瘤固氮和B 根吸收的14N 肥料氮) 之和。设定从地上部转运到B 根的氮量为NT,地上部向下转移氮的15N 丰度用R1 期和R5 期地上部15N 丰度的平均值来计算,则NT× (f地上部R1+f地上部R5)/2 代表R1 期到R5 期从地上部转移到B 根的15N 量;NR5-NR1为R1 期到R5 期B 根的氮积累量,NR5-NR1-NT为R1 期到R5 期来自B 根吸收的氮积累量 (包括根瘤供给的),其乘上15N 自然丰度f自,即 (NR5-NR1-NT) ×f自代表R1 期到R5 期B 根吸收的及根瘤供给的15N 量;NR5× fR5为R5 期B 根全部15N 量,NR1×fR1为R1 期B 根全部15N 量。地上部转移到B 侧根瘤的氮量也可用此方法计算出来。对于试验Ⅱ,则NT×(f地上部R1+f地上部R5)/2+(NR5-NR1-NT) × f自= NR5× fR5-NR1×fR1,即,
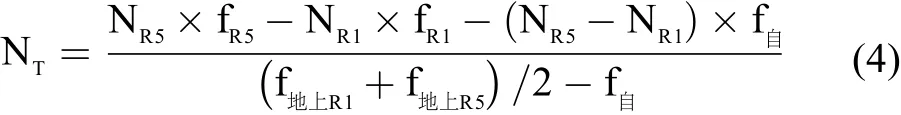
式中,fR1、fR5为B 根或B 侧根瘤在R1 期、R5 期的15N 丰度 (表1),f地上部R1、f地上部R5为地上部R1 期、R5 期的茎、叶片、叶柄、荚的15N 丰度 (表1) 的平均值,f自为自然丰度 (0.365%),NR1、NR5为B 根或B 侧根瘤R1 期、R5 期氮积累量。试验中参数取值见表6。
由 (4) 式结合表6 可以计算出地上部转移到B 根及B 根瘤的氮量,在试验Ⅱ中,由于双侧均施加相同浓度相同形态的氮,仅标记不同,认为地上部向A 和B 两侧的根及根瘤转移的氮量相同,试验Ⅱ在R1~R5 期地上部向根及根瘤的氮转移量和比例见表7。
NO3-和NH4+两种氮源处理下,在R1~R5 期A 根或B 根增加的氮积累量为15.7 mg/株和19.7 mg/株,R1~R5 期从地上部转移到A 根或B 根的氮积累量为6.4 mg/株和5.6 mg/株,占A 根或B 根增加的氮积累量的40.8%和28.4%。R1~R5 期A 侧根瘤或B 侧根瘤增加的氮积累量为20.3 mg/株和18.8 mg/株,R1~R5 期从地上部转移到A 侧根瘤或B 侧根瘤的氮积累量为3.5 mg/株和2.7 mg/株,占A 根瘤或B 根瘤增加的氮积累量的17.2%和14.4%。

表 6 B 根、B 根瘤及地上部始花期 (R1) 和始粒期 (R5) 的15N 丰度及氮积累量Table 6 15N abundance and N accumulation of root B, nodule B and shoot at initial flowering (R1)and initial seeding (R5) stage
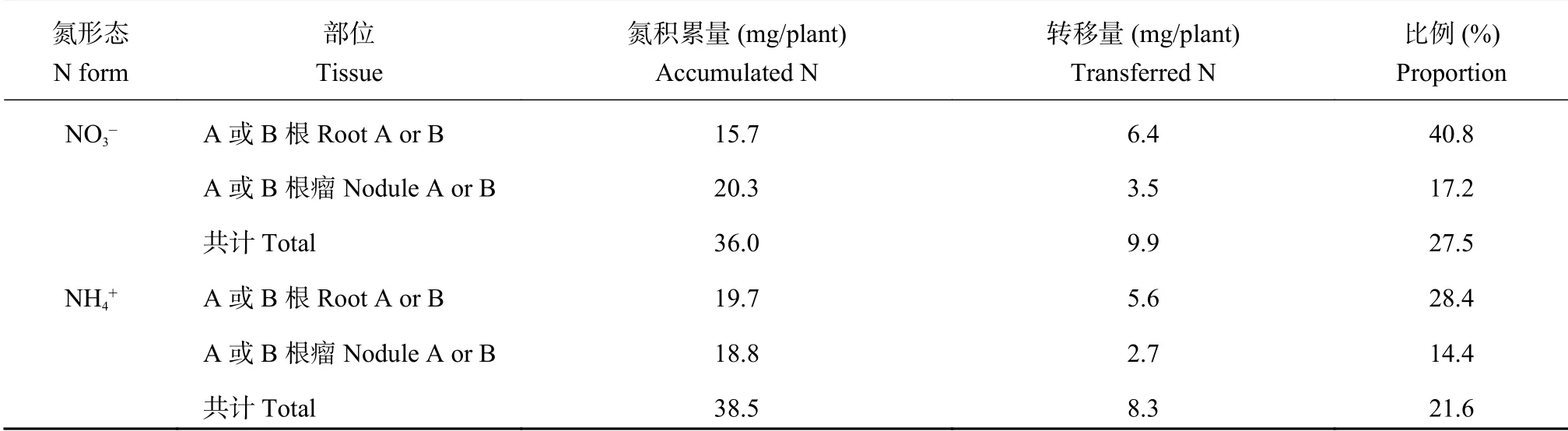
表 7 始花期 (R1) ~始粒期 (R5) 地上部向根及根瘤的氮转移量和比例Table 7 Amount and proportion of N periodically transferred from shoot to root and nodule from initial flowering (R1) to initial seeding (R5) stage
3 讨论
3.1 大豆各器官的氮素来源
大山卓爾等[29]的研究发现,给大豆供给15NO3-,一段时间后发现15N 标记出现在根瘤中,说明硝态氮可供大豆根瘤生长,尤其是在根瘤生长初期,其利用率是较高的。Sato 等[30]向培养大豆的营养液中加入13NO3-,发现13N 标记的NO3-首先出现在大豆叶柄中,接着是叶片中,而在根瘤中很少,说明根吸收的NO3-在短时间内没有转移到根瘤中。本研究中试验Ⅰ、Ⅱ是一侧施15N 标记的肥料氮,而在没有施氮或施没有15N 标记肥料氮的另一侧根瘤15N 丰度高于自然丰度,结合Sato 等[30]的试验结果,说明一定有15N 标记的肥料氮运输到两侧根瘤中,即根瘤中来自根系吸收的氮素主要是由地上部转移下来的。试验Ⅰ和试验Ⅱ中两侧根瘤的15N 丰度均高于氮的自然丰度 (0.365%),说明根瘤生长发育过程中所需要的氮不是全部都来自自身固氮,也有一部分来自根系吸收的肥料氮。且A 侧根瘤的15N 丰度显著高于B 侧根瘤,说明A 侧根吸收的15N 标记的肥料氮供应A 侧根瘤的量多于B 侧根瘤。
Wery 等[31]对苜蓿进行供硝酸铵与不施氮的试验,发现两者在氮积累量上没有显著性差异,但是在供氮条件下根瘤固氮率下降了,而吸收的氮素增加了,说明在有化合态氮和N2同时存在的情况下,苜蓿会优先选择化合态氮。本试验中,试验Ⅰ为单侧供氮,试验Ⅱ为双侧供氮,对比试验Ⅰ和试验Ⅱ中植株各部位来源于肥料氮和根瘤固氮的比例,发现试验Ⅱ中植株各部位来源于根瘤固氮的比例均小于试验Ⅰ,即根瘤固氮率明显下降,这表明在适当增加肥料氮时,大豆植株优先吸收利用肥料氮。
对于铵态氮和硝态氮两种氮素对氮的吸收及分配的影响说法不一。一些学者在大豆和玉米的大田试验中发现,无论是NO3-还是NH4+,使用单一氮源植株的长势均不如NH4+和NO3-混合[32-33]。Chaillou等[34]在水培条件下,利用大豆分根系统,一侧施加NH4+,一侧施加NO3-,研究发现施加NO3-侧的根干重大于NH4+侧的根干重。而Gan 等[18]给大豆分别施加NH4+和NO3-,研究发现施用NH4+比施用NO3-的大豆具有更高生物积累量、根瘤干重、总氮积累量和固氮量。本试验的试验Ⅰ、Ⅱ的NO3-或NH4+处理对比,各器官15N 丰度均没有显著性差异,可能是由于一些细菌的存在将NH4+转化为NO3-,但从其表现来看,施NO3-或NH4+并没有影响大豆植株对氮的吸收及分配,说明在50 mg/L 的氮浓度下,NO3-和NH4+影响大豆对氮吸收和分配的作用几乎相同。
3.2 大豆地上部与根系、根瘤的氮分配与再分配
Oghoghorie 等[24]给豌豆叶面施加15NO3-,发现在地上部、根和根瘤中均检测到了15N 标记,说明叶片中的氮会发生向下的运输,运输到了根及根瘤中。Ito 等[35]用15NO3-或15NH4+处理向日葵叶片,在施氮叶片的上下节间都测到了15N,而且上节间的15N 丰度小于下节间,表明施加在叶片上的氮可以发生向上运输的同时也可以发生向下的运输,即地上部的氮会转运到根及根瘤中。Reynolds 等[36]在水培条件下,利用大豆分根系统,一侧施13NH4+,一侧不施氮,发现13N 先出现在地上部,随后出现在未供氮一侧的根中,说明根部吸收的氮会运输到地上部分,随后再运输回根部。本研究的试验Ⅰ和Ⅱ中地上部、A 和B 两侧根、A 和B 两侧根瘤的15N 丰度均高于氮的自然丰度 (0.365%),且小于施加的肥料氮的15N 丰度(3.63%),表明A 和B 两侧根部吸收的肥料氮和A 和B 两侧根瘤固氮都会按一定的比例运输到地上部;一定有A 根吸收的15N 标记的肥料氮转移到B 根中;也一定有A 根吸收的15N 标记的肥料氮运输到两侧根瘤中,由于试验Ⅱ中双侧根都处于50 mg/L 的相同氮素溶液中,且均有根瘤的存在,可以认为两侧根及根瘤所处的营养状态相同,因此试验Ⅱ中A 根吸收的15N 标记的肥料氮会转移到B 根中,同理可知,B 根吸收的14N 的肥料氮也会转移到A 根中;A 侧根吸收的15N 标记的肥料氮会运输到两侧根瘤中,同理可知,B 侧根吸收的14N 的肥料氮也会运输到两侧根瘤中。综上所述,根吸收的肥料氮和根瘤固氮会以一定的比例运输到地上部,随后会再次重新分配回根及根瘤中。
为估算地上部向根及根瘤转运的氮量及占根和根瘤氮的比例,本试验将大豆双根系统中地上部和未施15N 标记肥料氮的一侧根及根瘤看成一个氮转移系统,利用15N 丰度的差异,构建了R1~R5 期地上部向根及根瘤转移氮量的计算方法。在试验Ⅱ中,利用公式 (1) 计算得出,在NO3-和NH4+两种氮源下,R1-R5 期A 根或B 根来自地上部转移的氮为5.6~6.4 mg/株,占R1~R5 期A 根或B 根氮积累量的28.4%~40.8%;R1~R5 期A 侧根瘤或B 侧根瘤来自地上部的氮为2.7~3.5 mg/株,占R1~R5 期A 侧根瘤或B 侧根瘤氮积累量的14.4%~17.2%。地上部向根及根瘤中转运的氮,是以何种形态和通过什么部位运输的,以及其生理作用如何还有待进一步研究。
4 结论
1) 根瘤生长所需要的氮来源包括自身根瘤固氮和根系吸收的外源氮,且大豆植株优先吸收外源氮。不论供应NO3-还是NH4+,在N 50 mg/L 浓度下,大豆氮的吸收和分配不受氮形态的影响。
2) 大豆根系吸收的肥料氮以及根瘤固氮运输到地上部后,会再次重新分配回根及根瘤中。将大豆双根系统中地上部和施14N 肥料氮的一侧根及根瘤看成一个氮转移系统,利用15N 丰度的差异,构建了R1~R5 期地上部向根及根瘤转移氮量的计算方法。经计算表明,当施氮浓度为50 mg/L 时,R1~R5 期(始花期~始粒期) 根来自地上部转移的氮占根部氮素积累量的28.4%~40.8%,根瘤来自地上部转移的氮占其氮素积累量的14.4%~17.2%。
