花生萌发期对低温胁迫的生理生化响应机制
2022-05-13吕登宇郝西苗利娟于海秋王玉龙张俊董文召黄冰艳张新友
吕登宇,郝西,苗利娟,于海秋,王玉龙,张俊,董文召,黄冰艳,张新友*
(1.沈阳农业大学农学院,辽宁 沈阳, 110866;2.河南省农业科学院河南省作物分子育种研究院/国家生物育种产业创新中心/农业农村部黄淮海油料作物重点实验室/河南省油料作物遗传改良重点实验室,河南 郑州, 450002;3.河南省农业科学院经济作物研究所,河南 郑州, 450002)
花生(Arachis hypogaeaL.)是世界上重要的豆科作物之一,是我国重要的油料作物、经济作物和出口创汇作物[1],其种子萌发是一个多因素参与的复杂调控途径,也是生产过程中最重要、最脆弱的一个阶段,生物和非生物胁迫均可对其生长和产量造成严重影响[2~4],而在花生萌发和幼苗早期生长期间的低温胁迫则是制约花生推广种植的最常见环境胁迫因子之一[5]。在我国,低温是影响花生早春及秋季播种的重要因素,可对花生种子出芽和幼苗生长带来严重影响[6~8]。本研究探讨低温胁迫对花生种子萌发过程中生理生化的影响,为花生耐低温种植及抗冷性研究提供理论依据。近年来,随着花生生产规模的不断扩大,花生耐低温研究越来越受到研究者的重视,在花生冷害方面也取得了一定进展[9]。花生萌发的最低温度为12~15℃[10],在低于最适温度时,种子活力减弱[11],在14~23℃范围内花生出苗速度和温度呈正相关关系[12]。低温影响最常见的症状是萌发率低和萌发延迟[13],花生种子吸胀期间,6℃以下低温胁迫24 小时以上,发芽率和胚根伸长均受到影响[14]。长江流域、华南地区、两广地区及东北地区季节性低温和突发的极端天气等易导致花生出苗率降低、出苗时间延长,甚至“粉籽”、烂种、死苗,直接导致花生减产[15~18]。研究表明,低温处理提高了花生品种相对膜透性、丙二醛含量[19],促使花生幼苗可溶性蛋白、脯氨酸、可溶性糖含量增加[20]。钟鹏等[21]研究发现,低温胁迫诱导了抗氧化酶活性增强,以清除体内氧自由基、活性氧等物质,进而防止植物受到逆境伤害[22~24]。目前对于花生耐低温生理生化机制的研究多集中在出苗后,花生种子萌发期研究相对较少[25],且采用的低温处理方法和检测指标不同,研究结果之间难以直接比较和借鉴。本研究采取冷浸法模拟花生在萌发期突然遭遇短时间低温胁迫,利用差异极显著的感低温材料与耐低温材料,通过测定种子露白率、发芽率、相对发芽率、膜透性、渗透调节物质含量、抗氧化酶活性等一系列生理生化指标,对花生种子萌发期抗冷性进行比较研究,探讨花生萌发期耐低温胁迫的生理生化响应机制,为花生的抗冷栽培和育种提供理论参考。
1 材料与方法
1.1 材料
本试验选取耐低温型品种豫花22 号和中间型品种漯花16 号以及低温敏感型品种泉花6 号、鲁花11 号为试验材料,供试材料的低温耐受性于之前试验中获得[4](从86 份种质中鉴定,含国内主栽64 个品种及育种高代材料22个品系),以第7 d相对发芽率为耐低温性分级标准,材料描述详见表1。均选用籽仁饱满、种皮无破损、均匀一致的种子为供试用种。

表1 品种名称、类型、来源及萌发期低温耐受性Table 1 Name,type,source and low temperature tolerance of varieties at germination stage
1.2 试验设计
试验分为两个处理:以2℃浸种48 h 为低温胁迫处理(LS),以25℃浸种48 h 作为常温对照(CK),处理后均转到25℃步入式人工气候室暗培养7 d。分别在第0 d(干种子)、1 d、2 d(胁迫期)、3 d、5 d、7 d(恢复期)取花生子叶,液氮速冻,后于-80℃冰箱保存备用,用于生理生化指标的测定。每处理选用25粒种子为一个重复,3次重复。
1.3 测定指标及方法
1.3.1 种子露白率、发芽率的测定 处理后,每天调查各处理种子的露白数、发芽数,依据以下公式计算露白率及发芽率:
露白率(%)=露白种子数/供试种子总数×100发芽率(%)=发芽种子数/供试种子总数×100
1.3.2 种子相对发芽率的测定 统计第7 d 发芽率,依据以下公式计算相对发芽率:
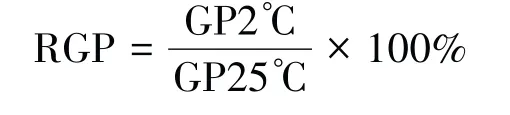
式中:
GP2℃:2℃下的发芽率;
GP25℃:25℃下的发芽率
1.4 生理指标的测定
低温胁迫24 h时种子电导率参照牛晓雪等[26]的方法测定;丙二醛(MDA)含量,抗氧化酶超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性,以及渗透调节物质可溶性蛋白(SP)、可溶性糖(Ss)、含量均采用苏州科铭生物技术有限公司生产的试剂盒(微量法)进行测定。
1.5 数据处理
运用统计分析软件SPSS 26.0 进行方差显著性和相关性分析,采用Microsoft Excel 2016和软件Origin 2017进行数据整理分析和相关图表的制作。
2 结果与分析
2.1 不同温度处理对花生种子发芽指标的影响
由表2得知,不同抗性花生品种在不同温度处理下,露白率、发芽率以及相对发芽率均存在较大差异。常温处理(CK)的各花生品种露白率和发芽率差异不显著,其露白率和发芽率均在92%以上;低温处理的各花生品种露白率和发芽率差异显著,耐低温型品种豫花22号露白率和发芽率均显著高于中间型及敏感性品种,但均低于CK。不同抗性花生品种的相对发芽率差异达显著水平,耐低温型品种豫花22号显著高于中间型和敏感型品种,为90.67%。
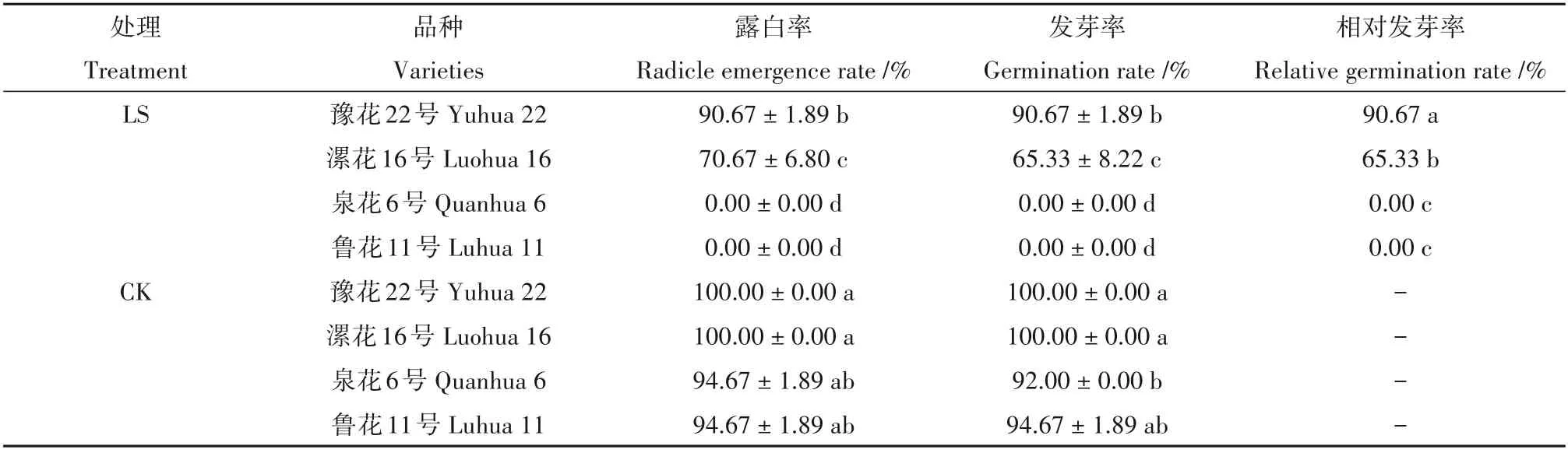
表2 不同温度处理下各品种露白率和发芽率情况Table 2 Whitening rate and germination rate of different varieties under different temperatures
2.2 不同温度处理对花生种子膜透性的影响
如图1A 所示,不同抗性花生品种,常温处理电导率值均高于低温处理。低温胁迫24 h 后,各品种电导率值差异达显著水平(P<0.05),由小到大依次为豫花22 号、漯花16 号、泉花6 号和鲁花11 号。中间型品种漯花16 号、敏感型品种泉花6 号、鲁花11号电导率值分别为豫花22号的1.15倍、1.59倍、2.5 倍。以上结果说明,低温胁迫后,耐低温型品种豫花22号电解质外流最少,对细胞质膜伤害程度最小;其次为中间型品种漯花16 号;敏感型品种溶质外流较多,对细胞质膜伤害程度较大。
由图1B 得知,常温处理条件下,随着萌发时间的延长,种子膜脂过氧化反应逐渐加快,各品种MDA 含量均大幅增加,在第5 d 达到峰值后小幅下降,不同抗性品种未呈现规律性变化。2℃胁迫48 h,不同抗性花生品种MDA 含量均增加且高于CK,且敏感型品种含量提高幅度大于耐低温型品种。恢复常温后,胁迫处理各品种MDA含量均低于CK,但随着萌发时间的延长,耐低温型品种豫花22号MDA 含量仍大幅增加,敏感型品种泉花6 号、鲁花11号小幅下降,与CK含量变化差异较大。
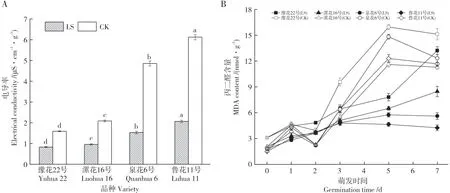
图1 低温胁迫对不同品种膜透性的影响Fig.1 Effects of low temperature stress on membrane permeability of different varieties
2.3 不同温度处理对花生种子渗透调节物质含量的影响
如图2A 所示,常温处理条件下,不同抗性花生品种随处理时间的延长可溶性糖含量逐渐降低。2℃胁迫48 h,各品种Ss含量均高于CK,由大到小依次为豫花22 号、漯花16 号、泉花6 号和鲁花11 号;随着胁迫时间的延长,耐低温型和中间型品种Ss 含量呈先下降后上升的变化趋势,敏感型品种Ss 含量一直下降。恢复常温后,胁迫处理各品种Ss 累积量存在一定差异,耐低温型品种豫花22号Ss含量仍保持着较高的水平。第7d 时,豫花22 号Ss 累积量高于其他3个品种。
由图2B 得知,常温处理条件下,随着处理时间的延长,各品种可溶性蛋白(SP)含量整体呈缓慢下降的趋势。低温处理条件下,耐低温型品种豫花22号以及中间型品种漯花16号SP含量逐渐下降,敏感型品种泉花6号、鲁花11号呈先下降后上升的趋势,胁迫结束时,不同抗性花生品种SP含量由小到大顺序为豫花22号、漯花16号、鲁花11号和泉花6号,且均低于CK。恢复期中,各品种SP含量均高于CK,SP含量在第3 d时达到峰值,后逐渐降低,至第7 d耐低温型品种和中间型品种已恢复正常,SP 含量与对照基本一致,而敏感型品种SP含量则还显著高于CK。
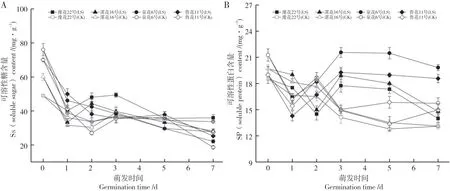
图2 低温胁迫对不同品种渗透调节物质含量的影响Fig.2 Effect of low temperature stress on the content of osmotic adjustment substances in different varieties
2.4 不同温度处理对花生种子抗氧化酶活性的影响
如图3A 所示,常温处理条件下,随着萌发时间的延长,各品种超氧化物歧化酶(SOD)活性小幅度波动,不同抗性品种未呈现规律性变化。低温胁迫期,各品种SOD 活性由高到低依次为豫花22 号>漯花16 号>泉花6 号>鲁花11 号;随胁迫时间的延长,耐低温型品种豫花22 号和中间型品种漯花16 号SOD 活性大于CK,呈现先上升后下降的变化趋势;敏感型品种泉花6 号、鲁花11 号SOD 活性则一直上升且小于CK。恢复期后,耐低温型品种豫花22 号SOD 仍保持着较高活性,中间型品种漯花16 号次之,敏感型品种泉花6号、鲁花11号则活性较低。
由图3B 可知,常温和胁迫处理过程中,各品种过氧化物酶(POD)活性均呈逐渐上升趋势。处理过后,CK处理各品种在第5 d时活性达到峰值;低温处理各品种表现不一,第5~7 d,低温处理各品种POD活性大小依次为豫花22 号、漯花16 号、泉花6 号和鲁花11 号;其中耐低温型品种豫花22 号变化趋势与CK 一致,至第5 d,已恢复至与对照基本一致,而中间型和敏感型品种则不能恢复至正常活性大小,且敏感型品种SOD 活性在恢复期也一直处于较低水平(图3A)。
如图3C 所示,常温处理条件下,随着萌发时间的增加,各品种过氧化氢酶(CAT)活性呈先下降后上升的趋势。低温胁迫过程中,各品种随胁迫时间的延长CAT 活性均逐渐降低,但不同抗性品种下降幅度不同,耐低温型品种豫花22号下降幅度最大为58.42%,中间型品种漯花16 号次之为57.92%,敏感型品种泉花6 号、鲁花11 号分别为47.37%、50.81%。恢复期后,耐低温型品种豫花22 号CAT活性仍保持着较高水平,而中间型和敏感型品种活性则较低,与CK差异也较大。

图3 低温胁迫对不同品种抗氧化酶活性的影响Fig.3 Effect of low temperature stress on antioxidant enzyme activities of different varieties
3 讨论与结论
低温是限制许多重要大田作物生产力和地理分布的主要因素之一,是影响作物种子萌发,生长发育和产量形成的重要因素之一[27,28]。本试验结果表明,低温处理显著降低了花生种子的露白率、发芽率、相对发芽率,延长了萌发时间,相比中间型和敏感型品种,耐低温型品种在低温条件下具有较高的露白率、发芽率、相对发芽率。说明筛选出耐低温种质,对低温区花生生产和耐低温新品种选育有较大意义。
电导率是衡量植物在逆境中细胞质膜伤害的程度,在许多植物研究中被用作鉴定耐低温能力的指标之一[29,30]。本项研究中,2℃低温胁迫24 h后,不同抗性花生品种电导率值由小到大顺序为豫花22号、漯花16号、泉花6号和鲁花11号,且耐低温品种豫花22 号显著低于其他3 个品种,花生品种的耐低温性与电导率值的大小呈负相关关系,这与张子戌等[31]研究结果一致。低温胁迫过程中,花生种子内丙二醛(MDA)含量随处理时间延长逐渐增加,不同抗性品种MDA含量增加幅度不同,敏感型品种增加幅度更大,说明其细胞膜受伤害程度更高。恢复期中,各品种MDA 含量均低于CK,耐低温型品种豫花22 号随着萌发进程MDA 含量仍大幅增加,中间型及敏感型品种增加幅度较小,说明低温胁迫虽对各花生品种细胞膜均造成伤害,但不同抗性品种受伤害程度有所不同。
本研究可以看出,低温处理条件下,可溶性糖(Ss)、可溶性蛋白(SP)的含量与植物的抗冷性密切相关,其含量增加可增强抗冷性。低温处理后,Ss积累量增加,且越耐低温品种Ss 累积量越高;SP 变化趋势与Ss 存在一定差异,各花生品种萌发期遭遇低温胁迫后,敏感型品种SP累积量高于耐低温型品种。复温后,随着萌发时间的延长,耐低温型品种和中间型品种Ss积累量高于敏感型品种;各品种SP积累量均高于CK,且敏感型品种累积量更高。由此表明,各花生品种萌发期遭遇低温胁迫后,细胞内会主动积累更多可溶性物质,以降低细胞渗透势,增加细胞吸水能力,维持膨压,从而避免原生质在低温逆境胁迫下受到脱水伤害[32]。
本研究结果表明,各花生品种萌发期遭遇低温胁迫,随着胁迫时间的延长,超氧化物歧化酶(SOD)、过氧化物酶(POD)活性上升,过氧化氢酶(CAT)活性下降。其中SOD 以及CAT 活性变化幅度较大,POD 变化幅度较小,说明种子在萌发期遭遇低温胁迫后,SOD 及CAT 可能发挥着更大的作用,即抗冷性越强的品种SOD 活性越高,郝晶等[33]、高利英等[4]的研究也得出这一结论。恢复期中,抗氧化酶SOD、POD、CAT 活性表现出相同的趋势,随着萌发时间的延长,抗冷性越强的花生品种其酶活性越高。由此表明,各花生品种萌发期遭遇低温胁迫后,种子内部会迅速启动抗氧化系统,通过SOD、POD、CAT 等抗氧化酶的协同作用来清除因低温胁迫产生的活性氧等物质,抵御逆境伤害[34~37],抗冷性越强的品种其酶活性越高。
本研究针对在花生萌发期突然遭遇的低温冷害,以不同抗冷性花生品种在萌发期遭遇低温胁迫以及胁迫后恢复常温条件的种子萌发作为研究对象,测定种子内部生理指标的变化动态,结果存在较大差异。这在一定程度上解释了春播花生在萌发期突然遭遇短时间低温逆境后种子萌发过程中主要的生理变化及内部的联系,试验结果为今后春播花生的抗冷栽培及耐低温机理研究提供一定的理论依据。
