1932例贝伐珠单抗用药患者相关尿蛋白阳性的自动监测及影响因素分析
2022-05-12李伯妍郭代红王嘉熙郭海丽解放军医学院北京100853解放军总医院医疗保障中心药剂科北京100853重庆医科大学药学院重庆400016
李伯妍,郭代红,王嘉熙,3,郭海丽,张 博(1.解放军医学院,北京 100853;.解放军总医院医疗保障中心药剂科,北京100853;3.重庆医科大学药学院,重庆 400016)
血管生成被认为在肿瘤的生长、发育、增殖和转 移中起到至关重要的作用[1]。抗血管生成治疗研究趋热,通过干预血管生成从而抑制肿瘤生长的药物也相继问世。贝伐珠单抗是第一个在全球获批上市的抗血管类单克隆抗体靶向药物[2]。它以血管内皮生长因子(vascular endothelial growth factor,VEGF)为靶点,与内源性的VEGF竞争性结合其受体(vascular endothelial growth factor receptor,VEGFR),抑制内皮细胞的有丝分裂,减少新生血管的形成,从而阻断肿瘤生长所需的血液、氧气及其他营养供应,起到抑制肿瘤生长的作用[3]。自2004年首次获批上市以来,贝伐珠单抗已先后在美国、欧洲、中国等全球多个国家和地区获批,用于结直肠癌、非小细胞肺癌、乳腺癌等10多种肿瘤的一线治疗[4-5]。研究[6]显示,贝伐珠单抗联合化疗可明显提高有效率,显著改善无进展生存期,且易耐受、不易产生抗药性、无需考虑肿瘤组织学特性。但随着临床应用的日益广泛,其不良反应也逐渐凸显。文献[7]报道,贝伐珠单抗可引起包括出血、高血压、蛋白尿/肾病综合征、胃肠道穿孔和伤口愈合障碍等一系列药品不良反应(adverse drug reaction,ADR),甚至有致死的报道。蛋白尿是贝伐珠单抗常见的不良反应,严重的蛋白尿可导致肾功能损伤、白蛋白降低、血凝异常等问题[8],给临床用药带来极大困扰。为进一步研究真实世界中贝伐珠单抗相关尿蛋白阳性的发生情况,本研究对某三甲医院2018年1月1日 - 2019年12月31日相关用药人群开展自动监测与病例对照研究,获取发生率并探究其相关风险因素。
1 资料与方法
1.1 数据来源
借助临床药物不良事件主动监测与智能评估警示系统-Ⅱ(adverse drug events active surveillance and assessment system-Ⅱ,ADE-ASAS-Ⅱ)[9],构建蛋白尿监测模块,调取医院信息系统(hospital information system,HIS)中2018年1月1日 - 2019年12月31日期间使用贝伐珠单抗的所有住院患者信息;系统自动筛选智能评估给出的报警病例,由2名研究人员根据《药品不良反应报告和监测管理办法》相关评价标准背靠背逐一评价,对于有异议的病例,提请专家做最终评判,以确定阳性病例并计算发生率。
为避免患者性别、BMI对实验结果的影响,在使用贝伐珠单抗而未出现尿蛋白阳性的人群中,利用个案控制匹配方法,按照1∶1的比例对患者性别、BMI进行匹配(控制性别相同,BMI上下浮动不超过0.1 kg·m-2)。对病例组和对照组患者的年龄、KPS评分、疾病史、贝伐珠单抗的使用剂量、周期、给药途径以及肾脏功能相关指标基值等29项指标进行回顾性病例对照研究。
1.2 蛋白尿模块构建相关规则与标准
纳入标准:①用药后尿蛋白定性检查为阳性;②关联性评价为“肯定”、“很可能”或“可能”。排除标准:①用药前尿蛋白定性检查指标缺失;②用药前尿蛋白定性检查阳性;③用药前诊断为肾衰患者。
蛋白尿阳性分级标准:参考美国国家癌症研究所常见不良反应事件评价标准(common terminology criteria for adverse events,CTCAE)5.0版,蛋白尿严重程度分为3级,1级为蛋白尿(+)或24 h尿蛋白定量< 1 g;2级为蛋白尿(++/+++)或24 h尿蛋白定量为1 ~3.5 g;3级为蛋白尿(++++)或24 h尿蛋白定量≥ 3.5 g。
报警阳性率:阳性病例数/系统报警例数,是自动监测系统的功效指标。
1.3 统计学方法
使用SPSS 25.0软件对研究中获得的数据进行统计分析。采用Kolmogorov-Smirnov检验对连续变量进行正态性检验。符合正态分布的数据用均值±标准差表示,比较采用t检验;非正态分布的数据用中位数±四分位距表示,比较采用Mann-Whitney U检验。分类变量数据显示为数字和百分比,比较采用χ2检验或Fisher精确检验。为确定贝伐珠单抗致尿蛋白阳性的相关风险因素,采用单因素和多因素二元条件Logistic回归分析。将单因素显著性小于0.05的风险因素纳入多因素逻辑回归,检验水准α= 0.05。
2 结果
2.1 一般情况
共计纳入患者1932例,系统自动监测报警疑似863例,经过人工评价后确定为阳性的353例,住院人群中贝伐珠单抗相关蛋白尿阳性的发生率为18.27%,系统报警阳性率为40.90%。其中关联性评价为“很可能”6例,“可能”347例。阳性患者的肿瘤类别分布见表1,蛋白尿阳性严重程度或分级见表2。
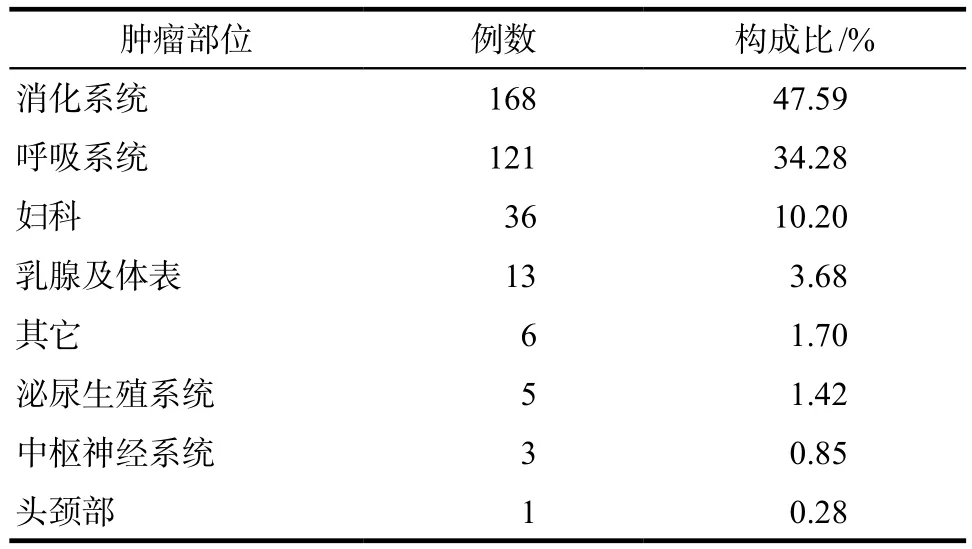
表1 阳性患者罹患肿瘤类别分布Tab 1 Distribution of tumor types in positive patients
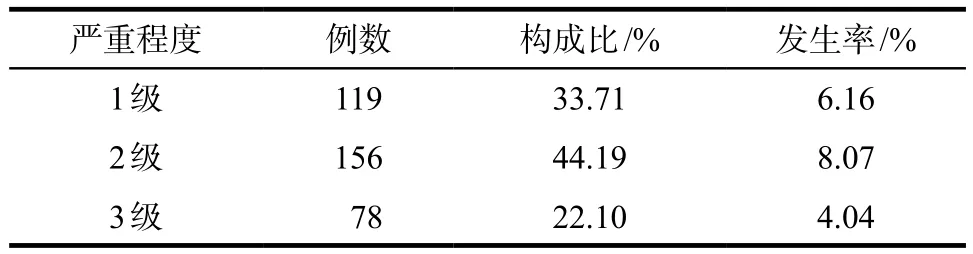
表2 蛋白尿阳性严重程度分级Tab 2 Severity classification of proteinuria
贝伐珠单抗注射液说明书中适应证为:转移性结直肠癌;晚期、转移性或复发性非小细胞肺癌;复发性胶质母细胞瘤及不可切除或转移性肝细胞癌。本研究353例阳性患者中有92例(26.06%)为超适应证用药,多应用于卵巢癌(18例,5.10%)、乳腺癌(13例,3.68%)、宫颈癌(11例,3.12%)等。
2.2 单因素逻辑回归结果
剔除可疑风险因素相关指标不全的病例,经个案控制匹配后得到病例组328例,其中男性患者187例(57.01%),女性患者141例(42.99%)。患者BMI 15.5 ~ 32.4 kg·m-2,平均BMI(23.59±2.98)kg·m-2。对照组男性患者187例(57.01%),女性患者141例(42.99%),患者BMI 15.5 ~ 32.4 kg·m-2,平均BMI(23.61±2.99)kg·m-2。单因素逻辑回归结果显示,合并肾脏疾病、用药剂量、用药周期数、尿糖定性、收缩压基值、肌酐基值差异均有统计学意义(P< 0.05),见表3。
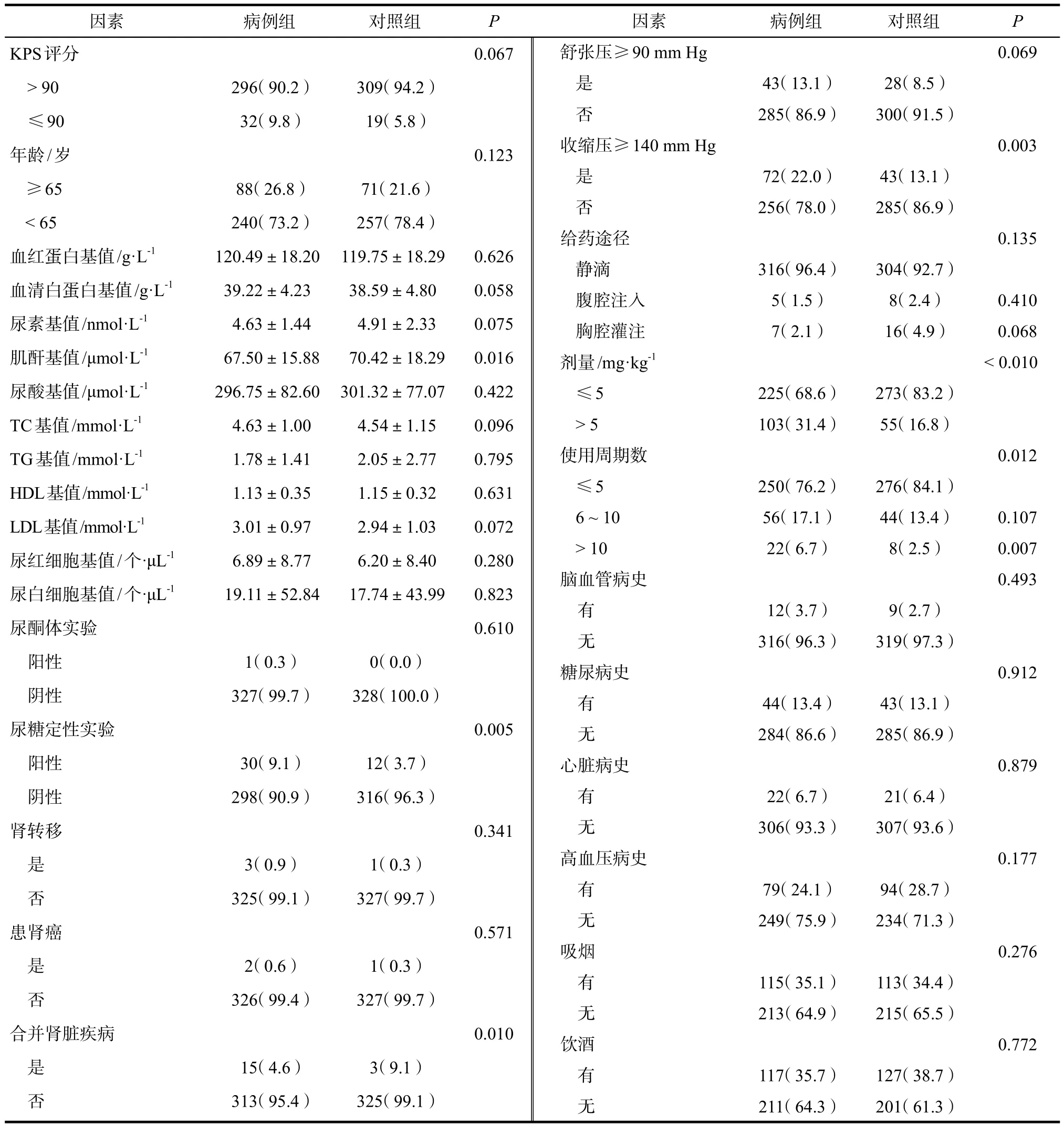
表3 单因素逻辑回归分析结果Tab 3 Results of single factor Logistic regression analysis
2.3 多因素逻辑回归结果
对单因素逻辑回归分析中P< 0.05的因素进行多因素逻辑回归分析(为方便统计,连续变量转换为分类变量表示),结果表明合并肾脏疾病,单次使用剂量> 5 mg·kg-1,使用贝伐珠单抗周期数>10,用药前尿糖定性为阳性和收缩压基值偏高为应用贝伐珠单抗后出现尿蛋白阳性的风险因素,见表4。
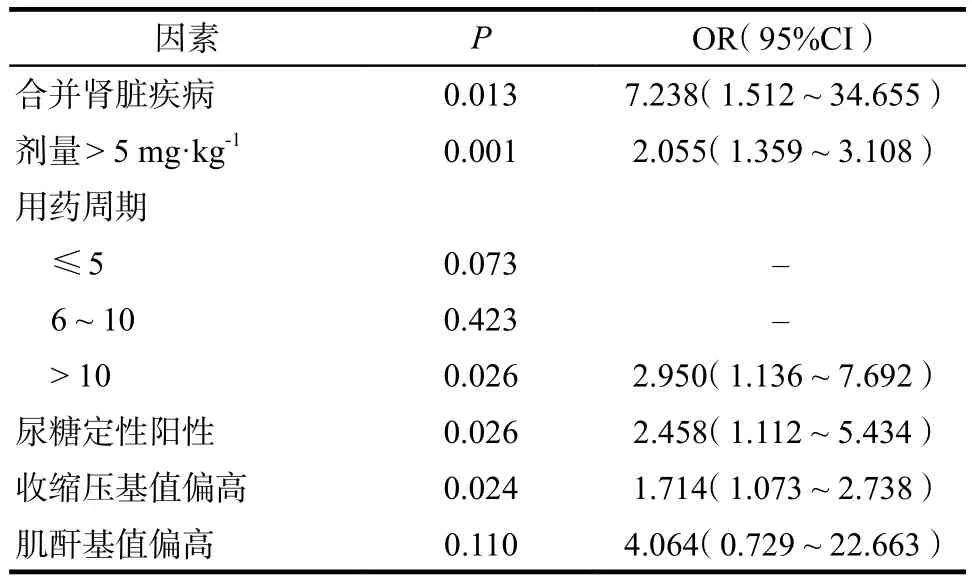
表4 多因素逻辑回归分析结果Tab 4 Results of multivariate Logistic regression analysis
3 讨论
3.1 贝伐珠单抗相关蛋白尿的发生率
尿蛋白可导致肾脏疾病持续进展,是肾小球或肾小管损伤的重要标志[10-11],也是肾功能持续恶化的独立危险因素[12]。持续性的蛋白尿可以引起肾脏损害,如血浆蛋白通过肾小球滤过膜进入肾小球Bowman囊,引起肾小球高灌注、高滤过、高压,导致肾小球硬化;肾小管重吸收蛋白过量,引起蛋白在肾小管上皮细胞沉积,导致肾小管损伤[13-14]。蛋白尿是贝伐珠单抗典型的不良反应之一[15],文献报道联合应用贝伐珠单抗相比于单纯化疗可显著增加肿瘤患者发生蛋白尿的概率[16],其发生率也在多项研究中被报道。
一项Meta分析对72项已发表的临床试验进行综合分析,其中贝伐珠单抗组21 902例,对照组20 608例,所有等级和高级别的蛋白尿的发病率分别为18.0%和2.4%[17]。美国肾脏病学会杂志发表的一项涉及16项研究数据,12 268名肿瘤患者的研究显示,贝伐珠单抗致3 ~ 4级蛋白尿的发生率为2.2%。与单纯化疗相比,贝伐珠单抗联合化疗可显著增加重度蛋白尿和肾病综合征的风险。就肿瘤类型而言,肾细胞癌的风险最高,累积发病率可达10.2%[18]。说明书显示贝伐珠单抗致蛋白尿的发生率为“十分常见”,临床试验结果显示其发生率为0.7% ~ 38.0%,其中3级蛋白尿的发生率为8.1%,4级蛋白尿(肾病综合征)的发生率为1.4%。这与本研究结果基本一致。提示临床应用贝伐珠单抗时应注意监测尿蛋白,出现蛋白尿后及时干预以防出现更加严重的后果。
3.2 预防贝伐珠单抗相关蛋白尿的临床用药注意事项
VEGF信号通路抑制剂导致的蛋白尿多为无症状蛋白尿[19],但也有少数患者会出现以血栓性微血管病变为特征的严重的肾功能损伤[20],因此在临床使用时应对可能的风险因素进行有效规避。本研究显示,合并肾脏疾病是贝伐珠单抗致尿蛋白阳性的高风险因素。这可能是由于患者在用药前已经出现了肾脏功能异常,而贝伐珠单抗拮抗了VEGF对内皮细胞的保护作用,导致肾小球滤过膜通透性增高,肾小球滤液中的蛋白质增多,超过肾小管重吸收能力,从而引起肾小管功能障碍,重吸收能力减弱,最终导致蛋白尿[21]。同时,单次使用剂量> 5 mg·kg-1(OR = 2.055,95%CI:1.359 ~ 3.108)及使用贝伐珠单抗周期数>10(OR = 2.950,95%CI:1.136 ~ 7.692),也增加了贝伐珠单抗致蛋白尿的发生风险,这与以往文献报道[22]中的“贝伐珠单抗致蛋白尿呈剂量依赖性”基本一致。提示临床用药时应注意慎用高剂量。本研究中,用药前收缩压偏高也是风险因素之一,已有研究表明[19],贝伐珠单抗引起的蛋白尿与其引起的高血压相关,且收缩压> 135 mm Hg是蛋白尿发生的危险因素[23],这可能提示收缩压轻度升高也会促使蛋白尿产生。因此,在接受贝伐珠单抗治疗之前,应详细询问患者的高血压、糖尿病、慢性肾病等既往病史并检测尿蛋白。若尿蛋白水平大于2+,应进行24 h尿蛋白监测;若尿蛋白水平≥ 2 g·24 h-1,则停止治疗,待尿蛋白水平下降后再恢复用药;若达到肾病综合征水平(尿蛋白≥ 3.5 g·24 h-1),则禁用[24]。
3.3 自动监测软件在真实世界药物评价中的应用
近年来,国家卫生健康委员会不断推进药物使用监测和临床综合评价工作,鼓励应用信息化智能化方法监测药物使用情况。本团队借助ADE-ASAS-Ⅱ与HIS数据库对接,已完成数十项大样本用药人群的真实世界研究(real world study,RWS)[25-26]。本研究基于ADE-ASAS-Ⅱ中“药源性肝损伤”、“过敏反应”、“药源性急性肾损伤”、“中性粒细胞减少”等成熟模块及相关多项大样本真实世界研究实践,首次构建了“蛋白尿”模块并用于真实世界监测研究,进一步拓展了ADE-ASAS-Ⅱ的自动监测领域和功能。该模块采用触发器原理,通过系统与HIS数据库的对接,提取住院患者尿蛋白定性实验结果,并利用人工智能技术进行后台自动比对,预警可疑阳性病例,从而为研究者后期人工评价甄别减免了大量初期的信息筛查与数据分析工作。该模块经过先1159例、后1932例不同样本量监测结果(发生率分别为18.46%、18.27%;报警阳性率分别为38.08%、40.90%)显示,模块的稳定性好,监测速度快,切实拓展了ADE-ASAS-Ⅱ的监测功能与应用领域。
