顺铂诱导急性肾损伤差异基因的分析和鉴定
2022-05-12韦肖娜吴剑平张瑞李佳佳甘言刚杨琼琼
韦肖娜 吴剑平 张瑞 李佳佳 甘言刚 杨琼琼
急性肾损伤(AKI)是一项严重危害人类健康的全球性公共卫生问题[1]。目前,肿瘤的发病率逐年上升,化疗药物引起的AKI 已经成为临床上亟待解决的突出问题[2]。顺铂(Cis)是目前最常用的化疗药物之一,因其严重的不良副作用包括肾毒性、神经毒性及耳毒性,其临床使用受到限制[3]。目前临床尚无针对顺铂诱导AKI(Cis-AKI)的有效治疗药物。因此,积极探索Cis-AKI 的发病机制,开发针对性治疗药物已成为Cis-AKI 防治的重要手段。生物信息学分析已被广泛用于探索一系列疾病的机制。为深入了解Cis-AKI 发病机制及治疗Cis-AKI 的治疗药物靶点,我们从公共基因表达数据库(GEO)中选取了大鼠Cis-AKI 的微阵列测序数据集进行生物信息学分析,筛选Cis-AKI发生发展的关键调控基因,为加深Cis-AKI 发病机制的理解和提供潜在的治疗靶点提供理论依据。
1 材料与方法
1.1 数据集从GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)筛选Cis-AKI 的微阵列测序数据集GSE85957。GSE85957 数据集来源于Cis-AKI 的大鼠肾脏的微阵列测序数据集,其中疾病组和对照组各5 例。使用GPL1355 平台对数据集进行注释。
1.2 差异基因的筛选在R 软件中使用limma 包分析Cis-AKI 组与对照组的差异基因(DEGs),DEGs 定义为校正后的P值<0.05 和∣logFC| ≥1。使用ggplot 包和heatmap 包绘制差异基因的聚类热图。
1.3 GO 和KEGG 通路富集分析使用DAVID在 线 数 据 库(https://david.ncifcrf.gov/home.jsp)对DEGs 进行基因的本体论(GO)分析和京都基因与基因组百科全书(KEGG)富集分析。
1.4 PPI 网络建设与模块分析使用STRING 数据库(版本11.0)构建蛋白质互作(Protein-Protein Interaction Networks,PPI)网络。所需置信度(综合得分)>0.4 是本研究中PPI 网络的阈值。Cytoscape用于可视化PPI 网络。使用默认参数(degree cutoff=2、node score cutoff=2、K -core=2、max depth=100)的Molecular Complex Detection(MCODE)模块和CytoHubba 模块来筛选PPI 网络中的关键基因。
2 结 果
2.1 差异表达基因的筛选从GEO 数据库中下载GSE85957 的原始数据,进行背景校正和数据标准化,使用limma 包进行DEGs 分析。与对照组相比,Cis-AKI 组共有119 个DEGs,其中上调的有57个基因,下调的有62 个基因。采用层次聚类方法,根据不同样本中差异基因的表达值对样本和基因进行聚类,并通过热图显示不同基因在不同样本中的表达情况(图1)。

图1 Cis-AKI 肾组织和对照组织之间的差异基因表达
2.2 DEGs 的GO 和KEGG 通路富集分析通过线数据库DAVID 对DEGs 进行GO 和KEGG 富集分析。GO 分析分为三个功能组,包括生物过程、细胞成分组成和分子功能。DEGs 的GO 和KEGG 富集分析的结果如图2 所示。在生物过程组中,119 个DEGs 主要富集于细胞RNA 聚合酶II启动子转录的正调控、对药物的反应、对刺激的反应、昼夜节律、转录正调控、凋亡过程的调控和细胞周期的调节等。在细胞成分组中,119 个DEGs主要富集在细胞质、细胞核、胞内膜界细胞器和RNA 聚合酶II 转录因子复合物等。在分子功能组中,119 个DEGs 主要富集在蛋白质结合、DNA 结合、转录激活因子活性、转录调控区序列特异性DNA 结合和泛素蛋白连接酶结合等。KEGG 富集通路分析结果显示DEGs 主要富集在癌症中的微小RNA、昼夜节律、细胞周期、多巴胺能突触、FoxO信号通路、泛素介导的蛋白水解和RIG-I 样受体信号通路。
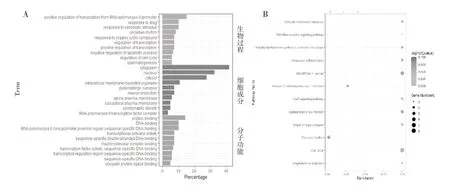
图2 119 个DEGs 的GO(排名前10 个类目)分析(A)和KEGG 富集通路分析(B)
2.3 PPI 网络建设与模块分析为进一步寻找这些差异基因中的关键基因。我们基于STRING 数据库,在Cytoscape 软件中构建了119 个DEGs 的PPI 网络(图3A)。亚网络分析得到了5 组基于PPI网络MCODE 的显着模块网络(图3B-F)。其中模块1(图3B)、模块2(图3C)和模块3(图3D)中富集到的关键基因最多。
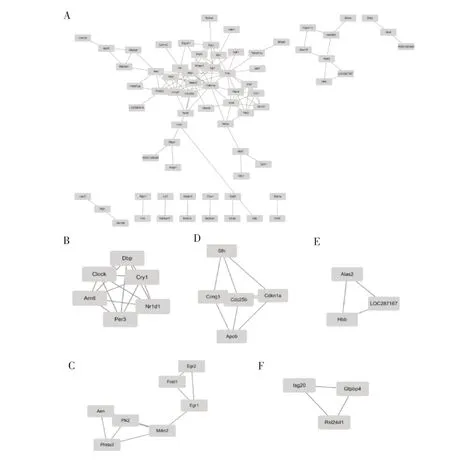
图3A 所有DEGs 的PPI 网络,得分>0.4。每个节点代表一个基因或蛋白质,边缘代表节点之间的相互作用.B-FMCODE 选择的5 个重要模块的PPI 网络。
2.4 关键差异基因的鉴定进一步通过结合Cyto-Hubba 模块给每个差异基因赋值,定义排名前10 的差异基因为关键差异基因。这些关键差异基因包括Apoptosis enhancing nuclease(AEN)、Aryl hydrocarbon receptor nuclear translocator-like(ARNTL)、BTG anti-proliferation factor 2(Btg2)、Cyclin G1(CCNG1)、cryptochrome circadian regulator 1(CRY1)、clock circadian regulator(Clock)、D-box binding PAR bZIP transcription factor(DBP)、Fos proto-oncogene(FOS)、nuclear receptor subfamily 1,group D,member 1(NR1D1)和Period circadian regulator 3(PER3)(表3)。基 于Cytoscape 中 的GeneMANIA 插件构建和可视化关键差异基因的PPI 网络(图4)。该网络显示,这些关键差异基因之间存在强烈的相互作用,它们的相互作用可能对CisAKI 的病理生理过程产生影响。这10 个关键差异基因主要富集在p53 信号通路、细胞周期和昼夜节律。
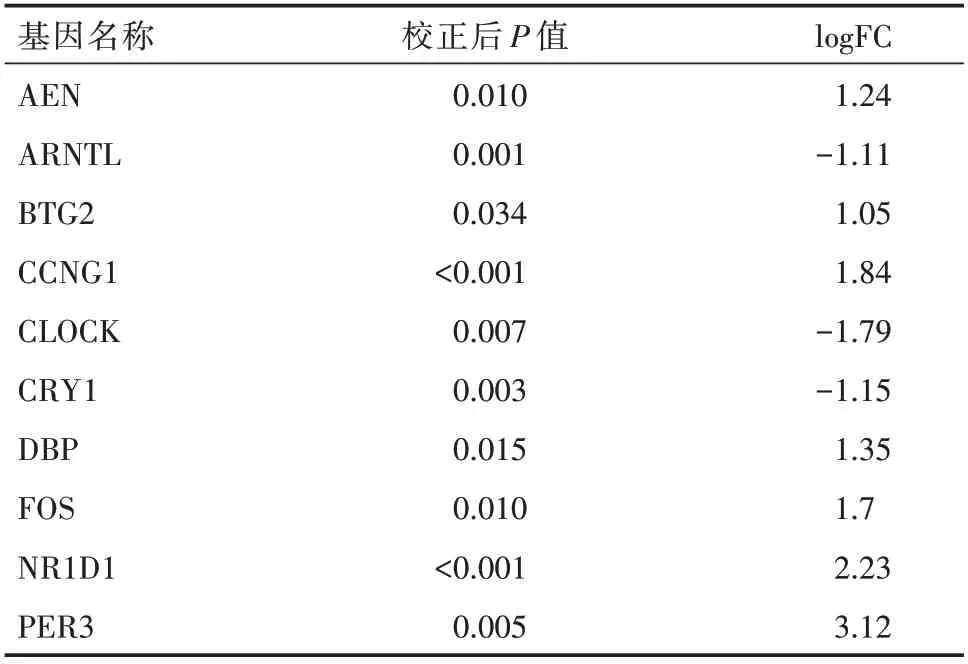
表3 GSE85957 数据集DEGs 关键差异基因的表达情况
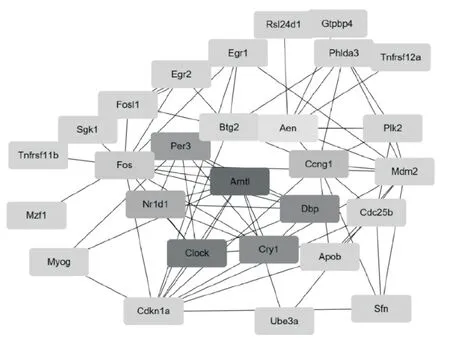
图4 10 个关键差异基因的PPI 网络(灰度深浅代表得分的高低)
3 讨 论
3.1 Cis-AKI 概述AKI 是一项高发病率、死亡率的全球公共卫生问题[1]。AKI 的病理生理学非常复杂,但其主要病因是脓毒血症、缺血和肾毒性。肾毒性主要与药物的使用有关。顺铂是最常见的肾毒性药物和最广泛使用的铂类药物之一,顺铂主要用于各种实体肿瘤(宫颈癌、食道癌、膀胱癌、小细胞肺癌和睾丸癌)的化疗,是迄今为止使用的最有效化学疗法之一[3]。随着肿瘤发病率的逐年升高,Cis-AKI 发病率居高不下[2]。然而,Cis-AKI的目前尚无针对性的治疗措施。因此,积极探索Cis-AKI 的发病机制,开发针对性治疗药物已经成为Cis-AKI 防治的重要手段,也将为Cis-AKI 的发病机制提供新思路。目前,测序技术已被广泛用于探索Cis-AKI 的发病机制、诊断和潜在的治疗靶点。在本研究中,通过选取GEO 中的Cis-AKI 数据集GSE85957 进行差异基因分析,聚类热图显示了57 个上调和62 个下调的DEGs。在对DEGs 的GO 和KEGG 通路富集分析表明,在Cis-AKI 发病过程中,许多参与细胞周期、昼夜节律、FoxO 信号通路和泛素介导的蛋白水解等细胞通路的基因被激活。细胞周期和FoxO 信号通路在AKI 的发病机制中具有重要的作用已有报道。而昼夜节律信号通路在AKI 中的作用目前尚未有报道。
3.2 p53 信号通路基因与Cis-AKI为寻找DEGs中的关键差异基因,对这119 个DEGs 进行了PPI网络分析,得分>0.4(图3)。进一步子网络分析发现5 个重要模块(图3)和PPI 网络中排名前10位的关键基因(图4)。这10 个关键差异基因在Cis-AKI 过程中可能非常重要,可用于Cis-AKI 的发病机制的探索。在关键差异基因中,AEN、BTG2、和CCNG1 是p53 信号通路和细胞周期蛋白。p53 信号通路基因和细胞周期蛋白在Cis-AKI的发病机制中和Cis-AKI 后期的肾脏修复中有着重要作用,有望成为Cis-AKI 潜在的治疗靶点。AEN 即细胞凋亡增强核酸酶,是p53 下游的靶基因,AEN 的表达受p53 的磷酸化状态的调节。研究表明,AEN 是p53 在细胞凋亡诱导中的重要下游介质,是p53 依赖性细胞凋亡中所必需的[4]。BTG2 是一种p53 诱导基因,通过调节细胞周期进程、细胞凋亡和细胞分化发挥其抗增殖作用。Zhang 等人的研究表明,BTG2 表达较高的肾移植患者标本中表现出较差的同种异体移植物存活率,这表明BTG2 可能参与了肾移植后缺血再灌注损伤的发病机制[5]。CCNG1 即细胞周期蛋白G1,是细胞周期蛋白家族的成员,参与DNA 损伤反应。Canaud 等人的研究发现CCNG1 调节近端肾小管细胞中的G2 /M 阻滞,促进纤维化和肾脏疾病进展[6]。然而,AEN、BTG2、和CCNG1 在Cis-AKI中的作用尚未有报道,这些关键差异基因在Cis-AKI 中的机制需要进一步去探索。
3.3 昼夜节律与Cis-AKI在关键差异基因中,ARNTL、PER3、CRY1、NR1D1 和CLOCK 是昼夜节律的相关基因。肾脏本身具有生理性昼夜节律模式,如尿钠、钾、氯化物和磷酸盐以昼夜节律模式排出,尿量和pH 值也发生相应变化。Hall 等人揭示了调节昼夜节律的分子机制,并获得2017 年诺贝尔生理学或医学奖。事实上,昼夜节律调节涉及大多数生物过程,并与人类健康和疾病密切相关。然而,昼夜节律相关基因在Cis-AKI 中的作用未有报道。昼夜节律紊乱与慢性肾脏病(Chronic kidney disease,CKD)发病有着密切的关联。流行病学研究表明,慢性昼夜节律紊乱,是包括癌症和心血管疾病在内的许多疾病的高危因素[7]。长期昼夜节律紊乱会导致患CKD 和高血压的风险增加[7]。昼夜节律CLOCK 蛋白基因缺失的小鼠比野生型小鼠更容易患腺嘌呤诱导的CKD[8]。Mishra等人同样也发现了在狼疮肾炎(Lupus nephritis,LN)发病小鼠和未发病小鼠中,生物钟相关基因和蛋白质的肾脏表达存在显着差异。与LN 发病鼠相比,未发病小鼠的肾脏表现出正常的ARNTL、CLOCK、PER 和CRY 基因表达的昼夜节律模式。与未发病小鼠相比,LN 发病小鼠在不同时间点的ARNTL 蛋白表达也显着降低[9]。本研究结果提示昼夜节律相关基因在Cis-AKI 的发生发展中可能起到关键作用。昼夜节律相关基因在Cis-AKI 中的作用机制仍需进一步的研究。FOS 是细胞增殖、分化和转化的调节剂。FOS 基因的表达也与凋亡细胞死亡有关。据报道,FOS 蛋白抑制剂T-5224 可以抑制LPS 引起的AKI[10],提示着FOS 有望成为AKI 潜在的治疗靶点,这与本研究结果相一致。
综上所述,本研究结果表明ARNTL、CLOCK、CRY1、DBP、PER3、NR1D1、CCNG1、FOS、BTG2 和AEN 等基因可能是Cis-AKI 发病机制中的关键基因及潜在治疗干预靶点,但需要进一步的研究及验证。然而,我们目前的研究仍然存在一些局限性。缺乏人体肾脏组织样本数据进行验证,关键基因在Cis-AKI 中的功能和机制有待进一步实验验证。
