关于识别60 岁以下急性心肌梗死患者潜在致病基因的研究
2022-05-12黄泳清陈颖温可馨周淑娴耿登峰
黄泳清 陈颖 温可馨 周淑娴 耿登峰
急性心肌梗死(AMI)是危害人类生命的重要疾病之一,其发病年轻化趋势日渐严重,对其早期诊治的研究尤为重要。因此,近年来应用生物信息学方法在Gene Expression Omnibus(GEO)数据库中下载基因芯片进行分析以挖掘AMI 新的诊断和治疗靶点的研究逐渐增多然而,针对发生在特定年龄的AMI 特殊机制的研究较少,60 岁以下患者发生AMI 的核心基因和调控因子尚无报道,因此,本研究应用生物信息学方法在GEO 中提取数据并分析60 岁以下AMI 潜在的治疗及药物靶点,为其早期诊断及治疗提供重要的理论依据。
1 材料和方法
1.1 数据的下载和初步分析在GEO 数据库下载GSE34198 基因芯片,利用在线工具GEO2R 对差异表达基因进行预处理,根据P<0.05 和| logFC | >0筛选差异基因。
1.2 差异基因的GO 和KEGG 通路分析基因本体论(GO)是一种常见的功能富集分析,包括分子功能、生物过程和细胞组成。KEGG 是一个被广泛使用的数据库,它存储了大量关于基因组、生物途径、疾病、化学物质和药物的通路数据。采用DAVID 进行通路富集分析。
1.3 PPI 网络的构建与核心基因鉴定STRING数据库通过评估差异基因间的蛋白互作关系进一步评估差异基因间的关系。提取出总分大于0.4的PPI 对。随后使用Cytoscape 软件对PPI 网络进行可视化。节点连通性越高对维护整个网络的稳定性就越重要。在本研究中,连通性排名前10 位的基因被确定为核心基因。
1.4 检索已知AMI 易感基因和保护基因孟德尔遗传数据库(OMIM)是一个不断更新的人类孟德尔遗传疾病数据库,提供全面、权威的疾病相关遗传变异信息概述。根据急性心肌梗死的关键词,根据不同的发病机制搜索相关易感基因并进行分类。
1.5 已知驱动基因的PPI 网络分析分析10 个已筛选出的核心基因和已知AMI 易感基因之间的蛋白互作网络,以确定在年龄小于60 岁的患者中更可靠的核心基因。
1.6 伦理审查该研究经中山大学孙逸仙纪念医院伦理委员会批准(SYSEC-KY-KS-2022-081),患者均由原始数据来源签署知情同意书。
2 结 果
2.1 差异基因的筛选人群资料见表1;筛选出1085 个差异基因,其中上调基因570 个,下调基因515 个。

表1 微阵列数据库的基线特征的比较
注:与对照组比较,*P<0.05,AMI,Acute myocardial infarction,急性心肌梗死。
2.2 差异基因的功能富集分析GO 功能富集分析结果和KEGG 通路分析结果如表2。
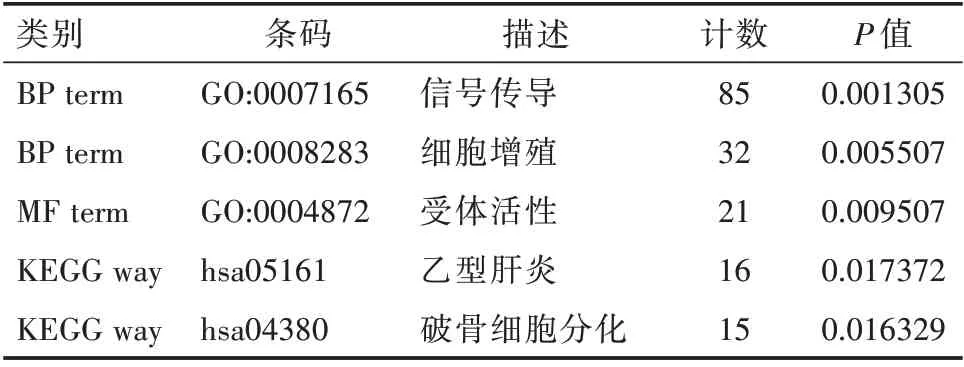
表2 GO 功能富集分析和KEGG 通路分析
2.3 PPI 网络的构建与核心基因鉴定结果如图1。
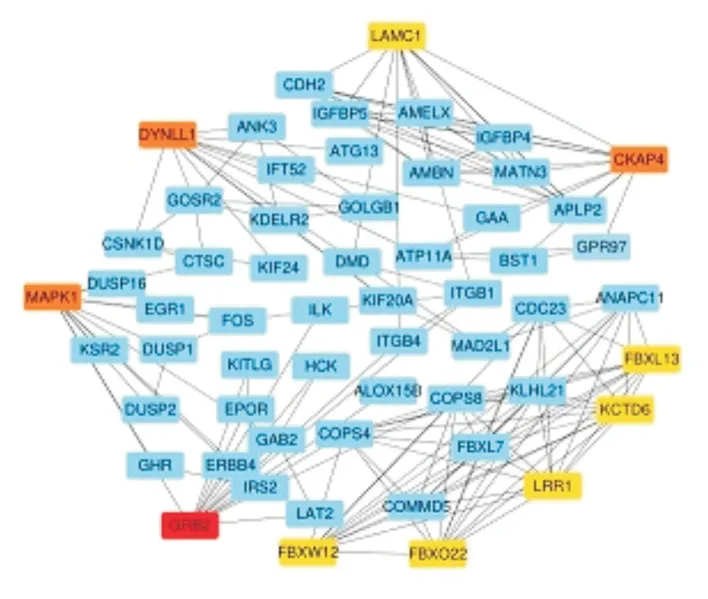
图1 根据差异基因的蛋白互相作用网络之间的连接度,筛选出10 个核心基因,其中红色标记为上调基因,黄色标记为下调基因。
2.4 核心基因与AMI 已知易感基因的相互作用在OMIM 数据库中,共发现51 个已知AMI 驱动基因和3 个保护基因。核心基因与易感基因的相互作用关系如图2。
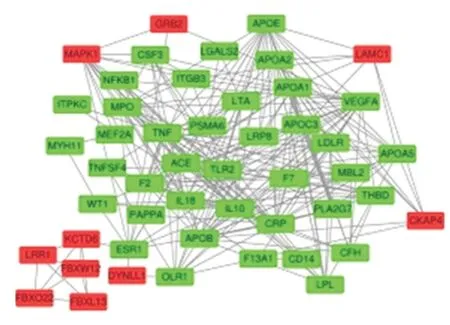
图2 10 个核心基因与已知AMI 易感基因相关性的蛋白质-蛋白质相互作用(红色是核心基因,绿色是易感基因)。
3 讨 论
急性心肌梗死(AMI)是威胁人类生命的重大心血管急症。由于有效治疗时间较短和心肌的不可再生,AMI 预后较差。虽然已有挖掘AMI 诊治相关的生物标志物的研究,但对60 岁以下发生AMI 患者的核心基因和机制至今仍不清楚。
既往研究报导多种信号转导通路可促进AMI的发生发展,AMI 引发的心肌纤维化与心肌细胞坏死、心肌间质细胞增生、成纤维细胞异常增殖有关[1],本研究结果提示信号转导和细胞增殖是60岁以下AMI 患者重要的生物过程之一。
乙型肝炎是本研究中相关度最高的关键通路。既往研究表明,乙型肝炎病毒感染可产生高氧化应激状态,干扰素诱导蛋白-10 和血清可溶性尿激酶纤溶酶原激活物受体的上调可促进血小板激活,增加动脉粥样硬化血栓形成风险[2]。Yang Y 等的基因芯片分析显示破骨细胞分化和B 细胞受体信号通路是AMI 的关键通路[3]。但在该研究中,这些通路被下调了,与我们的研究相悖。我们推测乙型肝炎和破骨细胞通路是年龄小于60 岁的AMI 发病的关键通路,但破骨细胞分化的作用仍待进一步研究。
两个PPI 分析提示MAPK1、CKAP4 和GRB2 是与AMI 已知易感基因相关的核心上调基因。编码增殖蛋白激酶1(MAPK1),也称为细胞外信号调节 激 酶(ERK)2。 研 究 表 明,IL- 17A 通 过p38MAPK/ERK1/2 途径诱导巨噬细胞浸润并激活NLRP3,加重AMI 的炎症反应[4]。Lorenz 等的人体实验表明ERK1/ERK2 的特定磷酸化事件通过整合不同的上游信号诱导衰竭心脏的心肌肥大[5]。本研究结果也提示AMI 已知易感基因中与炎症和免疫、脂代谢和凝血功能相关者都与MAPK1 有关。因此,我们推测MAPK1 可能通过影响炎症、脂代谢和凝血功能参与低于60 岁AMI 的发生发展,并通过促进心肌肥大影响其预后。
编码细胞骨架相关蛋白4(CKAP4)是一种稳定的跨膜蛋白。关于CKAP4 对心血管疾病作用的研究很少,但其在癌症中的重要作用已得到证实。Kimura,H.等报道,来自DKK1/CKAP4 的信号通过PI3K/AKT 途径促进正常细胞和癌细胞增殖[6]本研究结果提示CKAP4 表达上调,并与已知的调节AMI 脂代谢的易感基因有关。因此,我们推测CKAP4 在细胞增殖、信号转导和脂质代谢方面的作用可能促进60 岁以下AMI 的发生。
另一个与已知AMI 易感基因相关的核心上调基因是编码生长因子受体结合蛋白-2(GRB2)。Zhang,S.等对Grb2+/-压力过载模型小鼠的研究提示GRB2 与免疫调节、心肌细胞生长和心肌纤维化密切相关[7]。本研究表明GRB2 与AMI 免疫相关易感基因ESR1 有关。推测GRB2 可能通过免疫调节心肌细胞生长和心肌纤维化影响AMI 的发生和预后。此外,有研究表明GRB2 通过稳定免疫受体酪氨酸激活基序信号中的LAT 信号体在血小板止血和血栓形成中发挥重要作用[8]。GRB2 可能是抗血小板治疗的靶基因。
综上,乙型肝炎和破骨细胞分化是60 岁以下AMI 的主要上调通路,MAPK1 和CKAP4 可能通过炎症反应机制促进AMI 的发生发展,可作为潜在的诊断标志物。MAPK1 和CRB2 在促进心肌肥大、心肌细胞生长、纤维化、免疫调节和抗血小板等方面可能是潜在的药物靶点。
