miR-1285通过YAP对慢性粒细胞白血病K562细胞增殖、凋亡的影响及其作用机制
2022-05-12张红霞吴广胜
张红霞,吴广胜
慢性粒细胞性白血病(chronic myeloid leukemia, CML)是一种骨髓增生性肿瘤,酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI)作为CML治疗的临床一线用药,仍有许多患者对TKIs发生耐药[1]。CML与Wnt、Notch、Hippo等信号通路的失调相关[2]。转录共激活因子Yes相关蛋白1(Yes-associated protein 1, YAP1)是Hippo信号通路中的癌基因,在肿瘤发生中起着重要的作用[3]。YAP参与了癌症恶性行为的维持[4-6],有研究[7]显示抑制YAP的表达,CML细胞生长减慢增加药物的敏感性,另有研究[8]表明YAP的磷酸化水平与CML细胞生长成正比。
近年来微小RNA(microRNA,miRNA)在调控基因表达、肿瘤发生及发展发挥了重要作用[9]。miR-1285,也称为miR-1285-1,miR-1285-3p,位于7q21-q22中[10]。miR-1285在多种癌症中发挥抑癌作用[11],而在CML中的作用尚不清楚。CML中许多microRNA处于失衡状态,多项研究[12]证明这些microRNA在调节白血病细胞的增殖、侵袭和转移方面发挥了重要作用,但是否会作用于YAP这条通路尚无有力证据。因此该研究主要侧重于miR-1285通过靶向YAP对慢性粒细胞白血病K562细胞的增殖、凋亡以及对其作用机制的初步探讨。
1 材料与方法
1.1 主要试剂RNA提取试剂盒、反转录试剂盒、SYBR Green试剂盒(Thermo Fisher公司),CCK8检测试剂盒、细胞凋亡检测试剂盒(Abcam公司),RIPA细胞裂液(BOSTER公司),1%青链霉素、10%胎牛血清(Gibco公司),质粒(上海Genepharma公司),具体序列见表1。

表1 质粒序列
1.2 K562细胞的制备慢性粒细胞白血病K562细胞购于武汉普诺赛公司,使用含1%青链霉素10%胎牛血清的DMEM培养基培养,于37 ℃含有5%CO2的细胞培养箱中培养,每隔24 h进行更换培养基处理并1 ∶2传代。选择对数期生长的细胞进行下一步实验细胞。质粒的转染使用Lippofectamine 3000作为载体。
1.3 CCK-8法检测K562细胞增殖情况按5×105/ml密度将K562细胞种植在24孔板中并设置空白组,培养12 h后,每组设置3个对照组,将质粒与K562细胞共培养48 h与72 h后,每孔加入25 μl CCK-8试剂,避光,37 ℃条件中孵育1.5 h,测定酶标仪在450 nm吸光度时的吸光度(A)值,以此来计算细胞的增殖率。计算方法:增殖率=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.4 流式细胞仪检测K562细胞凋亡情况按5×105/ml密度将K562细胞种植在6孔板中,按照1.3项处理后的K562细胞使用预冷的PBS冲洗干净后,加入胰酶消化后收集细胞,离心获得沉淀,使用PBS重悬细胞后分装,分别加入PI和Annexin V-FITC抗体后,设置对照组,避光情况下上机检测。
1.5 实时荧光定量PCR检测K562细胞中miR-1285的表达水平按照1.3项处理后的K562细胞,TRIzol法提取细胞中总RNA,调平后逆转录成cDNA,反应条件:37 ℃ 2 min,42 ℃ 60 min,70 ℃ 5 min,4 ℃ 保存。将所得cDNA进行实时荧光定量PCR,所用PCR引物序列见表1。扩增条件为:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 30 s,循环次数40次。使用2-ΔΔCt计算公式得出mRNA的表达量。
1.6 Western blot法测定蛋白表达量按照1.3项处理后的K562细胞加入RIPA细胞裂解液,获取K562细胞中总蛋白样品,用BCA法检测上样蛋白浓度,调整蛋白浓度后使各组浓度一致,然后使用SDS-聚丙烯酰胺凝胶电泳的方法分离蛋白并转移至PVDF膜,加入兔抗鼠单克隆抗体YAP、P-EGFR、EGFR、BAX、Bcl-2、GAPDH(稀释比1 ∶800)于4 ℃条件下孵育24 h后,充分去除一抗并于常温条件下加入山羊抗兔二抗(稀释比1 ∶20 000)孵育2 h,化学发光法检测各分子的蛋白表达情况,使用Image J软件处理灰度值并计算相对蛋白表达量。

2 结果
2.1 转染质粒后K562细胞内miR-1285 mRNA的表达量在转染后48 h检测细胞内miR-1285的表达量,与mimics control组比较,miR-1285 mimics组表达升高,与inhibitor control组比较,miR-1285 inhibitor组表达下降(P<0.05)。而mimics control组与inhibitor control组比较,差异无统计学意义(P>0.05),见图1。

图1 不同处理组miR-1285表达情况A:mimics组;B:mimics control组;C:inhibitor组;D:inhibitor control组;与mimics control组比较:*P<0.05;与inhibitor control组比较:#P<0.05
2.2 过表达miR-1285后抑制K562细胞增殖转染质粒48 h,与miR-1285 inhibitor组比较,miR-1285 inhibitor组、mimics control组、inhibitor control组均可促进K562细胞增殖(P<0.05);而通过过表达miR-1285,miR-1285 mimics组较mimics control组增殖减弱,差异有统计学意义(P<0.05)。在相同的培养环境下,miR-1285 inhibitor组细胞增殖明显高于inhibitor control组(P<0.05),见图2。

图2 不同处理组K562细胞增殖情况A:mimics组;B:mimics control组;C:inhibitor组;D:inhibitor control组;与mimics control组比较:*P<0.05;与inhibitor control组比较:#P<0.05
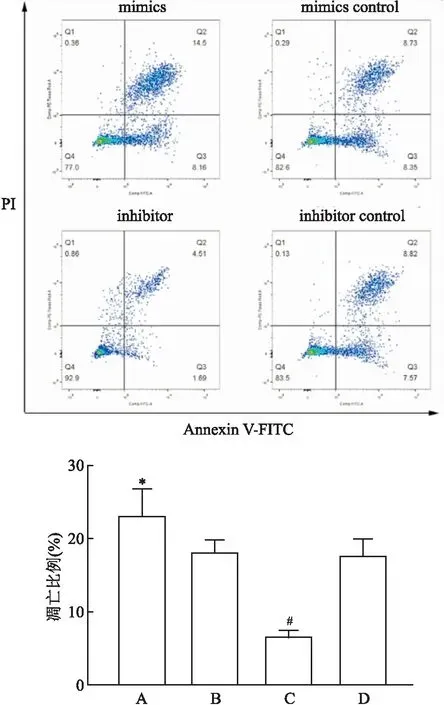
图3 不同处理组K562细胞凋亡情况A:mimics组;B:mimics control组;C:inhibitor组;D:inhibitor control组;与mimics control组比较:*P<0.05;与inhibitor control组比较:#P<0.05
2.4 凋亡相关分子BAX、Bcl-2的蛋白表达Western blot结果显示,与mimics control组比较,mimics组BAX升高,而Bcl-2降低,差异有统计学意义(P<0.05);而与inhibitor control组比较,miR-1285 inhibitor组的BAX表达降低,而Bcl-2表达升高,差异有统计学意义(P<0.05)。见图4。

图4 不同处理组K562凋亡相关蛋白BAX、Bcl-2表达情况A:mimics组;B:mimics control组;C:inhibitor组;D:inhibitor control组;与mimics control组比较:*P<0.05;与inhibitor control组比较:#P<0.05
2.5 YAP及EGFR下游相关分子的蛋白表达Western blot结果显示,过表达miR-1285后,YAP的表达下降,而敲低miR-1285会使YAP的表达上升;与mimics control组比较,miR-1285 mimics组的YAP、P-EGFR表达量下降,差异有统计学意义(P<0.05)。与inhibitor control组比较,miR-1285 inhibitor组的YAP、P-EGFR表达量升高,差异有统计学意义(P<0.05)。各组之间EGFR未见明显变化,见图5。
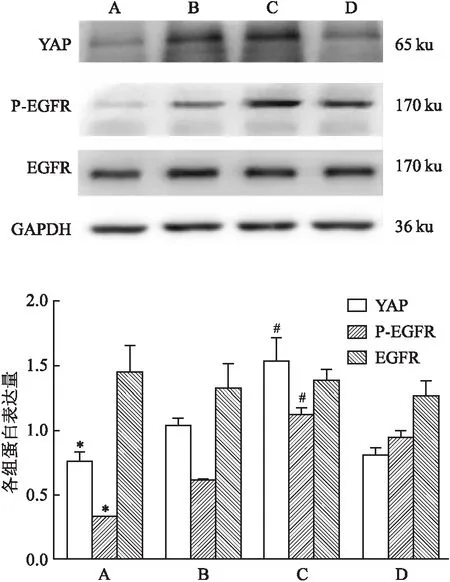
图5 不同处理组K562细胞中YAP、EGFR、P-EGFR的表达情况A:mimics组;B:mimics control组;C:inhibitor组;D:inhibitor control组;与mimics control组比较:*P<0.05;与inhibitor control组比较:#P<0.05
3 讨论
近年来关于microRNA的研究逐渐增多,其中在抑制肿瘤方面有较多发现。有研究[13]显示在CML中使用YAP抑制剂维替泊芬可抑制其凋亡,促进增殖。本研究显示使用miR-1285质粒后,使miR-1285表达增加时,K562细胞增殖减弱,而凋亡增加;相同条件下使miR-1285下调后,K562细胞出现增殖明显而抑制凋亡。这与Huang et al[14]在胰腺癌中发现miR-1285过表达后其抑制恶性生物学行为,可能是抑制了YAP的表达;而使miR-1285降低时,可得到相反的结果。
通过过表达或敲低miR-1285,可以观察到K562细胞中miR-1285表达升高及降低,与对照组相比,差异有统计学意义,证明可有效建立细胞模型。当过表达miR-1285后,与inhibitor组相比,K562细胞凋亡增加,而使miR-1285表达降低时,细胞凋亡降低,可能是由于过表达miR-1285后可抑制YAP的表达从而使K562细胞增殖减弱,进而凋亡增加,当使miR-1285表达降低后对YAP的抑制作用减弱,YAP表达增加,促进K562细胞的增殖,抑制凋亡。这与相关研究[13]结果一致。CCK-8法检测结果显示,过表达miR-1285后,K562细胞增殖减弱,而敲低miR-1285后,可促进miR-1285的增殖,增殖结果与流式结果相一致;其原因也与上述一致,可能是由于抑制或促进YAP的表达进而影响了K562细胞的增殖。
对凋亡相关分子BAX与Bcl-2进行测定,结果显示mimics组BAX表达量升高,且明显高于其余三组,差异有统计学意义;当抑制miR-1285后,BAX的表达量较对照组下降,明显低于mimics组;而与之对应的促增殖因子Bcl-2在mimics组中表达明显低于三组,而在inhibitor组中Bcl-2表达高于其余三组,差异均有统计学意义;说明miR-1286可通过一系列信号通路作用于K562细胞的线粒体通路从而影响增殖与凋亡,过表达miR-1285后,细胞增殖能力减弱,可能是因为抑制了Bcl-2而促进BAX的表达,通过线粒体通路来影响细胞增殖情况。而敲低miR-1285后,这种抑制作用减弱,对线粒体凋亡通路影响较小,因此促进细胞增殖。然而这种是通过何种机制来发挥作用的不得而知。
有研究[15]显示miR-1285可通过YAP信号通路可调控卵巢癌的增殖、侵袭及转移。而另有一项研究[7]证明YAP抑制剂可作用于K562细胞介导Hippo信号通路抑制增殖、促进凋亡。miRNA在CML中的研究较少,但YAP对CML的作用已有大量研究[16]证实,因此笔者猜想miR-1285是否也能作用于YAP进而影响K562细胞的生物学行为,对增殖、凋亡有何影响。本研究结果显示使miR-1285过表达后可抑制YAP的表达,通过对下游分子检测P-EGFR表达也下降,而非磷酸化的EGFR未见明显变化;当使miR-1285敲低后,这种抑制作用会减弱,相比对照组YAP的表达升高,下游分子P-EGFR的表达随之升高,而相应的非磷酸化EGFR表达不变,发生这种情况的原因可能是由于miR-1285作用于YAP使表达降低,进而抑制对下游分子的激活作用,使下游分子呈现出非磷酸化,而使miR-1285表达降低后,这种抑制作用会降低,影响其他分子对YAP的抑制作用,使YAP表达升高,再通过一系列信号通路影响K562细胞的线粒体凋亡通路,抑制BAX的表达,使Bcl-2的表达升高,促进增殖,抑制凋亡。
综上所述,YAP的表达异常参与了多种肿瘤细胞及血液系统疾病的生物学行为进程,与疾病的预后和转归均密切相关。miR-1285又可以通过作用于YAP使YAP表达异常,在CML细胞的增殖、凋亡方面发挥了重要作用。为后期研究microRNA在CML的作用机制提供思路,为后期靶向治疗提供新方向,可设计针对于CML的microRNA,为该病后期治疗提供一种新的靶向药物。
