miRNA let-7g介导低氧诱导对慢性鼻-鼻窦炎伴鼻息肉成纤维细胞增殖和凋亡的影响
2022-05-10沈羿廷黎可华
沈羿廷,黎可华,张 融
(1.株洲市中心医院 耳鼻咽喉头颈外科,湖南 株洲 412000;2.长沙卫生职业学院 内科学教研室,湖南 长沙 410000)
慢性鼻-鼻窦炎是鼻腔鼻窦的慢性炎症性疾病[1]。慢性鼻-鼻窦炎鼻腔、鼻窦解剖结构异常、变态反应和感染为主要致病因素,从而导致嗅觉减退、脓涕、鼻塞等为主要症状的疾病[2]。慢性鼻-鼻窦炎伴鼻息肉是慢性鼻-鼻窦炎的一个亚型,是耳鼻咽喉头颈外科难治性疾病之一,多次手术治疗效果并不满意,较容易复发[3]。该病的发病较为复杂,受多种因素的影响,本质上是发生在鼻腔和鼻窦粘膜的免疫炎症反应,包括变应性因素、细菌生物膜、鼻腔鼻窦解剖异常、细菌感染、真菌感染、细菌超抗原以及纤毛系统功能异常等[4]。微小RNA是目前研究的热点,是一类大小为22个核苷酸左右的单链非编码RNA,广泛存在动植物和病毒的生物体内,调控影响着生长发育、细胞增殖、分化、凋亡等过程[5]。let-7是最早发现的一类miRNA,参与基因调控、个体发育和细胞黏附等功能活动[6]。相关研究报道,let-7家族中let-7g在肝癌中低表达,与远处转移和预后相关[7]。本研究通过let-7g介导的缺氧诱导慢性鼻-鼻窦炎伴鼻息肉成纤维细胞,对该细胞增殖作用的影响,为临床治疗慢性鼻-鼻窦炎伴鼻息肉提供有价值的参考。
1 材料与方法
1.1 临床资料 选取2020年11月至2021年3月入本院耳鼻咽喉头颈外科行鼻内镜手术治疗慢性鼻-鼻窦炎伴鼻息肉患者10例,患者年龄18~64岁,男6例,女4例。术中所取的鼻息肉组织经过PBS缓冲液冲洗,并去除脓性分泌物、黏液以及坏死组织,放入EP管中,浸入冰水。纳入标准:①符合2018年中国慢性鼻窦炎诊断和治疗指南;②术后病理学证实为慢性鼻-鼻窦炎伴鼻息肉的诊断; ③入组患者近1个月内未使用糖皮质激素、抗生素、抗组胺类药物以及免疫抑制剂治疗;④收集标本前经过患者以及家属同意。排除标准:①霉菌性鼻窦炎、鼻窦肿瘤等患者;②自身免疫性疾病及免疫缺陷性疾病的患者。
1.2 主要试剂 Let-7g mimic由上海生工生物有限公司合成;PBS缓冲液、胰蛋白酶购自天根生化科技(北京)有限公司;DMEM培养液、胎牛血清购自上海威奥生物科技有限公司;多聚甲醛、Prime Script TMRT reagent Kit反转录试剂盒、VEGF和IL-19一抗购自碧云天生物科技有限公司;链霉素青霉素双抗购自福州迈新生物技术有限公司。
1.3 方法
1.3.1 组织细胞分离 将EP管中的鼻息肉标本放到无菌的培养皿中,PBS冲洗,采用组织剪剪成0.5~1 mm,再用PBS冲洗,静置一段时间后去上清液,转入到新的EP管中,加入dispaseⅡ酶1 mL,孵育过夜,移除液体,在剩余的组织中加入0.25%的胰蛋白酶、0.02%的EDTA后,置于37°C水浴箱中,20 min中取出,吹打消化后组织,100目过滤,离心处理,弃上清,PBS清洗,再次吹打。在将分离后的组织分别放置在培养皿中,加入5 mL的培养液,分别放于常氧和低氧条件下进行细胞培养,常氧是以普通空气作为气体进行培养,低氧是利用氮气进行培养,控制氧体积分数,24 h可见组织块周围有细胞向外生长,2 d更换1次培养液,7 d后组织块周围爬满细胞,10 d后细胞相互汇合。继续传代培养,待细胞生长融合度为80%左右时进行传代培养,适量胰蛋白酶消化,吹打分散细胞,分装稀释细胞,在进行细胞冻存与复苏,分装入培养皿内,将培养皿放入 37°C 5%C02的培养箱内48 h后,换液继续培养,对人鼻息肉成纤维细胞细胞进行鉴定,传代至第4~7代细胞用于实验。
1.3.2 CCK-8法检测人鼻息肉成纤维细胞的生长情况 分别取出常氧和低氧下培养的处于对数生长期的人鼻息肉成纤维细胞接种于96孔板中,接种的细胞密度为5×104/孔,在37°C 5%的CO2培养箱中孵育,24 h更换液体1次,采用CCK-8试剂酶联免疫检测仪上检测,在450 nm波长测定96孔的吸光度OD值,连续测定7 d,并记录1~10 d的细胞生长情况。
1.3.3 实验分组 将人鼻息肉成纤维细胞分成4组,常氧组、低氧组、let-7g空白组、let-7g模拟组,常氧组为常规普通空气作为气体进行培养的人鼻息肉成纤维细胞,低氧组为氮气进行培养的人鼻息肉成纤维细胞,let-7g空白组是将miR-NC转染到人鼻息肉成纤维细胞中,在低氧环境下进行培养,let-7g模拟组是将Let-7g mimic转染到人鼻息肉成纤维细胞中,在低氧环境下进行培养。采用CCK-8法检测0、24、48、72 h的各组的细胞增殖情况,方法同上。
1.3.4 qRT-PCR检测let-7g的表达 分别将常氧培养、低氧培养、常氧组、低氧组、let-7g空白组、let-7g模拟组的人鼻息肉成纤维细胞,采用TRIzol提取总RNA,使用Prime Script TMRT reagent Kit反转录试剂盒对提取RNA进行反转录cDNA,将cDNA稀释处理,取2 μL样品,按照qRT-PCR试剂盒使用说明检测,let-7g mRNA上游5′-TCAGCAAACACAACTCCTCCT-3-3′,下游5′-TCAAAGGTCACAACTCCATCC-3′;GAPDH作为内参,异物序列为上游5′-TGGCCTCCAAGGAGTAAGAAAC-3′,下游5′-GGCCTCTCTCTTGCTCTCAGTATC-3′,PCR循环条件:95°C初始孵育30 s,95°C变性5 s,60°C退火31 s,40个循环,用相对定量2-ΔΔCT法计算组织中let-7g mRNA的水平,GAPDH作为miRNA的内源性对照。
1.3.5 流式细胞术实验检测人鼻息肉成纤维细胞的凋亡情况 收集各组已经处理过的细胞,采用胰酶消化,置于流式管内,6°C下孵育,PBS洗涤3次,再将细胞密度调整为1.0×106个/mL,离心处理后,加入500 μL结合液重悬细胞,再加入5 μL的 Annexin V-FITC着色液慢慢混匀,按照Annexin V-FITC 细胞凋亡检测试剂盒说明书进行操作,室温孵育14 min,加入500 μL binding buffer重悬细胞,加入PI着色液,避光静止5 min,流式细胞仪检测细胞凋亡率。
1.3.6 Western blot实验检测VEGF和IL-19蛋白的表达 收集各组已经处理过的细胞,PBS清洗后加入RIPA裂解液,采用BCA 法检测蛋白的浓度,按照试剂盒的使用标准进行操作,采用SDS-PAGE电泳,转到PVDF膜,在室温条件下使用5%的脱脂奶粉封闭1 h,加入VEGF一抗(1∶100)和IL-19一抗(1∶500),4°C孵育过夜,进行TBST清洗,室温下在加入二抗(1∶5 000)孵育1 h,TBST洗膜,以GAPDH作为内参,ECL法显影,采用Image J 软件分析灰度值。
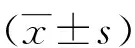
2 结果
2.1 人鼻息肉成纤维细胞鉴定 经过初步形态学鉴定发现,人鼻息肉成纤维细胞呈现星形、梭形、纺锤形等不规则形态,细胞中有卵圆形的细胞核,核仁比较明显,胞质外伸,会有3~6个长短不齐的突起,单个或者多个细胞之间相互粘连聚集(见图1)。
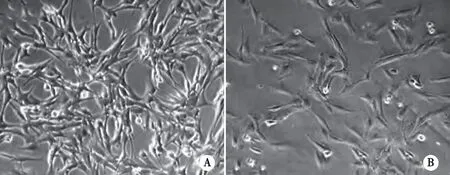
A:人鼻息肉成纤维细胞(×100);B:人鼻息肉成纤维细胞(×200)。图1 倒置显微镜下观察人鼻息肉成纤维细胞
2.2 常氧和低氧条件下人鼻息肉成纤维细胞生长情况对比 CCK-8检测结果显示,1~6 d,常氧状态下的人鼻息肉成纤维细胞生长率与低氧状态下对比无明显差异(P>0.05),7~10 d,常氧状态下的人鼻息肉成纤维细胞生长率显著低于低氧状态,差异有统计学意义(P<0.05,见图2)。
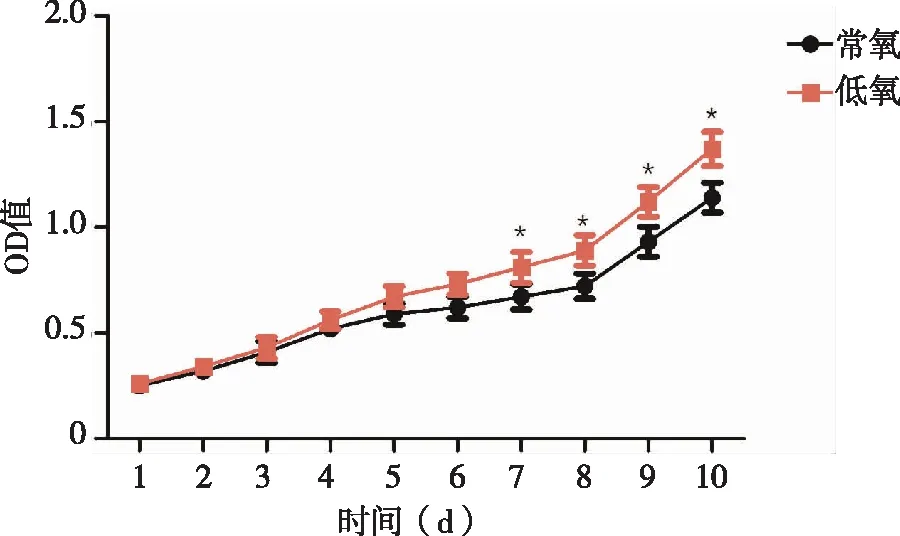
图2 常氧和低氧条件下人鼻息肉成纤维细胞生长曲线比较
2.3 let-7g在常氧和低氧环境下人鼻息肉成纤维细胞中的表达 低氧环境下let-7g的水平显著低于常氧环境下的水平(P<0.05);在不同时间内,0 h和2 h中的let-7g的水平对比无明显差异(P>0.05),但4、8、12、24 h中let-7g的水平显著低于0 h,差异有统计学意义(P<0.05,见图3)。
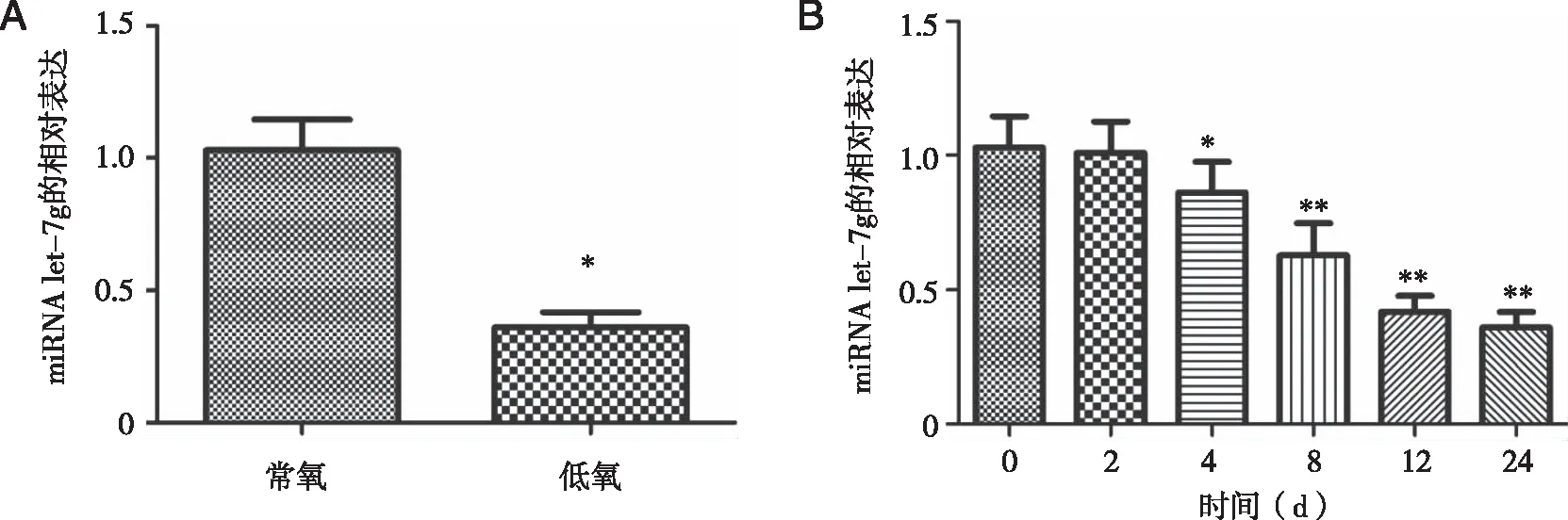
*:与常氧比较, P<0.05; *、**:分别与低氧环境下0 d比较, P<0.05, P<0.05。图3 let-7g在不同环境下人鼻息肉成纤维细胞中的表达
2.4 let-7g对低氧诱导的人鼻息肉成纤维细胞增殖的影响 0~24 h,各组人鼻息肉成纤维细胞增殖能力对比无明显差异(P>0.05),48~96 h,低氧组、let-7g空白组、let-7g模拟组人鼻息肉成纤维细胞增殖能力明显高于常氧组(P<0.05),let-7g空白组的人鼻息肉成纤维细胞增殖能力与低氧组对比无明显差异(P>0.05),let-7g模拟组人鼻息肉成纤维细胞增殖能力明显低于低氧组,差异有统计学意义(P<0.05,见图4)。
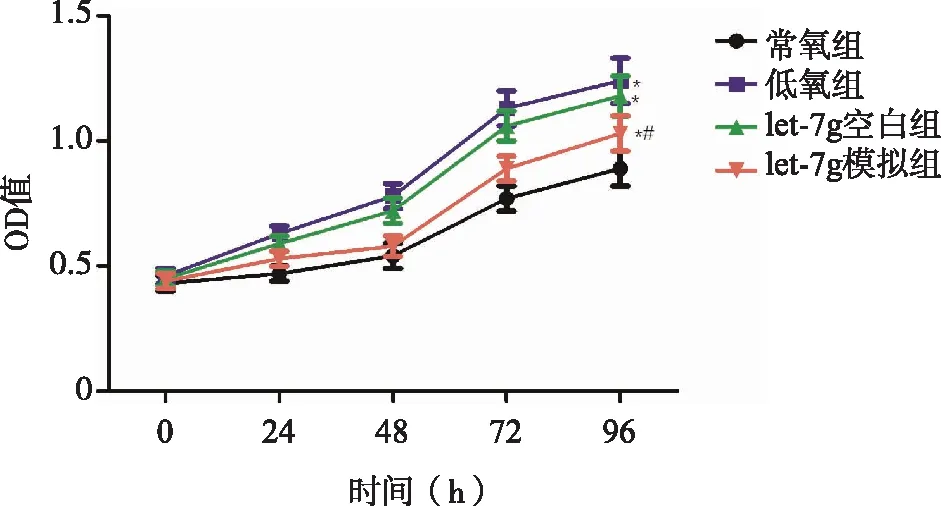
*:与常氧组比较, P<0.05;#:与低氧组比较, P<0.05。图4 let-7g对低氧诱导的人鼻息肉成纤维细胞增殖的影响
2.5 let-7g对低氧诱导的人鼻息肉成纤维细胞凋亡的影响 低氧组、let-7g空白组、let-7g模拟组人鼻息肉成纤维细胞凋亡率明显低于常氧组(P<0.05),let-7g空白组的人鼻息肉成纤维细胞凋亡率与低氧组对比无明显差异(P>0.05),let-7g模拟组人鼻息肉成纤维细胞凋亡率明显高于低氧组,差异有统计学意义(P<0.05,见图5)。
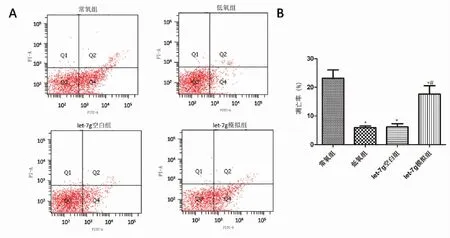
*:与常氧组比较, P<0.05;#:与低氧组比较, P<0.05。 图5 let-7g对低氧诱导的人鼻息肉成纤维细胞凋亡的影响
2.6 let-7g对低氧诱导的人鼻息肉成纤维细胞中VEGF和IL-19蛋白的影响 低氧组、let-7g空白组、let-7g模拟组人鼻息肉成纤维细胞中VEGF和IL-19蛋白明显高于常氧组(P<0.05),let-7g空白组的人鼻息肉成纤维细胞中VEGF和IL-19蛋白与低氧组对比无明显差异(P>0.05),let-7g模拟组人鼻息肉成纤维细胞中VEGF和IL-19蛋白明显低于低氧组,差异有统计学意义(P<0.05,见图6)。
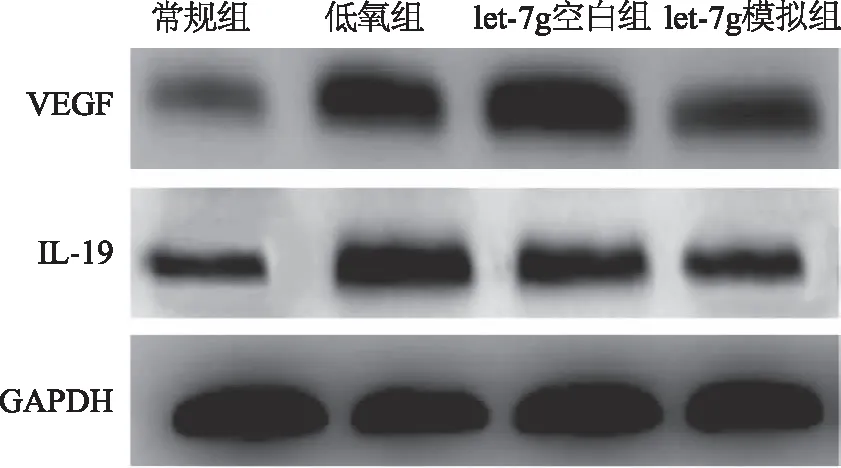
图6 let-7g对低氧诱导的人鼻息肉成纤维细胞VEGF和IL-19的影响
3 讨论
慢性鼻-鼻窦炎是耳鼻喉科常见的一种慢性炎症疾病。在中国的发病率高达8%,欧美地区的发病率为11%,南韩低于占比约为8.4%[8],不仅严重影响着患者的生存质量,同时给社会带来了一定的经济负担。该病包括慢性鼻-鼻窦炎伴鼻息肉和慢性鼻-鼻窦炎不伴鼻息肉两种[9]。其中慢性鼻-鼻窦炎伴鼻息肉临床症状较重,尚未出现较为有效的药物,以手术治疗为主,术后复发率较高,预后较差,所以探讨其发病机制是目前耳鼻喉科研究的热点。慢性鼻-鼻窦炎伴鼻息肉是多因素疾病,具有高度的异质性,所用的治疗效果都不尽人意。尽管关于该病已经出现了大量的报道,但关于其发病机制和病因目前尚不清楚。miRNA是一个长度为18-24nt的小分子RNA,广泛存在于各种生物中,转录后调控着各种基因的表达[10]。相关研究表明,在伴有鼻息肉的慢性鼻-鼻窦炎组中会有7种miRNAs表达上调,69种miRNAs表达下调,这就说明慢性鼻-鼻窦炎可能与miRNA机制相关蛋白的变化异常有一定的关系,参与了炎症发生发展[11]。
miRNA let-7属于细胞分化的标志物,在人类中不仅起着促进分化的作用,而且在成体组织中高表达,在干细胞中低表达[12]。近期研究表明,let-7表达的降低与肿瘤的致瘤性增加和患者预后具有一定的相关性[13]。let-7家族被认为是一种肿瘤抑制miRNA,尤其是let-7g,相关研究发现let-7g通过靶基因调控着炎症反应和低氧诱导的细胞增殖等[14]。目前关于let-7g在鼻-鼻窦炎伴鼻息肉中的相关报道较少,所以本研究探讨let-7g在低氧诱导慢性鼻-鼻窦炎伴鼻息肉成纤维细胞中的表达,并探讨其对细胞调控的作用。本研究结果首先对鼻息肉组织细胞进行分离,分别放于常氧和低氧条件下进行细胞培养,结果发现低氧状态下形成的人鼻息肉成纤维细胞生长率明显高于常氧状态。同时采用qRT-PCR检测let-7g在低氧中的表达,结果显示,低氧环境下let-7g水平显著低于常氧环境下的水平,而且随着在低氧中的时间越长,let-7g水平的表达越低。为了进一步验证miRNA let-7在慢性鼻-鼻窦炎伴鼻息肉中的作用机制,采用CCK-8法和流式细胞术实验证明let-7g对人鼻息肉成纤维细胞增殖和凋亡的作用,结果显示,低氧组、let-7g空白组、let-7g模拟组人鼻息肉成纤维细胞增殖能力明显高于常氧组,let-7g模拟组人鼻息肉成纤维细胞增殖能力明显低于低氧组;低氧组、let-7g空白组、let-7g模拟组人鼻息肉成纤维细胞凋亡率明显低于常氧组,let-7g模拟组人鼻息肉成纤维细胞凋亡率明显高于低氧组、所以说明过表达let-7g可阻断缺氧诱导的细胞增殖,促进其凋亡。
VEGF促血管内皮细胞生长的因子,参与多种疾病的发生发展,包括癌症、炎症疾病和癌症等[15]。IL-19属于IL-20的亚家族,主要作用为调节机体Thl和Th2平衡,促使机体体液免疫反应发生发展[16]。在不同生理状况下可以表现为双重免疫效应,促炎或者抗炎。本研究采用Western blot实验检测VEGF和IL-19蛋白的表达,结果显示,低氧组、let-7g空白组、let-7g模拟组人鼻息肉成纤维细胞中VEGF和IL-19蛋白明显高于常氧组,let-7g模拟组人鼻息肉成纤维细胞中VEGF和IL-19蛋白明显低于低氧组。说明过表达let-7g可以抑制中VEGF和IL-19表达。相关研究表明,低氧和炎症因子联合作用增加了VEGF的产生,可能参与了鼻窦炎的发病机制[17]。已有研究表明,IL-19在慢性鼻-鼻窦炎发展的过程中起到了一定的促炎作用[18]。
综上所述,过表达let-7g可阻断缺氧诱导的细胞增殖,促进其凋亡,有效的降低VEGF和炎症因子水平。
