小鼠睾丸体外生精小管模型构建及Rho/ROCK信号通路对其重构的影响
2022-05-10孙梦迪李春阳刘松坡李小明兰东锋代小方张继东
孙梦迪,李春阳,刘松坡,李小明,徐 睿,兰东锋,代小方,张继东
(1.遵义医科大学 免疫学教研室,贵州 遵义 563099;2.遵义医科大学 遗传学教研室,贵州 遵义 563099)
随着工业社会的发展,不孕不育已经成为全民健康问题。据世界卫生组织(WHO)统计,婚后1年患有不孕不育的夫妇占8%~12%,其中单由男方因素所致的不育占50%[1]。除男性生殖系统本身异常导致精子发生障碍之外,社会和环境因素同样会造成男性不育[2-3]。因此明确男性不育的病因及发病机制对临床治疗男性不育具有重要意义。睾丸作为精子发生的重要场所,明确其发育过程能更好的帮助我们寻找精子发生异常的原因,从而解决男性不育。然而,机体睾丸发育及精子发生过程非常复杂,给相关研究带来一定困难。近年来,类器官、睾丸体外研究模型的建立为明确生精小管形成和精子发生机制提供了诸多可能[4]。此外,我们前期研究中通过添加KSR在体外成功重构出生精小管样结构[5]。支持细胞作为生精小管的主要细胞在1865年被意大利生物学家Enrico Sertoli首次报道。随后对原代支持细胞的培养发现其在维持生殖细胞存活及精子发生过程中扮演至关重要的角色[6]。因此,支持细胞体外培养可作为研究睾丸形成和精子发生的理想模型。
研究证实生精小管发育和精子发生受到激素、蛋白、生长因子以及信号通路等因素的相互调控[7-9]。TGFβ信号通路相关分子可参与调控胚胎期睾丸的形成及生殖细胞的增殖及分化[10]。我们前期研究结果发现TGF-β-ALK5信号轴参与体外睾丸生精小管重构,促进CD34+内皮细胞、p75+细胞、管周肌样细胞(Peritubular myoid cells,PTMs)和SCs的增殖及SCs和其他睾丸细胞的迁移[11]。DHH/PTCH1信号轴通过上调PTCH1+细胞中类固醇生长因子1(Steroidogenic Factor 1,SF1)的表达促进胚胎睾丸间质细胞的分化[12]以及Notch可通过下调支持细胞胶质源性神经生长因子(Glial cell line-derived neurotrophic factor,GDNF )的表达来调节生精细胞的增殖和分化状态,从而维持精原干细胞稳态等[13]。即便如此,参与生精小管形成及精子发生过程中的大量调控因子及其机制仍有待进一步明确。Rho/ROCK信号通路广泛存在于生物体内,发挥促进细胞增殖、迁移、细胞骨架重塑等作用[14]。在胚胎发育早期用Y27632抑制ROCK后,小鼠心脏、神经、躯体等出现明显发育缺陷,表明Rho/ROCK信号通路还可参与器官发育[15]。在睾丸组织中,与生殖细胞相比,RhoA、Rac1在支持细胞呈高表达[16]。Limanjaya等[17]报道L-选择素通过L-型Ca2+通道诱导Ca2+流入支持细胞内活化RhoA、Rac1蛋白,从而调节细胞骨架和支持细胞间的紧密连接。在对生殖系统相关毒性研究中发现,雷公藤通过抑制支持细胞中Rho、ROCK蛋白的表达破坏支持细胞与生殖细胞间的紧密连接[18]。但Rho/ROCK信号通路在睾丸形成过程中的具体作用机制亟需进一步探讨。本研究旨在建立体外生精小管培养模型,探讨Rho/ROCK信号通路在调控生精小管形成中的作用,为男性不育症的发病机制研究提供新思路。
1 材料与方法
1.1 仪器和试剂 水平摇床(海门市其林贝尔仪器制造有限公司);体视显微镜(南通晶锐光学电子有限公司);3111型二氧化碳细胞培养箱(美国Thermo公司);IX53倒置显微镜(日本Olympus公司);DM2500荧光显微镜(德国Leica公司);RPMI 1640培养基、FBS、KSR(美国Gbico公司);IV型胶原蛋白酶(美国Worthington公司);透明质酸酶(德国Merck公司);I型胶原蛋白(日本新田明胶株式会社);4%多聚甲醛、Percoll细胞分离液、青链霉素混合液、24孔板爬片(北京索莱宝科技有限公司);SOX-9多克隆抗体、DAPI(德国Merck公司);Alexa FluorTM594 donkey anti-mouse(美国Thermo-Invitrogen公司); Y27632、BK(美国MCE公司);六孔板(广州海狸生物科技有限公司)。
1.2 实验动物 10日龄雄性C57/BL6小鼠由遵义医科大学实验动物中心提供,《实验动物生产许可证》许可证号为SYXK(黔)2021- 0002,按照遵义医科大学实验动物饲养管理条例,并经过遵义医科大学实验动物伦理委员会审批,伦审[2019]2-089,饲养于遵义医科大学实验动物中心SPF级实验室,人工控温23℃, 12 h光照,12 h黑暗,自由饮水采食。
1.3 实验方法
1.3.1 实验分组 RPMI 1640培养基作为对照组(cont组)、KSR组、FBS组、KSR+Y27632组 (5μM Y27632、10 μM Y27632、25 μM Y27632)及Bradykinin(BK)组,各组DMSO终浓度均为0.1%。
1.3.2 小鼠睾丸支持细胞分离及培养 取新生10日龄小鼠睾丸,去除白膜后,0.1% 胶原蛋白酶酶解消化30 min,静置后去除包含有睾丸间质细胞的上清,将剩余组织剪至约3 mm小块后加入胶原蛋白酶和透明质酸酶再次酶解消化1 h后吹打均匀,200目细胞尼龙网过滤得到单细胞悬液,将3 mL单细胞悬液以1∶1比例缓慢加入3 mL 30% Percoll细胞分离液上方,230 g离心10 min,吸取分层处细胞即为粗提支持细胞。将分离得到的支持细胞分为cont组、KSR组、FBS组、KSR+Y27632组、BK组均匀铺于10%胶原蛋白上,放置在 37℃,含5% CO2培养箱中连续培养6 d,前3 d每天换液去除生殖细胞。
1.3.3 免疫荧光鉴定支持细胞纯度 将分离得到的支持细胞接种于24孔板爬片上,待其完全贴壁去除生殖细胞(约3 d)后取出爬片用4%多聚甲醛固定。参照参考文献[19]方法进行免疫荧光染色。一抗稀释浓度GATA4 1∶200,二抗稀释浓度 1:200,Alexa FluorTM594 donkey anti-mouse 阳性为红色;DAPI终浓度为5 μg/mL。利用Image J软件对GATA4+DAPI+细胞数量进行计数。
1.3.4 生精小管形态观察 相差显微镜下连续每天监测各组支持细胞形态变化及生精小管形成情况。
2 结果
2.1 分离支持细胞的鉴定 GATA4是支持细胞标志物,如图1所示,GATA4+DAPI+支持细胞达90%以上,表明支持细胞粗分离成功。
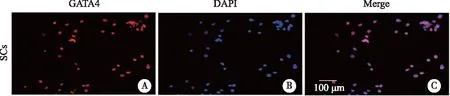
A:分离提取10日龄小鼠睾丸支持细胞,GATA4(红色)标记支持细胞;B:DAPI(蓝色)标记细胞核;C:利用IF技术对细胞纯度进行鉴定;×10。图1 分离细胞中GATA4+ 细胞支持细胞的鉴定
2.2 原代SCs生精小管体外2D模型的构建 将分离得到的细胞分为cont组、FBS组、KSR组,如图2所示,可以观察到在cont组中细细胞伸长呈梭形并具有方向性,朝向管腔,细胞与细胞之间相互连接呈管状分布,但FBS组细胞仅仅变为长梭形,未有管状结构形成。以上结果说明生精小管2D培养模型构建成功。
2.3 Rho/ROCK信号通路在生精小管形成过程中的作用 将分离得到的细胞分为cont组、KSR组、KSR+Y组。观察到 KSR组有明显管状结构形成,而添加ROCK分子抑制剂后,随着抑制剂Y27632浓度的升高,管状结构逐渐崩解(见图3)。
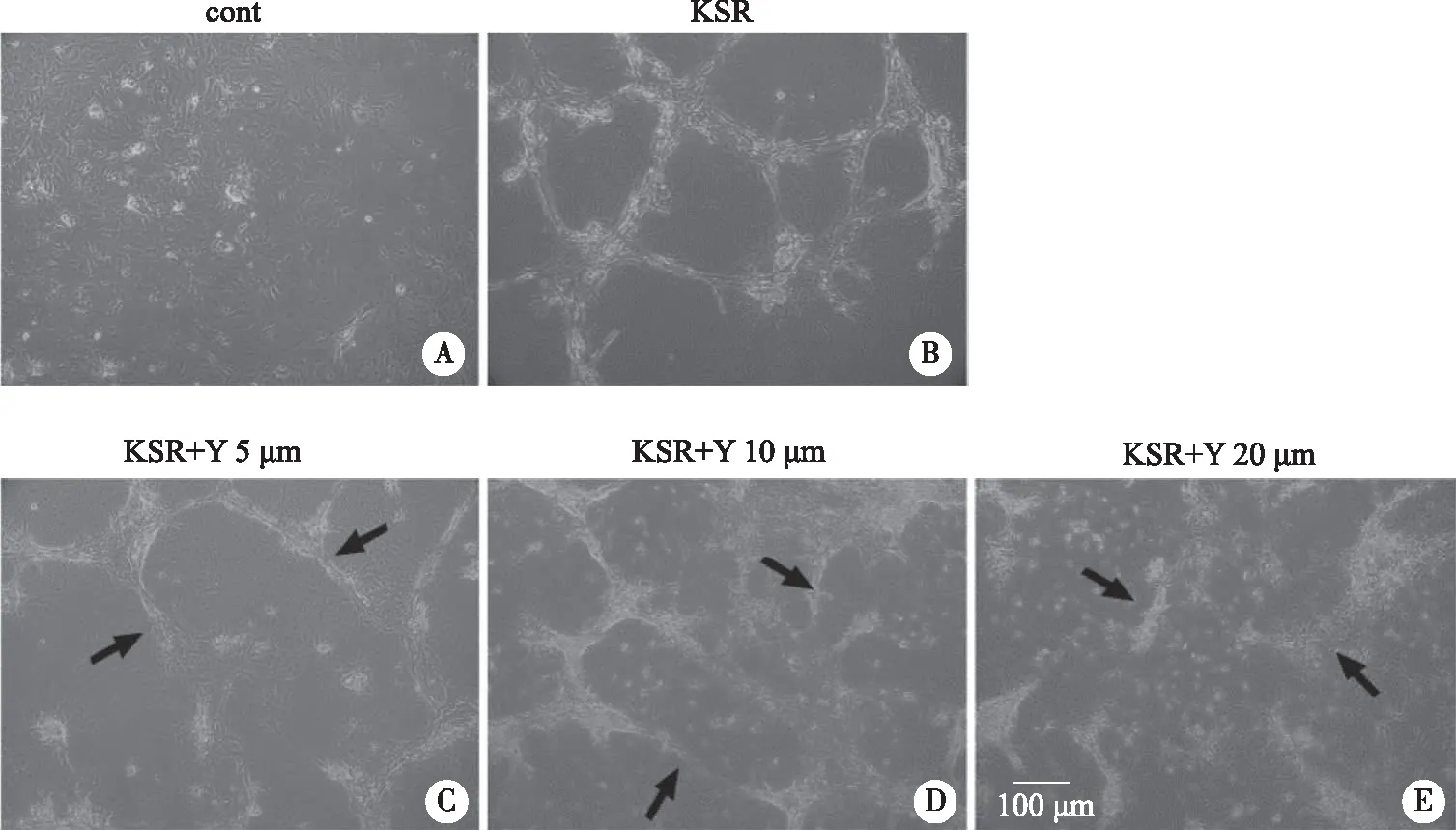
A、B:培养6 d时cont组和KSR组细胞形态;C、D、E:培养6 d后不同抑制剂浓度对生精小管样结构重构的影响;黑色箭头指向被破坏的生精小管样结构;×10。图3 抑制剂Y27632对生精小管样结构重构的作用
为了进一步明确管状结构的形成是否与Rho/ROCK信号通路相关,选用Rho蛋白激动剂BK进一步验证,结果发现BK组细胞相较于对照组呈长梭形,并且细胞与细胞之间相互连接,呈现出类似于KSR组的管状结构(见图4)。以上结果表明,在生精小管形成过程中,Rho/ROCK信号通路扮演着重要的角色。
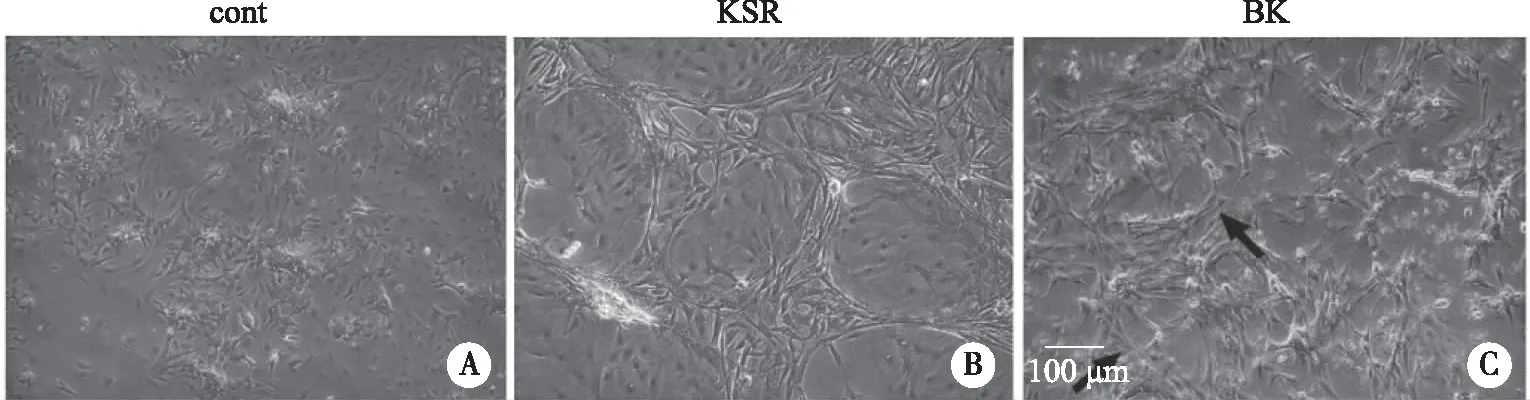
A、B、C:培养6 d时cont组、KSR组、BK组细胞形态;黑色箭头代表生精小管样结构;×10。图4 激动剂BK对生精小管样结构重构的作用
3 讨论
支持细胞是雄性睾丸生精上皮的主要细胞,与睾丸间质细胞和管周肌样细胞共同构成生精微环境维持精子发生。胚胎期生殖腺支持细胞数量的维持对启动生精小管形成具有重要意义[20]。而在成年期,其作为“Nurse”细胞通过形成紧密连接、黏附连接等维持生殖细胞分化发育为精细胞[6]。有研究表明支持细胞是睾丸中一类重要的毒性作用靶细胞[21]。支持细胞体外重构生精小管系统不仅为研究生精小管形成机制、体外重现精子发育过程提供一个很好的模型,还可成为研究生殖毒性的一种可靠模型。因此,在本研究中,将支持细胞分离,在体外构建生精小管模型并探讨能够影响生精小管形成的因素。首先对分离出的细胞进行鉴定,免疫荧光结果显示,分离所得的细胞中GATA4+DAPI+细胞占90%以上,说明支持细胞分离成功。据Hadley等[22]报道,在添加卵泡刺激素、表皮生长因子、胰岛素等生长因子培养支持细胞时,将支持细胞铺在人工合成基底膜(包含层粘连蛋白、IV型胶原蛋白、巢蛋白等)上与普通培养相比,前者可维持支持细胞逐渐伸长呈柱状形成索状结构并伴随着雄激素结合蛋白和转铁蛋白的分泌。但是以上培养系统所含营养成分众多,不利于深入研究参与生精小管形成的影响因素。2017年,Zhang等[23]将分离得到的支持细胞置于基质胶上,在添加KSR后同样在体外重构出管状结构。但基质胶中同样含有大量生长因子。为了避免多种营养物质的干扰,采用无营养成分的I型胶原蛋白作为支架,结果发现,随着培养时间的增加,对照组细胞由最初的圆形贴壁变为不规则形,细胞数量并没有随着培养时间的延长而增加。FBS组只观察到细胞贴壁后逐渐伸长呈纤维状,细胞大量增殖,无管状结构形成。有意思的是在添加KSR后,镜下观察到随着培养时间的增加细胞逐渐伸长、聚集,随后细胞与细胞相连、迁移并逐渐形成管状结构。以上结果提示生精小管模型构建成功,故我们推断KSR中含有某些未知成分能够促进生精小管形成。
Rho GTP酶(Rho GTPases)是1985年发现的Ras超家族中的一员,其主要成员有Rho,Rac和Cdc42三类,具有调节细胞迁移、细胞增殖以及细胞极性等功能。ROCK又称Rho相关蛋白激酶(Rho-associated coiled-coil kinase,ROCK),属于丝氨酸/苏氨酸蛋白激酶,是目前功能研究最为详细的Rho下游效应分子。ROCK有两种异构体ROCK1和ROCK2,其中ROCK1在非神经组织(肝,肺,脾和睾丸)中广泛表达,而ROCK2主要分布在脑,心脏和肌肉中。Rho GTP酶活化后激活下游分子ROCK,进而磷酸化ROCK下游底物肌球蛋白轻链(Myosin light chain,MLC)、LIM激酶(LIM kinase,LIMK)、埃兹蛋白/根连蛋白/膜突蛋白(Ezrin/Radixin/Moesin,ERM)等通过调节细胞肌动蛋白骨架的重组调节细胞迁移、吞噬、收缩和粘附等作用[14],体外研究发现ROCK分子抑制剂Y27632可抑制胚胎期小鼠心脏、神经、躯体[15]、肾脏输尿管[24]的形成。为了进一步明确Rho/ROCK信号通路在生精小管重构过程中的作用,我们选用ROCK分子抑制剂Y-27632及Rho蛋白激动剂BK探讨Rho/ROCK信号通路的作用,结果发现与KSR组相比,随着抑制剂浓度的增加,生精小管结构逐渐崩解,细胞由长梭形逐渐趋向于圆形。相反的是在添加BK后,细胞伸长、迁移并相互连接形成类似于KSR组的管状结构。以上研究表明Rho/ROCK信号通路在SCs参与的生精小管形成过程中具有重要作用。有研究报道,在Rac1、Cdc42敲除小鼠中睾丸重量下降,血睾屏障破坏,SCs极性消失,生殖细胞发育受阻,睾丸生精小管排列紊乱[25-26]。RhoB在睾丸SCs、间质细胞及早期生殖细胞中表达,调节黏附连接的动态平衡[27]。Lui等[28]研究发现整合素可激活RhoB,活化ROCK/LIMK/Cofilin通路介导黏附连接解聚,促进生殖细胞进入近腔面参与生精过程。与RhoB GTPase介导的黏附连接调节机制不同,Cdc42通过与其效应物如IQGAP1的相互作用参与调节E-钙粘附素介导的支持细胞生殖细胞细胞间粘附,失活的Cdc42可扰乱细胞黏附功能[29]。这些研究提示Rho蛋白参与睾丸生精小管的形成。
睾丸生精小管形成过程涉及因素众多,虽然体外模型研究日渐发展迅速,迄今为止,相关研究仍有众多问题亟待解决,包括如何确保体外研究模型的真实客观性;调节生精小管形成的基因、信号通路之间究竟如何联系等。综上所述,本研究成功构建了生精小管体外培养模型,发现Rho/ROCK信号通路参与生精小管重构过程。但Rho和ROCK在体内分布广泛,涉及的生理病理功能复杂,与其他信号通路的相互作用尚未明确,在今后的研究中仍需进一步深入探索Rho/ROCK信号通路在生精小管重构中的作用。
