下调Caveolin-1对紫外线照射下人皮肤成纤维细胞的影响及机制
2022-05-10焦丽萍吴远慧杨晓静
焦丽萍,吴远慧,杨晓静
(河北北方学院附属第一医院 皮肤科,河北 张家口 075000)
皮肤老化是皮肤丧失结构完整性和正常生理功能的过程,该过程可能由内在因素或外在因素引起[1]。来自日光中的紫外线(UV)辐射是引起皮肤衰老的主要外在因素,UV分为长波紫外线UVA(320~400 nm)、中波紫外线UVB(280~320 nm)和短波紫外线UVC(100~280 nm)3种波长范围。UVC几乎完全被臭氧层所吸收,因此,到达地球表面的紫外线主要由大约90% UVA和10% UVB组成,UVA和UVB均可直接破坏DNA分子或诱导相邻嘧啶碱基之间的嘧啶二聚体形成,从而导致突变发生[2-3]。UVB不能有效穿透表皮,主要造成晒伤,而UVA则可以到达真皮层,在皮肤损害和老化中起主要作用[4]。
人皮肤成纤维细胞(Human skin fibroblasts,HSF)是皮肤衰老过程中的主要受损细胞之一,其主要存在于皮肤的真皮层中,产生细胞外基质成分。在经过紫外线照射后,HSF细胞的增殖、分化以及合成分泌功能均会发生明显的改变[5-6]。本研究利用UVA辐射HSF细胞建立光损伤皮肤模型,通过siRNA-Caveolin-1质粒转染HSF细胞,探讨靶向抑制Caveolin-1对UVA诱导的HSF细胞损伤的影响。
1 材料与方法
1.1 材料与试剂 人皮肤成纤维细胞HSF(中国科学院上海细胞库);p38MAPK抑制剂SB203580(美国Santa Cruz);胎牛血清、胰蛋白酶、青霉素、链霉素及 DMEM培养基(美国Gibco);LipofectamineTM2000 转染试剂盒(美国Invitrogen);Trizol试剂、PrimeScript RT reagent Kit with gDNA Eraser试剂盒、SYBR® Premix Ex TaqTMII试剂盒(日本Takara);MTT 试剂、DCFH-DA活性氧检测试剂盒、SA-β-GAL 染色试剂盒(北京索莱宝);Annexin V-FITC/PI细胞凋亡检测试剂盒(上海贝博);PVDF膜、Bradford蛋白浓度测定试剂盒、ECL 超敏发光液(上海碧云天);抗体Caveolin-1、p16、p21、p38 MAPK、P-p38 MAPK、p53(英国Abcam);GAPDH、辣根过氧化物酶(HRP)标记山羊抗兔IgG(北京中杉金桥);本研究引物序列合成均由上海生工生物公司完成。
1.2 方法
1.2.1 细胞培养 人皮肤成纤维细胞HSF复苏后,用含10%胎牛血清、1%青霉素-链霉素的DMEM培养基孵育,置于37℃、5%CO2恒温培养箱中。待细胞生长铺满瓶底80%时,使用含0.02% EDTA 的胰蛋白酶进行消化,离心后更换为完全培养基进行培养。
1.2.2 细胞转染与处理 待HSF细胞生长至对数期时,调整细胞浓度为5×105个/mL,取100 μL接种于96孔培养板上,培养箱内过夜培养。将培养的HSF细胞随机分为4组:①Control组,为正常培养的HSF细胞;②siRNA-Cav-1组,为转染siRNA-Caveolin-1质粒的HSF细胞;③UVA组,经20 J/cm2UVA照射48 h的HSF细胞;④siRNA-Cav-1+UVA组,转染 siRNA-Caveolin-1质粒,再经20 J/cm2UVA照射48 h的HSF细胞。按脂质体 LipofectamineTM2000 转染试剂盒步骤进行HSF细胞转染操作,每组均重复3次。此外,在进行p16、p21、p38 MAPK、P-p38 MAPK及 p53蛋白表达检测时,设置分组包括Control组、SB203580组(10 μmol/L SB203580处理48 h)、UVA组(20 J/cm2UVA照射48 h)、SB203580+UVA组(10 μmol/L SB203580处理48 h,再经20 J/cm2UVA照射48 h)、siRNA-Cav-1+UVA组(转染 siRNA-Caveolin-1质粒,再经20 J/cm2UVA照射48 h)。
1.2.3 实时荧光定量 PCRTrizol法提取各处理组HSF细胞总RNA。通过PrimeScript RT reagent Kit with gDNAEraser试剂盒对总RNA进行逆转录以获得cDNA,并参照SYBR®Premix Ex TaqTMII试剂盒说明进行qRT-PCR检测,以β-actin作为内参基因。反应程序:95℃预变性3 min(1个循环);95 ℃变性20 s,60 ℃退火15 s,72 ℃延伸45 s(38个循环),实验重复3次。采用2-ΔΔCt法计算基因mRNA的相对表达水平。使用的引物序列为:Caveolin-1引物,上游5′- AGTTTCATCCAGCCACGGG-3′,下游5′-AATGTAATGGTGATCCACATGC-3′;β-actin引物,上游5′-ATCGTCCACCGCAAATGCTTCT-A-3′,下游5′- AGCCATGCCAATCTCATCTTGTT-3′。
1.2.4 Western blot 各处理组HSF细胞中加入RIPA 裂解液进行裂解,提取各组细胞的总蛋白, Bradford法检测其浓度。将提取的各组蛋白样品以35 μg的量上样,经过10% SDS-PAGE进行电泳分离,并转印至PVDF膜上。TBST 洗膜3 次,在室温下加入5%山羊血清封闭 2 h,TBST洗膜3次,加入兔抗Caveolin-1(1∶500)、p16(1∶1 000)、p21(1∶1 000)、p38 MAPK(1∶1 000)、P-p38 MAPK(1∶1 000)、 p53(1∶1 000)作为一抗,并以GAPDH为内参蛋白,4°C孵育过夜。第二日TBST 洗膜后,加入HRP标记山羊抗兔IgG(1∶5 000)作为二抗,室温孵育2 h,TBST洗膜,滴加ECL 超敏发光液显影后,蛋白条带拍照,Image J软件分析统计各条带的灰度值。
1.2.5 MTT 法 取对数生长期的HSF细胞,并以1×104个/孔的密度接种到96 孔培养板中,按照1.2.2的方法进行分组处理。处理结束后,加入 5 g/L MTT试剂液,在37℃、5%CO2恒温培养箱中孵育4 h,添加150 μL DMSO溶液,置于恒温培养箱继续孵育10 min,利用酶标仪检测 490 nm 波长下各孔细胞的吸光度值(OD值),并计算各组细胞存活率。细胞存活率(%)= 各处理组OD 值/对照组OD值×100%。
1.2.6 DCFH-DA染色收集 各处理组HSF细胞,采用预冷的PBS缓冲液清洗后,以1×104个/孔的密度接种到 96 孔培养板中,加入终浓度为20 μmol/L的 DCFH-DA,置于37 ℃培养箱内孵育35 min,离心后,PBS缓冲液清洗细胞,无血清细胞培养液洗涤细胞,除去染液,利用荧光显微镜进行观察并拍摄图像,随机选择3个视野,计数每个视野中的细胞数目,采用Image J软件测定总荧光强度,并计算平均荧光强度。
1.2.7 流式细胞术 收集各处理组HSF细胞,使用胰蛋白酶对细胞进行消化并离心,以Annexin V-FITC结合缓冲液重悬细胞后,加入5 μL Annexin V-FITC试剂液,轻轻混匀,接着加入10 μL PI,室温下避光孵育30 min,流式细胞仪检测细胞凋亡情况。
1.2.8 细胞SA-β-GAL 染色 取对数生长期的HSF细胞,并以1×104个/孔的密度接种到6 孔培养板中,按照1.2.2的方法处理后收集各组HSF细胞,PBS缓冲液清洗后,每孔加入1 mL SA-β-GAL试剂液,室温孵育15 min,弃原液,PBS缓冲液洗涤,再加1 mL染色液,保鲜膜封孔后,将培养板放在37 ℃下过夜,次日,光学显微镜观察染色结果并计数,衰老细胞呈深蓝色。
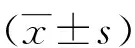
2 结果
2.1 各组HSF细胞中Caveolin-1 mRNA与蛋白表达检测 HSF细胞经过不同处理后,实时荧光定量PCR和Western blot检测各组细胞中Caveolin-1 mRNA与蛋白的表达水平,转染siRNA-Cav-1的细胞中Caveolin-1 mRNA相对表达量与蛋白相对表达量均显著下降(P<0.05),而经UVA处理的细胞中Caveolin-1 mRNA相对表达量与蛋白相对表达量均显著上升(P<0.05),而转染siRNA-Cav-1后再经过UVA处理的细胞中Caveolin-1 mRNA相对表达量与蛋白相对表达量组均显著下降(P<0.05,见图1)。

A:Control ;B:SiRNA-Cav-1;C:UVA;D:SiRNA-Cav-1+UVA;*:与Control组比较, P<0.05;#:与 UVA组比较,P<0.05。图1 各组HSF细胞中Caveolin-1 mRNA与蛋白表达检测
2.2 siRNA 转染对UVA诱导的HSF细胞存活率的影响 MTT检测结果显示,经UVA处理的HSF细胞存活率较Control组显著下降(P<0.05),而转染siRNA-Cav-1的细胞存活率与Control 组无差异(P>0.05);与UVA组比较,转染siRNA-Cav-1后再经过UVA处理的细胞存活率显著升高(P<0.05,见图2)。
*:与Control 组比较, P<0.05;#:与UVA组比较,P<0.05。图2 各组HSF细胞存活率比较
2.3 siRNA 转染对UVA诱导的HSF细胞ROS水平的影响 通过DCFH-DA染色检测各组HSF细胞内ROS水平,转染siRNA-Cav-1的细胞绿色荧光强度较Control组无明显变化(P>0.05),经UVA处理的细胞绿色荧光明显增强,说明ROS水平增加(P<0.05);转染siRNA-Cav-1后再经过UVA处理的细胞绿色荧光明显减弱,ROS水平较UVA组下降(P<0.05,见图3)。

*:与Control 组比较, P<0.05;#:与 UVA 组比较,P<0.05。图3 DCFH-DA染色检测各组HSF细胞内ROS水平
2.4 siRNA 转染对UVA诱导的HSF细胞凋亡水平的影响 流式细胞术检测各组HSF细胞凋亡的结果显示,转染siRNA-Cav-1的HSF细胞凋亡率与Control 组比较差异无统计学意义(P>0.05),经过UVA处理的细胞凋亡率较Control 组显著增加(P<0.05);而转染siRNA-Cav-1后再经过UVA处理的细胞凋亡率较UVA处理后细胞凋亡率显著减少(P<0.05,见图4)。

*:与Control 组比较, P<0.05;#:与 UVA 组比较,P<0.05。图4 流式细胞术检测各组HSF细胞凋亡情况
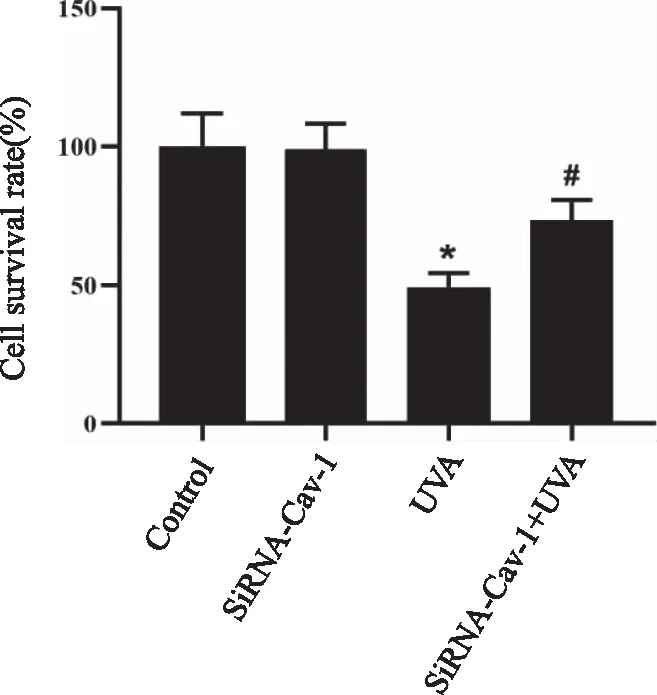
2.5 siRNA 转染对UVA诱导的HSF细胞衰老的影响 SA-β-GAL 染色检测各组HSF细胞衰老情况,转染siRNA-Cav-1后再经过UVA处理的细胞SA-β-GAL染色阳性细胞较少,着色很浅,而UVA处理的细胞SA-β-GAL染色呈强阳性,衰老细胞所占比例较Control 组显著增加(P<0.05);转染siRNA-Cav-1后再经过UVA处理的细胞中SA-β-GAL染色阳性细胞较少,衰老细胞所占比例较UVA处理显著下降(P<0.05,见图5)。
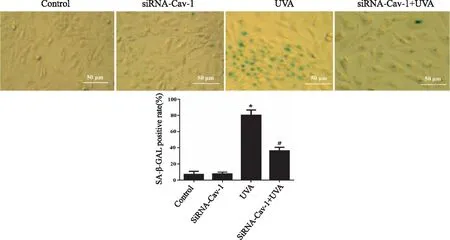
*:与Control 组比较, P<0.05;#:与 UVA 组比较,P<0.05。图5 SA-β-GAL 染色检测各组HSF细胞衰老情况
2.6 siRNA转染对UVA诱导的HSF细胞内p16、p21、P-p38 MAPK及 p53蛋白表达的影响 Western blot检测结果显示,经10 μmol/L p38 MAPK抑制剂SB203580处理48 h 的细胞内p16、p21、p53蛋白表达以及p38 MAPK磷酸化水平较Control 组均显著下调(P<0.05),而经UVA处理的细胞内p16、p21、p53蛋白表达以及p38 MAPK磷酸化水平较Control 组均显著上调(P<0.05);经过10 μmol/L p38 MAPK抑制剂SB203580处理48 h后再经过UVA照射的细胞中,p16、p21、p53蛋白表达以及p38 MAPK磷酸化水平较单独使用UVA照射的细胞均显著下调(P<0.05),且该作用效果与转染siRNA-Cav-1后再经过UVA处理的细胞中一致,见图6。
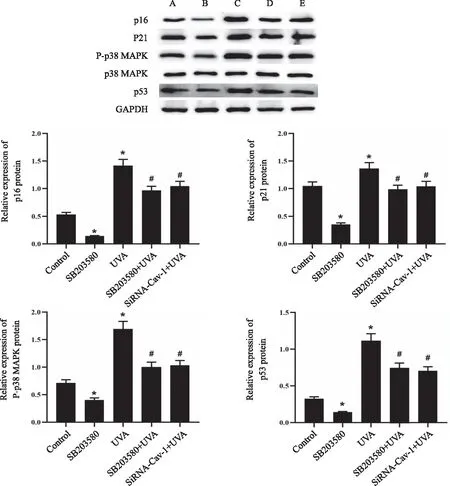
A:Control 组;B:SB203580 组;C:UVA 组;D:SB203580+UVA组;E:siRNA-Cav-1+UVA 组;*:与control 组比较, P<0.05;#:与UVA 组比较,P<0.05。图6 各组HSF细胞p16、p21、P-p38 MAPK及p53蛋白表达
3 讨论
作为人体与周围环境的界面,皮肤为人类提供了稳定外部环境的保护性屏障,并在免疫中发挥一定的作用。人的皮肤主要由表皮、真皮以及皮下组织所组成,HSF细胞是真皮的主要基质产生的细胞,并且主要受到其基质环境的调节,可用于改善和指导皮肤伤口愈合过程,能够过合成和降解细胞外基质(ECM)的某些成分,例如胶原蛋白、弹性蛋白和糖胺聚糖等来维持皮肤状态稳定,在抗皮肤衰老与预防皮肤损伤中均起着重要作用[7]。当皮肤屏障受损时,HSF细胞通过协调一系列反应来修复损伤,主要包括止血、炎症、上皮形成和细胞外基质重塑[8]。因此,HSF细胞在维持皮肤组织完整性和抗老化中发挥着不可替代的作用,是研究皮肤衰老发生发展机制及采取治疗措施的关键环节。
胞膜小窝是细胞质膜内陷所形成的直径大小为50~100 nm的囊状结构,主要由脂类和蛋白质组成,其中小窝蛋白(Caveolin)是胞膜小窝区别于其它脂筏结构的特征性蛋白分子,在胞膜小窝的结构功能中起着关键作用[9]。Caveolin-1 是Caveolin的一种亚型,存在于多种类型细胞中,作为细胞膜中必不可少的一种膜蛋白,其在多数细胞中呈高表达[10]。以往研究表明,Caveolin-1的主要功能可能是参与跨膜转运,而近期研究发现Caveolin-1能够与多种蛋白质相互作用,是细胞内信号分子的转导中心[11]。例如,细胞内各种信号分子与Caveolin-1的支架区域结合形成复合体,从而抑制了关键信号蛋白分子的活性以负调节信号通路,从而抑制细胞增殖,促进细胞的成熟与分化[12];另外,Caveolin-1还可能参与钙通道活性的调节过程[13]。本研究结果显示,经过UVA诱导的HSF细胞内Caveolin-1表达明显上调,这提示Caveolin-1可能参与调节HSF细胞的生理活性。接着通过转染siRNA-Caveolin-1质粒抑制HSF细胞中Caveolin-1表达发现,经UVA诱导的HSF细胞存活率增加,同时抑制了细胞凋亡的发生。
适量ROS对维持机体或细胞稳定起着有益作用,例如激活环氧合酶和脂氧合酶以及调节炎症过程,但ROS的过量产生是皮肤老化过程中的关键病理与生理事件,能够诱导并加速皮肤衰老[14]。光老化的发生也与ROS的产生有关,紫外线会导致ROS升高,破坏细胞结构和功能并介导炎症反应[15]。ROS通过激活相关信号通路,从而导致胶原蛋白的产生、基质金属蛋白酶合成减少以及基质金属蛋白酶的降解,从而导致结缔组织降解,衰老相关分泌表型的产生,最终促进了皮肤的衰老[16]。本研究结果显示,在抑制Caveolin-1表达后经过UVA照射的HSF细胞中ROS水平较只经过UVA照射的HSF细胞明显下降,由此表明抑制Caveolin-1表达可阻止HSF细胞内ROS水平的升高,抑制细胞的老化。
衰老细胞的典型特征包括形态改变、SA-β-GAL活性升高、加速端粒的缩短和细胞增殖速率降低[8]。细胞衰老诱导涉及多种机制和途径,p53、p21和p16是诱发细胞老化的刺激信号的关键蛋白。p53是衰老的关键调节因子,p53/p21途径可响应DNA损伤和端粒磨损而促进细胞衰老,p16同样作为衰老细胞和衰老过程的生物标志物,其调控十分复杂,涉及表观遗传控制和多种转录因子[17]。本研究发现,p16、p21、p53蛋白表达以及p38 MAPK磷酸化水平均显著下调,与使用p38 MAPK抑制剂SB203580的作用结果一致。丝裂原活化蛋白激酶(MAPK)在代谢、氧化还原反应以及细胞生长中发挥功能,p38在氧化应激中被相关激酶迅速磷酸化激活,进而促进细胞凋亡并引起氧化应激反应[18]。
综上所述,在UVA诱导的人皮肤成纤维细胞损伤老化后,通过靶向抑制 Caveolin-1表达可起到保护细胞的作用,其机制与降低细胞内ROS 水平、抑制p16/p21/p53途径的激活以及p38 MAPK磷酸化水平有关。本研究对于靶向Caveolin-1抗老化损伤效应的研究及应用提供理论依据。而在光老化关键信号路径中相关蛋白的表达变化,是否直接引起Caveolin-1表达产生变化以及具体机制有待进一步研究论证。
