白及多糖通过circ_0006168/miR-127-5p对肝癌细胞生物学行为的影响
2022-05-10石海波严丹丽
石海波,李 冬,严丹丽
(四川省资阳市第一人民医院 肿瘤科,四川 资阳 641300)
肝癌的发病率与死亡率逐年上升,手术、化疗等治疗手段可提高肝癌患者的生存率,但化疗等治疗方法的毒副作用较大[1-2]。随着对中药抗肿瘤的研究,越来越多的研究表明中药的活性成分具有抗肝癌的作用[3-4]。白及为兰科白及属多年生草本植物,多糖是其主要活性成分,研究表明白及多糖具有抗肝癌作用,但关于其具体作用机制尚未阐明[5]。环状RNA(Circular RNA,circRNA)具有稳定性与组织特异性,其在肿瘤中表达异常并可参与多种疾病发生发展过程,研究表明circ_0006168在食管癌细胞中表达上调,并可促进食管癌细胞增殖、迁移及侵袭[6]。Circular RNA Interactome预测显示circ_0006168与miR-127-5p存在结合位点。研究表明miR-127-5p在肝癌细胞中表达水平降低,上调其表达可抑制细胞增殖及侵袭[7]。因此,本研究主要探讨白及多糖是否可通过调控circ_0006168/miR-127-5p分子轴而调节肝癌细胞生物学行为。
1 材料与方法
1.1 材料与试剂 白及茎块购自亳州市徽永堂生物科技有限公司;人肝癌细胞HCC9204购自美国ATCC;DMEM培养液与胎牛血清购自美国Gibco公司;Trizol试剂、Lipofectamine2000购自美国Thermo Fisher公司;cDNA合成及qRT-PCR试剂购自北京天根生化公司;miR-NC、miR-127-5p mimics、si-NC、si-circ_0006168、pcDNA、pcDNA-circ_0006168购自上海吉玛制药技术有限公司;CCK-8试剂、细胞凋亡检测试剂盒购自北京索莱宝公司;Transwell小室购自美国Corning公司;双荧光素酶报告基因载体及其活性检测试剂盒购自美国Promega公司。
1.2 方法
1.2.1 白及多糖的提取[8]白及茎块中加入20倍体积的蒸馏水,60℃回流提取4 h后再重复1次,收集2次提取液后过滤,10 000 r/min转速离心10 min后提取上清液,加入石油醚后充分混匀,吸取下层提取液后加入2%活性炭,40℃水浴30 min后过滤并经70℃减压浓缩,加入无水乙醇沉淀后经10 000 r/min转速离心10 min,提取沉淀后加入蒸馏水,采用Savage法脱蛋白,直至无中间层析出,相同条件下离心后吸取上清液,采用流水透析3 d后经蒸馏水透析2 d,真空冷冻干燥后得到白及多糖,加入培养基稀释液至50、100、200 μg/mL。
1.2.2 实验分组 HCC9204细胞接种于6孔板(1×104个/孔),加入含有不同浓度(0、50、200 μg/mL)白及多糖的培养基培养24 h,分别记为白及多糖0、50、100、200 μg/mL组。采用脂质体转染法将si-NC、si-circ_0006168分别转染至HCC9204细胞,分别记为si-NC组、si-circ_0006168组。采用脂质体转染法将pcDNA、pcDNA-circ_0006168分别转染至HCC9204细胞,转染成功后加入含有浓度为200 μg/mL白及多糖的培养基培养24 h,分别记为白及多糖+pcDNA组、白及多糖+pcDNA-circ_0006168组。
1.2.3 CCK-8实验检测细胞增殖 收集各组HCC9204细胞接种于96孔板(3×103个/孔),每孔加入CCK-8溶液10 μL,于37℃、体积分数5%CO2培养箱内培养2 h后应用酶标仪检测各孔在450 nm波长处的光密度值(OD值)并计算细胞增殖抑制率[(对照组OD-实验组OD)/(对照组OD-空白组OD)×100%]。
1.2.4 平板克隆形成实验 取各组HCC9204细胞接种于6孔板(500个/孔),于37℃、体积分数5%CO2培养箱内培养14 d,弃培养基,加入预冷PBS洗涤后加入甲醇500 μL固定20 min,弃甲醇后加入1%结晶紫染色液400 μL染色15 min,蒸馏水洗涤后晾干并置于显微镜下统计细胞克隆形成数。
1.2.5 Transwell实验检测细胞迁移 取各组HCC9204细胞(1×105个/mL)分别接种于小室的上室(200 μL/孔),下室加入600 μL含有10%胎牛血清的培养液,于37℃、体积分数5%CO2培养箱内培养24 h,多聚甲醛固定20 min,0.1%结晶紫染色液染色10 min,于显微镜下统计迁移细胞数。
1.2.6 流式细胞术检测细胞凋亡率 用胰蛋白酶消化各组CAL-27细胞(5×105个/mL),取1 mL细胞悬液经3 000 r/min转速离心5 min,弃上清,预冷PBS洗涤细胞沉淀后加入400 μL结合缓冲液重悬细胞,分别加入5 μL Annexin V-FITC与5 μL PI,室温避光孵育15 min,于1 h内用流式细胞仪检测细胞凋亡率。
1.2.7 qRT-PCR检测circ_0006168、miR-127-5p的表达水平 取各组HCC9204细胞加入1 mL Trizol试剂后室温孵育5 min,3 000 r/min转速离心5 min,分别加入氯仿、异丙醇后离心,弃上清,加入75%乙醇1 mL洗涤RNA沉淀,离心后弃上清得到RNA。反转录合成cDNA,以cDNA为模板进行qRT-PCR反应,应用罗氏LightCycler480荧光定量PCR仪检测基因相对表达量。circ_0006168正向引物5′-ACCAGCAGAACTAGGAAACA-3′,反向引物5′-TGGCATCCCTATTAGTCTTTC-3′;GAPDH正向引物5′-GGGAAGCTCACTGGCATGGCCTTCC-3′,反向引物5′-CATGTGGGCCATGAGGTCCACCAC-3′;miR-127-5p正向引物5′-TTCCCACCTGCGGGGTG-3′,反向引物5′-TCTAGAGAAATCTTTGAATGCCAAG-3′;U6正向引物5′-TCCGATCGTGAAGCGTTC-3′,反向引物5′-GTGCAGGGTCCGAGGT-3′。
1.2.8 双荧光素酶报告实验检测circ_0006168与miR-127-5p的靶向关系 采用用分子克隆法将circ_0006168与miR-127-5p的结合位点克隆至pGL3质粒中构建野生型载体WT-circ_0006168,采用点突变试剂盒将结合位点进行突变,然后将突变位点克隆至pGL3质粒中构建突变型载体MUT-circ_0006168,采用脂质体转染法将WT-circ_0006168、MUT-circ_0006168分别与miR-NC或miR-127-5p mimics共转染至HCC9204细胞,于37℃、体积分数5%CO2培养箱内培养48 h后收集细胞并采用试剂盒检测细胞相对荧光素酶活性。
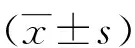
2 结果
2.1 白及多糖对HCC9204增殖、凋亡、迁移的影响 与白及多糖0 μg/mL组比较,50、100、200 μg/mL组细胞增殖抑制率和细胞凋亡率升高(P<0.05),克隆形成数和迁移细胞数减少(P<0.05),且呈剂量依赖性(见图1、表1)。
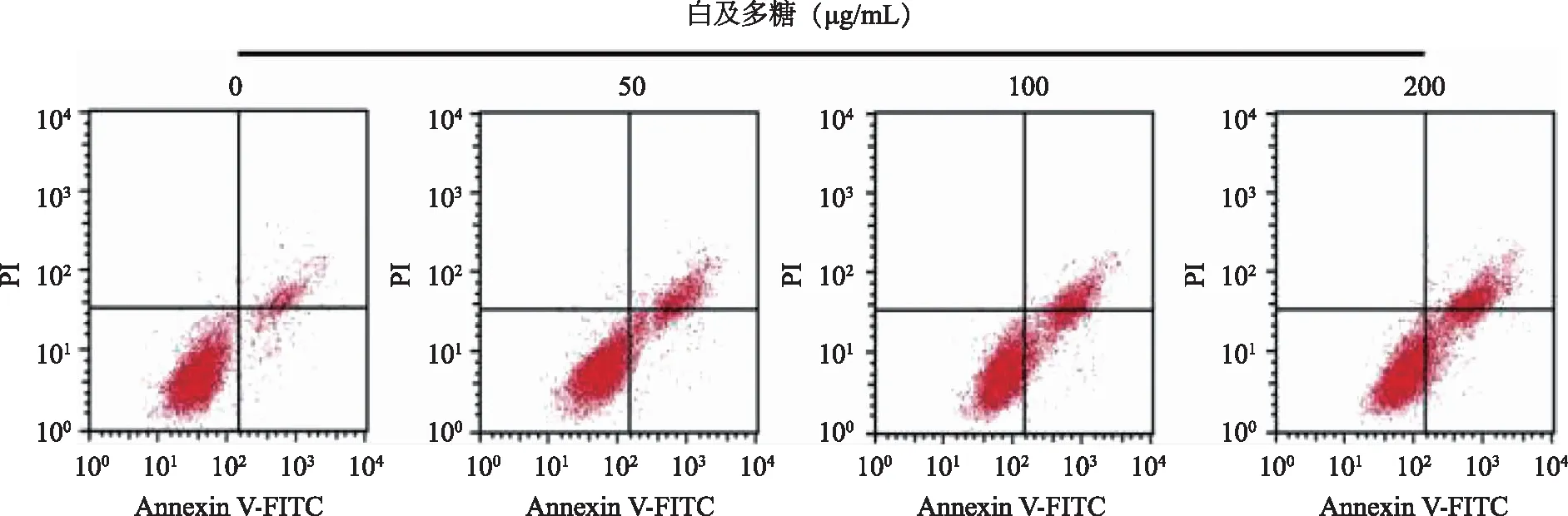
图1 不同浓度白及多糖诱导HCC9204凋亡
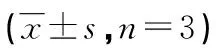
表1 白及多糖抑制HCC9204增殖、迁移及诱导凋亡
2.2 白及多糖对HCC9204中circ_0006168和miR-127-5p表达的影响 与白及多糖0 μg/mL组比较,50、100、200 μg/mL组circ_0006168的表达量降低(P<0.05),miR-127-5p的表达量升高(P<0.05),且呈剂量依赖性(见表2)。
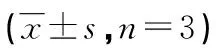
表2 白及多糖对circ_0006168和miR-127-5p表达的检测
2.3 circ_0006168和miR-127-5p靶向关系 circ_0006168与miR-127-5p存在结合位点,见图2。miR-127-5p过表达可抑制野生型载体WT-circ_0006168的荧光素酶活性(P<0.05),见表3。

图2 circ_0006168和miR-127-5p互补序列
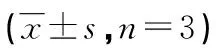
表3 双荧光素酶报告实验
2.4 下调circ_0006168对HCC9204增殖、凋亡、迁移的影响 与si-NC组比较,si-circ_0006168组miR-127-5p的表达量升高(P<0.05),细胞增殖抑制率和凋亡率升高(P<0.05),克隆形成数和迁移细胞数减少(P<0.05),见图3、表4。
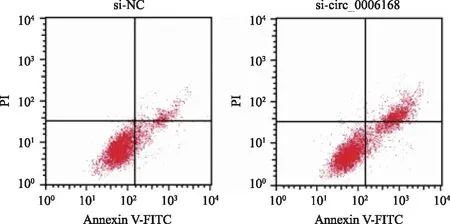
图3 下调circ_0006168诱导HCC9204凋亡
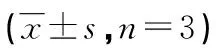
表4 下调circ_0006168抑制HCC9204增殖、迁移及诱导凋亡
2.5 circ_0006168对白及多糖处理的HCC9204增殖、凋亡、迁移的影响 与白及多糖+pcDNA组比较,白及多糖+pcDNA-circ_0006168组miR-127-5p的表达量降低(P<0.05),细胞增殖抑制率和凋亡率降低(P<0.05),克隆形成数和迁移细胞数增多(P<0.05),见图4、表5。
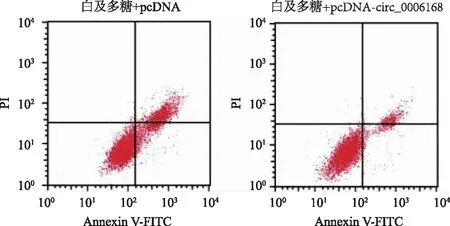
图4 circ_0006168可逆转白及多糖对HCC9204凋亡的诱导作用
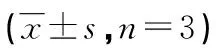
表5 circ_0006168对白及多糖处理的HCC9204增殖、凋亡、迁移的作用
3 讨论
中草药的活性成分具有抗肿瘤作用,研究表明中草药可通过调控多个靶点基因表达而发挥抗肝癌作用[9-10]。circRNA在肝癌中表达异常,并可充当miRNA的海绵体而调节其靶基因表达从而参与肝癌发生发展过程,还可能作为肝癌治疗的潜在靶点[11]。但circRNA是否可作为中草药治疗肝癌的潜在靶点尚未阐明。
白及多糖具有抗结肠癌[12]、胃癌[13]的作用,并可抑制肿瘤生长。本研究结果显示,随着白及多糖浓度的增加,肝癌细胞增殖抑制率和细胞凋亡率升高,克隆形成数和迁移细胞数减少,提示白及多糖可抑制肝癌细胞增殖、克隆形成及迁移,并可促进细胞凋亡。分析原因可能在于白及多糖具有抗肿瘤作用,其可能通过抑制肝癌细胞增殖及转移从而发挥抗肝癌作用。
为进一步探究白及多糖抗肝癌的作用机制,本研究结果显示,白及多糖能够以浓度依赖性的方式降低circ_0006168的表达量,而增高miR-127-5p的表达量,提示白及多糖可能通过抑制circ_0006168表达而促进miR-127-5p的表达从而发挥抗肝癌作用。研究表明circ_0006168在人胶质母细胞瘤细胞中呈高表达,并可促进细胞增殖及转移[14]。circ_0006168在食管鳞状细胞癌细胞中表达上调,并可通过调节miR-516b-5p/XBP1分子轴的表达而促进细胞增殖、迁移及侵袭[15]。miR-127-5p在胃癌细胞中表达水平降低,上调其表达可通过靶向调控SORT1的表达而抑制胃癌细胞生长及转移[16]。miR-127-5p高表达可抑制食管鳞状细胞癌发展进程[17]。本研究初步证实circ_0006168可靶向结合miR-127-5p,并可充当miR-127-5p的海绵分子。同时本研究发现,上调circ_0006168表达可减弱白及多糖对肝癌细胞增殖、克隆形成、迁移的抑制作用及其对细胞凋亡的促进作用。提示白及多糖可通过调控circ_0006168/miR-127-5p的表达而发挥抗肝癌作用。
综上所述,白及多糖可通过抑制circ_0006168表达而促进miR-127-5p表达,从而抑制肝癌细胞增殖、克隆形成及迁移,促进细胞凋亡,circ_0006168/miR-127-5p分子轴在肝癌发生发展过程中可发挥重要调控作用,可作为白及多糖治疗肝癌的潜在靶点,还可为肝癌治疗提供新方向。但白及多糖是否可通过调控其他基因或信号通路表达而发挥抗肿瘤作用仍需进一步探究。
