可载药的磁性聚己内酯/明胶微球支架的制备及其体外成骨性能的研究
2022-05-10胡姝颖章非敏
周 昉,刘 俊,胡姝颖,史 凡,严 佳,章非敏
口腔颌面部骨量不足是阻碍种植义齿临床应用的一大因素。临床上常使用自体骨和异体骨移植修复骨缺损,然而受到来源和伦理等因素的限制[1]。骨组织工程通过结合材料学、生物学及机械工程学的原理与技术,构建模仿细胞外基质理化性质的替代材料,为骨缺损的修复提供新的选择[2]。
支架在骨组织工程中发挥着重要作用,支架材料作为人造的临时细胞外基质,为骨组织修复维持空间,其理化性能可影响附着细胞的功能和状态[3]。其中,颗粒支架材料具有比表面积大、临床操作的灵活便利等特点,在临床中应用较为广泛[4]。本课题组在过去的研究中,成功制备了聚己内酯(polycaprolactone,PCL)多孔微球支架,并在体外研究中取得一定的成骨效果。但其仍然存在无法载药且缺乏骨诱导作用等问题[5]。因此在本研究中,我们拟改进该颗粒支架,并将生物活性物质与之结合,以达到更好的成骨特性。
近年来,磁性纳米铁颗粒因其特殊的理化性质,可与周围组织产生生物交互作用,被越来越多地应用于生物医药领域中[6-7]。磁性纳米铁颗粒自身可提供纳米级别的微小磁场,对周围细胞的行为造成影响[8]。干细胞的膜蛋白受体可感受并响应该磁场导致的微小机械力变化,通过其相应的联离子通道触发胞内信号转导[9]。在骨组织工程中,有研究者使用纳米铁作为人造高分子支架材料的改性物质,可增加材料表面粗糙度,促进干细胞的粘附和铺展,同时通过增加机械应力刺激促进其成骨分化[10-11]。然而,过量的未经修饰的纳米铁会导致细胞内活性氧增加,引起细胞氧化应激,因此纳米铁需要合适的表面改性方法并且控制使用浓度[12-13],Hao等[14]发现,油酸四氧化三铁纳米颗粒(nano oil-acid coated Fe3O4particles,OA@Fe3O4)毒性低于经表面修饰之前,且油酸可与聚酯分子之间结合,减少铁泄漏[14]。因此,我们拟在多孔聚酯微球中添加OA@Fe3O4,以期对支架上的细胞进行成骨诱导。此外,生长因子的载入可赋予颗粒支架更好的骨诱导特性。比如,骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)是转化生长因子-β(transforming growth factor-β,TGF-β)超家族的重要成员,被公认为是干细胞成骨分化过程中重要的细胞因子之一[15-16]。其配合人造植入物的使用可以加快新骨与植入物的整合,降低手术失败风险[17]。并且,含有BMP-2的胶原支架已被FDA认证并投放临床使用[18]。然而BMP-2在外界环境中易失活,且在体内易被酶解,必须为其构建保护性载体[19]。明胶为Ⅰ型胶原降解产物,常被用于药物载体的构造[20]。因此,我们拟在多孔的高分子聚合物的孔隙中加入明胶,通过改性明胶实现生长因子负载。
在本研究中,我们制备了PCL/明胶微球颗粒(PCL/gelatin microsphere,PGM)支架,并筛选出特定浓度的OA@Fe3O4,对微球进行改性,制备出了磁性颗粒支架。同时,我们也初步探究了该支架的生长因子的负载效果,通过大鼠骨髓间充质干细胞(rat bone mesenchymal stem cell,rBMSC)体外行为来验证其有效性。
1 材料与方法
1.1 试剂与仪器
PCL(分子量80 ku;济南岱罡生物工程有限公司,中国山东),二氯甲烷(国药,中国北京),明胶(A型;Sigma,美国),PVA(Sigma,美国),京尼平(Macklin,中国上海),高温热解法油酸四氧化三铁纳米颗粒(东纳生物科技有限公司,中国江苏),重组人源骨形态发生蛋白-2(recombinant human BMP-2,rhBMP-2)(Peprotech,美国),rBMSC(P3~P6;Cyagen,中国上海),SD大鼠骨髓间质干细胞完全培养基、SD大鼠骨髓间质干细胞成骨诱导分化培养基(Cyagen,中国上海),0.25%胰酶/EDTA(Gibco,美国),磷酸盐缓冲液(phosphate buffered solution,PBS;Hyclone,美国),CCK-8(Apexbio,美国),载绿色荧光蛋白基因慢病毒(吉凯基因科技有限公司,中国上海),总RNA提取试剂盒(天根生化科技有限公司,中国北京),PrimerScript RT Master Mix、SYBR Premix EX Taq Ⅱ 酶(Takara,日本),Maia3场发射扫描电子显微镜(field emission scanning electron microscope, FESEM, TESCAN,捷克),JEM-1200EX透射电子显微镜(transmission electron microscope, TEM, JEOL,日本),LGJ-10冷冻干燥机(松源华兴科技发展有限公司,中国北京),相差显微镜、倒置荧光显微镜(inverted fluorescence microscope, IFM)(Leica,德国),Spectra Max 190酶标仪(Molecular device,美国),STA 449F3同步热分析仪(Netzsch,德国),ABI QuantStudio 7荧光定量PCR仪(Applied Biosystems,美国)。
1.2 PGM的制备与表征
1.2.1 PGM的制备 将500 mg明胶加入5 mL双蒸水中,同时将500 mg PCL加入10 mL二氯甲烷中,37 ℃水浴使二者分别溶解后混合,37 ℃下高速匀浆,形成乳液状后转入500 mL 4 ℃的1.5%PVA水溶液中,500 r/min搅拌4~6 h。4 ℃双蒸水冲洗并经孔径为200~500 μm的筛网过筛,冷冻干燥48 h,4 ℃贮存。取上述PGM 500 mg,使用5 mL 0.5%的京尼平交联,4 ℃孵育72 h,双蒸水清洗样品,冷冻干燥48 h。
1.2.2 结构表征 使用相差显微镜观察交联前后的PGM。将干燥的PGM粘附于样品台,喷金2 min,于FESEM下观察显微结构。
1.2.3 热稳定性测试 取样品200 mg,使用热重分析仪进行检测,检测过程中使用氮气保护,加温范围为30~800 ℃,升温速率为10 ℃/min。
1.2.4 体外降解测试 将样品100 mg置于15 mL无菌离心管内,加入10 mL PBS,置于恒温摇床中(80 r/min,37 ℃)。分别于第1、3、7、14、21、28、35、42天取出样品,使用无菌双蒸水冲洗3次,冻干后称重。
1.3 Fe-PGM的制备以及添加OA@Fe3O4剂量的筛选
1.3.1 OA@Fe3O4纳米粒子的结构表征 配制OA@Fe3O4/二氯甲烷分散液(铁元素质量浓度为0.85 mg/mL),将分散液稀释至原10倍体积后,吸取2 μL转移至碳支持膜铜网上,待二氯甲烷挥发后,使用TEM观察纳米粒子形貌。
1.3.2 OA@Fe3O4浸提液的毒性 将1 mg OA@Fe3O4粉末使用1 mL PBS制备浸提液,使用完全培养基分别稀释至0.08、0.4、2、10 μg/mL,过滤除菌后用于培养细胞。96孔板中每孔接种1×103个细胞,加入完全培养液,置于37 ℃、5% CO2、100%湿度的细胞培养箱中培养,24 h后更换为各浓度浸提液(每孔200 μL)继续培养。分别于1、3、5、7 d后吸弃原培养液,加入工作液200 μL(CCK-8液与完全培养液以1∶9的体积比混合),37 ℃孵育2 h,每孔吸取100 μL液体至另一96孔板,使用酶标仪检测在450 nm波长处的光密度(D)值。
1.3.3 Fe-PGM的制备 为制备含铁元素质量分数为0.2%、0.4%、0.8%的Fe-PGM,在制备PGM的过程中,使用上述OA@Fe3O4/二氯甲烷分散液替代纯二氯甲烷溶解PCL,替代的体积比分别23.5%、47.0%、94.0%。
1.3.4 Fe-PGM的细胞增殖 样品于75%乙醇溶液浸泡30 min,无菌PBS漂洗3次,完全培养液中预培养2 h。取无菌样品20 mg,铺于96孔板底部,每孔接种2×103个rBMSC,放置于细胞培养箱中培养,于第1、3、5、7天检测细胞增殖。通过细胞增殖结果筛选出Fe-PGM制备过程中OA@Fe3O4的比例,得到细胞安全性最优的Fe-PGM。
1.4 Fe-PGM的细胞粘附
为进一步研究Fe-PGM载入细胞因子后对细胞行为的影响,我们在该部分分为三组:PGM,Fe-PGM,Fe-PGM+BMP-2。Fe-PGM+BMP-2组的样品为在1% rhBMP-2的PBS溶液中孵育2 h的Fe-PGM。
使用载绿色荧光蛋白基因的慢病毒转染P3 rBMSC(感染复数为25),待绿色荧光蛋白表达后将该细胞接种于各组样品(将50 mg无菌样品铺于48孔板底,每孔接种2.5×104个rBMSC),放置于37 ℃细胞培养箱中。于6、24 h后使用IFM进行观察。
1.5 Fe-PGM的骨诱导性能
通过荧光定量逆转录聚合酶链式反应(quantitative real-time reverse transcription polymerase chain reaction,qRT-PCR)检测其表面rBMSC成骨相关指标的基因表达,分组如下:PGM、Fe-PGM、Fe-PGM + BMP-2。将各组样品100 mg铺于12孔板底部,每孔接种P4 rBMSC 5×104个,使用成骨诱导培养基培养7、14 d,胰酶消化收集细胞。消化下来的细胞使用天根总RNA试剂盒提取总RNA,按照500 ng/mL质量浓度使用PrimerScript RT Master Mix酶逆转录为cDNA,再通过qRT-PCR检测成骨相关基因的表达,步骤如下:使用384孔板10 μL体系,每孔加入1 μL cDNA、0.8 μL引物(引物详见表1)、5 μL SYBR Premix EX Taq Ⅱ 酶、0.2 μL ROX Reference Dye、3 μL双蒸水,置于ABI QuantStudio 7荧光定量PCR仪上反应,反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,50个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,60 ℃ 15 s。以GAPDH为内参,PGM为对照组,最终数据使用2-ΔΔCt法进行分析。
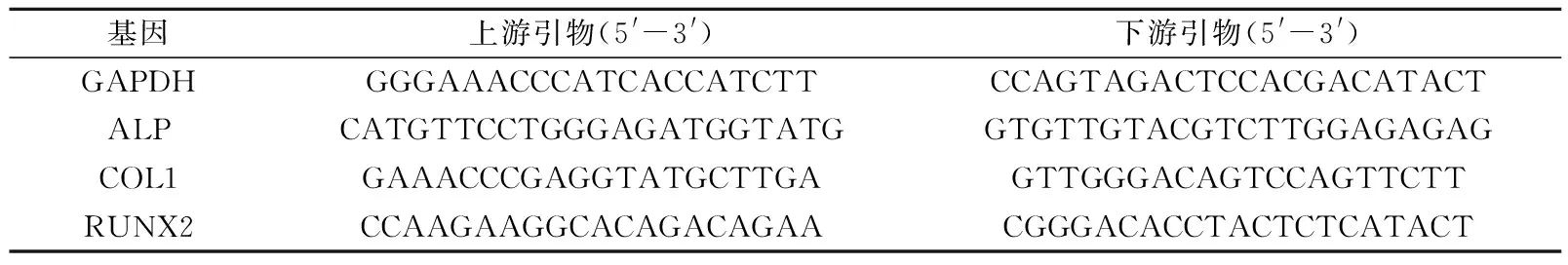
表1 qRT-PCR引物序列Tab.1 Primer sequences for qRT-PCR
1.6 统计学分析
以上所有数据采用SPSS 22.0进行统计分析,Graphpad Prism 9.1.1作图,以平均值±标准差的形式表示,组间比较采用单因素方差分析,两两比较采用最小显著性差异法(least-significant difference,LSD)检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 PGM的形貌
PGM的形貌如图1所示,其由多孔PCL骨架与明胶水凝胶组成:PCL骨架呈现为网络结构,内部为相互连通的孔隙,孔隙直径约为(151.30±44.06) μm;该孔隙内填充着明胶水凝胶。在交联前,PGM中的明胶吸水后溶胀,呈现出膨隆的半球形外观,表面粗糙疏松。在交联后,PGM中的明胶表面紧实平整,冻干后出现塌陷。

图1 PGM的形貌Fig.1 Morphology of PGM
2.2 PGM的成分与降解
PGM的成分可由热稳定性检测获得。如图2A所示,未交联与已交联的PGM成分类似,两组曲线基本重叠,无明显差异。随着温度的升高,质量均呈梯度损失,且有三个快速变化期:第一个变化期约在100 ℃之前,此期的出现为样品内水蒸发,损失质量约占总质量的4.5%;第二个变化期的温度范围275~380 ℃,主要对应明胶的损失,在此期间损失的质量约占总质量的30%;与之移行第三个变化期则主要对应PCL和部分残余明胶的损失,在此期间损失的质量约占总质量的50%;最终残余质量稳定约为16%。
体外降解结果如图2B所示,未交联的PGM在7 d内质量快速下降,于第7天时到达平台期。而交联后的PGM前期质量损失较为缓慢,于14 d时质量快速下降,在第35天时到达平台期。未交联的PGM与交联后的PGM在第42天时剩余质量分别为48.4%与45.3%,两者无统计学差异,逼近PCL占PGM总质量的百分比(50%,上文提及)。
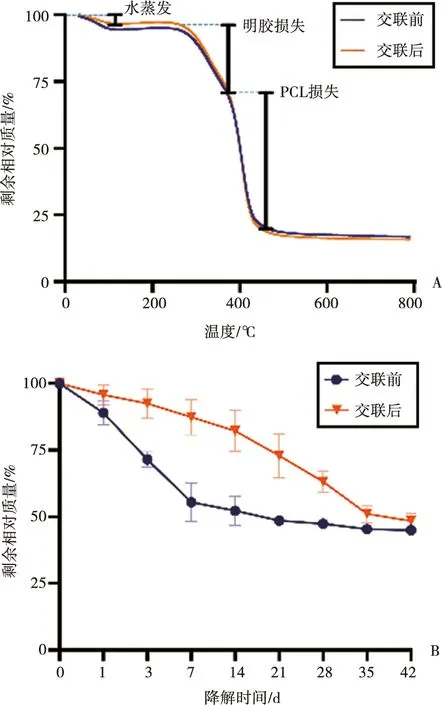
A:热稳定性研究图;B:称重法检测PGM的体外降解
2.3 OA@Fe3O4及其毒性
OA@Fe3O4的透射电镜照片如图3A所示,纳米粒子呈现为均质多面体形貌,粒径为(8.7±1.3) nm。
OA@Fe3O4浸提液的细胞毒性结果如图3B所示,从第1天到第7天,所有浓度浸提液组的细胞增殖与对照组比均无明显抑制。其中,第5天时2 μg/mL组的细胞增殖较对照组出现明显促进(P<0.05),10 μg/mL组在第3天较0.08 μg/mL组、在第5天相较于其他低浓度浸提液组出现暂时的细胞增殖抑制(P<0.05)。
2.4 含有不同剂量OA@Fe3O4的Fe-PGM的细胞增殖
不同含量OA@Fe3O4的Fe-PGM的细胞增殖结果如图3C所示。从第1天至第7天,各组的D值呈递增趋势,说明rBMSC可以在各组支架上稳步增殖。其中,0.8% Fe-PGM组在3 d和7 d时的D值显著性低于PGM组(P<0.05),其余均无统计学差异。
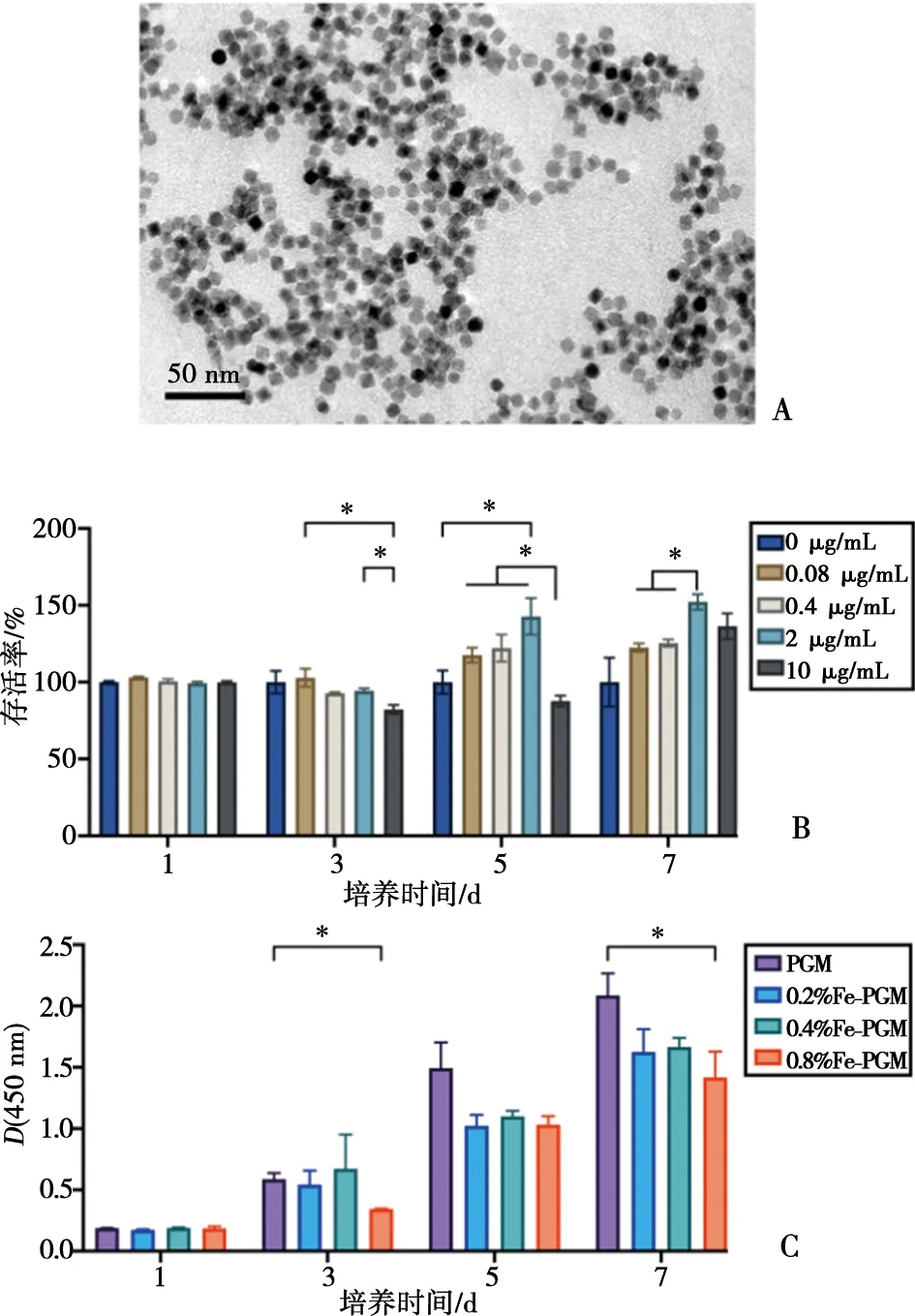
A:OA@Fe3O4的透射电镜图;B:不同浓度OA@Fe3O4浸出液的细胞毒性(*:P<0.05, n=3);C:含有不同浓度OA@Fe3O4的Fe-PGM的细胞增殖(*:P<0.05, n=3)
2.5 Fe-PGM的细胞粘附
经IFM观察,rBMSC在慢病毒转染后的72 h出现绿色荧光。其粘附于微球表面的荧光图片如图4所示。接种后6 h,PGM、Fe-PGM、Fe-PGM+BMP-2三组微球表面均有rBMSC粘附,细胞形态较圆,未见明显伪足,Fe-PGM组表面细胞数目与PGM组差异不明显,Fe-PGM+BMP-2组表面的细胞较多且可见伪足。培养24 h后,各组微球表面均有细胞粘附,细胞呈典型梭形,伪足伸展,胞间互相接触连接,PGM组与Fe-PGM组的粘附细胞数目差异不明显,但均少于Fe-PGM+BMP-2组。
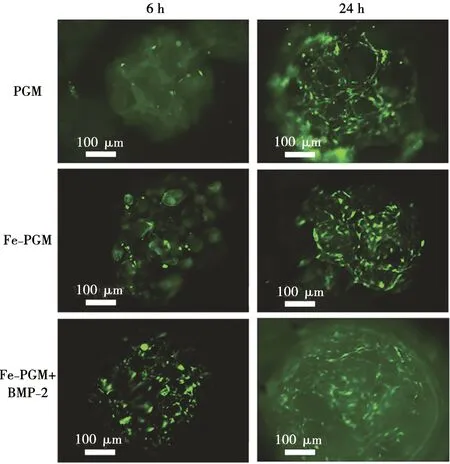
绿色荧光处为慢病毒转染的rBMSC
2.6 Fe-PGM的骨诱导性能
rBMSC成骨相关指标的基因表达如图5所示。在成骨诱导的第7天,Fe-PGM+BMP-2组的ALP基因表达显著高于其余两组(P<0.05),Fe-PGM组和Fe-PGM+BMP-2组的COL1基因表达显著高于PGM组(P<0.05),三组的RUNX2基因表达无显著差异。在成骨诱导的第14天,Fe-PGM组与Fe-PGM+BMP-2组在ALP、COL1、RUNX2的基因表达中均显著高于PGM组(P<0.05),Fe-PGM+BMP-2组在ALP、RUNX2的基因表达中显著高于Fe-PGM组(P<0.05)。
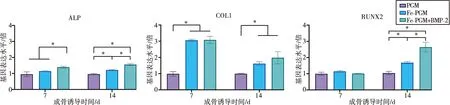
成骨诱导7、14 d时各组成骨基因相对表达倍数(*:P<0.05, n=3)
3 讨 论
本研究通过复乳液法成功制备了PGM支架,其由PCL多孔骨架及明胶水凝胶构成。京尼平的交联提高明胶的抗溶胀性、耐酶解性,赋予其良好的初期稳定特点[21]。因此在本研究的体外降解实验中,PGM的剩余质量曲线平缓,质量损失缓慢。并且,京尼平与BMP-2等小分子蛋白所带电荷相反,可相互吸引,有利于生长因子的负载与缓释[22]。体外降解实验结束时,交联后PGM的剩余质量逼近50%,说明了明胶在第42天已几乎完全降解,这有利于后期骨组织的长入。
纳米粒子浸出液细胞毒性实验显示,OA@Fe3O4有较高的安全剂量范围。然而过高的OA@Fe3O4浓度仍然会对细胞产生不利影响,铁过载会导致细胞内过氧化,从而损伤细胞功能[23]。含不同浓度铁的Fe-PGM的CCK-8结果表明,载有较高浓度OA@Fe3O4的微球会抑制细胞增殖。因此筛选出合适的支架内铁浓度为0.4%,以进一步验证其生物学效应。
细胞粘附实验表明,PGM和Fe-PGM在6 h及24 h均具有良好的细胞粘附特性,两者之间无明显差异。虽然Russo等[10]的研究表明,OA@Fe3O4可以增加PCL的表面粗糙度以利于细胞铺展。我们推测这是因为微球中的OA@Fe3O4仅分布在PCL支架中,并非所有粘附细胞均与其有接触,因此本实验中纳米铁对细胞的粘附与铺展作用并不明显。Fe-PGM良好的载药性能可赋予其更好的细胞学特性,Fe-PGM+BMP-2在6、24 h时显示出优于其余两组的细胞铺展。这与Sun等[24]的研究相符合,Sun等将BMP-2固定在种植体表面,早期显著地促进了干细胞的粘附与铺展,这可能与BMP-2可增加干细胞特异性整合素受体亚基表达的功能相关。
荧光定量PCR的结果显示,纳米铁粒子显著地增加了ALP、COL1、RUNX2基因的表达量。这与目前的一些研究相一致:Hao等[14]发现PLGA/OA@Fe3O42D支架上的MC3T3-E1细胞,14 d的ALP表达水平及钙结节沉积显著性高于PLGA组;Sajesh等[25]的研究表明,大鼠颅顶骨缺损内植入的3D磁性支架对骨损伤修复有一定促进作用。可能涉及的机制为:复合了磁性纳米颗粒的支架拥有合适的表面硬度,且可以产生微弱的空间磁场,可能对其内的rBMSC有一定交互作用;rBMSC通过多种膜表面受体对外界的力学及磁刺激进行感知,并通过MAPK等多条通路影响细胞的遗传物质表达,影响细胞的成骨分化动力[26]。而BMP-2的载入进一步促进了细胞的成骨分化,该机制为:BMP-2可通过结合细胞膜上的配体,激活MAPK、Smad等通路,促进干细胞向骨细胞分化[27-28];BMP-2可与微小的机械或磁刺激协同作用于细胞[29],进一步提升了Fe-PGM的成骨诱导效果。并且,交联后的明胶具有良好的BMP-2负载效果,比如Zhang等[30]将BMP-2吸附于PCL支架表面的明胶涂层,释放时间可达110 h。在本研究中,在第7和第14天时Fe-PGM+BMP-2的部分成骨指标均显著高于Fe-PGM组,提示在成骨诱导的早至中期,体外培养环境中的BMP-2可保持一定的浓度,发挥促进rBMSC成骨分化的作用。
综上所述,本研究制备出了可负载生长因子的磁性微球支架。适当浓度纳米铁的载入可使PGM保持原有良好的细胞增殖与粘附特性,并且其明胶内部可载入生长因子(如BMP-2),能进一步促进其表面干细胞的成骨分化。本研究将为今后颗粒支架的改进与设计提供新思路。
