一种新分离的人肠道细菌静息细胞对大豆苷的生物转化*
2022-05-09朱金惠王玲陶金华马振祥
朱金惠,王玲,陶金华*,马振祥
(南通大学1 公共卫生学院,2 药学院,南通 226019)
功能性食品可以预防、延缓或帮助治疗慢性或急性疾病,如心血管疾病、癌症、免疫障碍和骨质疏松[1],其安全性、营养性和功能性受到越来越多的关注。黄酮类化合物是人类饮食中消耗的主要植物雌激素来源[2],研究[3]表明,异黄酮由于其具有较高的亲水性和分子量,在植物体内大部分与糖结合成苷类或碳糖基的形式存在,致其口服生物利用度较低,其雌激素活性低于相应水解产物异黄酮苷元。因此肠道微生物区系对大豆食品中异黄酮的生物利用度起着重要作用[4]。
微生物群落的组成受年龄、饮食、环境及系统发育的影响[5],食用的功能性食品及草药的成分在被吸收之前与消化道微生物区系接触[6-7]。在没有疾病和抗菌治疗的情况下,个体粪便中的肠道菌群被认为是相当稳定的。尽管对粪便微生物区系的组成和功能以及对黏膜微生物区系不同程度的认识尚不清楚,但粪便样品由于易获得,通常被用于研究肠道微生物区系[8]。
细菌的生长细胞和静息细胞都可以用于生物转化实验。静息细胞是活的,较少分裂甚至不分裂,保持了细胞的许多酶活性,广泛用于酶生物合成的研究。与生长细胞相比,静息细胞生物转化具有反应时间短、反应条件温和、产物分离方便、对设备和能量要求低的优点。此外,通过静息细胞的生物转化能够以相同产量水平重复至少3 次且只产生少量的杂质,这对复杂生物样品中痕量分析物的检测非常有益[9]。
本研究从人体粪便中分离出一种新的肠道细菌,采用超高效液相色谱/四极杆飞行时间质谱联用技术(ultra-performance liquid chromatography/quadrupoletime-of-flight mass spectrometry,UPLC-Q-TOF/MS)联合自动数据分析方法(MetaboLynx)测定其静息细胞转化大豆苷的能力,同时鉴定其代谢产物[10]。
1 材料与方法
1.1 仪器与材料 厌氧包装矩形罐购自三菱气体化学公司(日本),高效液相色谱级乙腈购自泰达公司(美国),甲酸购自默克公司(德国),蒸馏水由EPED超级净化系统净化(南京),其他试剂是分析级的。大豆苷及大豆苷元标准品购自上海温赫伯医疗S&T发展有限公司(上海)。
1.2 培养基的制备 发酵实验中使用的普通厌氧培养基的配制:消化性血清粉13.5 g、胰蛋白胨10.0 g、蛋白胨10.0 g、酵母提取物5.0 g、可溶性淀粉5.0 g、大豆蛋白胨3.0 g、葡萄糖3.0 g、氯化钠3.0 g、KH2PO42.5 g、牛肉提取物2.2 g、牛肝提取物粉1.2 g、L-半胱氨酸盐酸盐0.3 g、巯基乙酸钠0.3 g 和蒸馏水约1 000 mL。用氢氧化钠水溶液调节酸碱度至7.3,然后在121 ℃高压灭菌20 min。
1.3 细菌的分离和培养 从1 位健康女性志愿者(3个月内未服用任何药物,并在48 h 内避免饮酒以及摄取富含多酚的食物)处获取新鲜粪便4 g,将其悬浮于20 mL 无菌生理盐水中,通过涡流混合器充分混匀。混合物以2 000 g 离心10 min,上清悬浮液即为人体肠道细菌混合物。将细菌混合物在无菌水中连续稀释,涂抹于GAM(Glfu anaerobic medium)琼脂平板上,在37 ℃厌氧条件下孵育48 h。孵育反应结束后观察平板,初步鉴定了约100 种不同类型的菌落[11]。将从GAM 琼脂平板上提取的每种细菌接种到1.0 mL GAM 培养基中,并在37 ℃厌氧条件下孵育24 h。
1.4 16S rRNA 基因测序及系统发育分析 使用DNA 纯化试剂盒从分离物中提取细菌基因组DNA。用两个通用引物扩增16S rRNA 序列,革兰阴性菌,16S-2F:CATGCAAGTCGARCG,16S-2R:GGTGTGACGGGCGGT;革兰阳性菌,16S-1F:AGAGTTTGATCCTGGCTCAG,16S-1R:AGAAAGGAGGTGATCC。聚合酶链式反应(polymerase chain reaction,PCR)程序:94 ℃1 min(预变性);94 ℃30 s(高温变性)、55 ℃30 s(退火)、72 ℃2 min(扩增),共29 个循环;72 ℃10 min(延伸)。PCR 产物使用凝胶纯化试剂盒从琼脂糖凝胶中纯化。16S rRNA 片段的测序由美吉生物(上海,中国)进行。16S rRNA 基因序列的同源性搜索由EzBioCloud server 完成。采用CLUSTAL-W 程序和MEGA(5.0 版)软件的邻域连接方法构建了系统发育树[12]。新分离的人体肠道细菌菌株埃希氏菌sp.88,利用其静息细胞生物转化大豆苷。
1.5 利用静息细胞生物转化大豆苷 用无菌生理盐水将GAM 预培养的细菌洗涤3 次,悬浮在5×10-2mol/L 的磷酸缓冲盐溶液中(pH 7.0)制备静息细胞。通过将精确称量的大豆苷溶解在甲醇中制备大豆苷的标准溶液,最终质量浓度为3.0 mg/mL。
转化系统中不同静息细胞浓度对代谢产物产量有显著影响[13]。为了研究不同细菌浓度对大豆苷生物转化的影响,将菌株sp.88 的静息细胞数分别稀释至106、107、108、109个/mL。向1 mL 静息细胞悬浮液中加入14 μL 大豆苷原液,然后样品在37 ℃厌氧条件下孵育48 h。
在静息细胞浓度为109个/mL 的条件下进行大豆苷代谢的时程实验,然后样品在37 ℃厌氧条件下孵育,并在0、6、12、24、48、72 h 时检测大豆苷的代谢产物。
分析前,将每个样品溶解在0.3 mL 甲醇中,以12 000 g 离心10 min。上清液用0.22 μm 的膜过滤,用于UPLC/MS 分析。
1.6 UPLC/MS 检测分析 根据保留时间和MS/MS光谱,与空白样品相比,检测到大豆苷M0 和一种代谢物M1。为了鉴定大豆苷及其代谢物,在方法开发中尝试了包括电喷雾(electrospray ionization,ESI)+和ESI-模式。发现ESI-模式比ESI+模式更灵敏。因此,发酵上清液中代谢产物的表征是基于在ESI-模式下的离子碎裂。由于保留时间和分子离子峰与标准品相同,因此检测到大豆苷(M0)。
1.7 静息细胞葡萄糖苷酶活性测定 菌株sp.88 于37 ℃条件下在1 mL 的GMA 培养基中培养2、4、6、8、12、16、24 h,然后悬浮液以5 000 g 离心10 min。将上清液(0.3 mL)在磷酸缓冲盐溶液(0.2 mol/L,pH 7.3)中稀释5 倍,再在37 ℃条件下与0.25×10-3mol/L 的对硝基苯-β-D-葡萄糖苷(4-Nitrophenyl beta-Dglucosaminide,PNP-β-D-glu)孵育。收集反应溶液的等分试样,并在96 孔微孔板中用水(1∶10)稀释。用酶标仪在405 nm 处测量每个孔的吸光度。用一系列不同浓度PNP 的吸光度来计算菌株sp.88 的酶活性。
2 结 果
2.1 新分离人体肠道细菌菌株88 的特征 新分离菌株88 的16S rRNA 基因约为1 300 个碱基对序列,该核苷酸序列已在基因库中注册,登记号为KC819126。用CLUSTALW 程序比较16S rRNA 基因序列,确定菌株88 的系统进化关系(图1)。与大肠埃希菌KCTC 2441(99.31%,EU014689)、费格森埃希菌ATCC 35469(99.23%,CU928158)、艾伯替埃希菌TW07627(98.62%,ABKX01000030)、大肠埃希菌O157 EC4115(98.46%,CP001164)具有较高的序列相似性。然而,其16S rRNA 序列与其他属的同源性较低,如克氏柠檬酸杆菌CDC 3613-63(97.31%,AF025372),吉伦氏柠檬酸杆菌CDC 4693-86(95.93%,AF025367),牛肠杆菌CIP 107300(96.84%,AJ508303),生癌肠杆菌LMG 2693(96.38%,Z96078),阿氏肠杆菌JCM 6051(96.24%,AB004744),潘托亚瓦力西菌LMG 26277(96.71%,JF295057)和分散泛菌LMG 2603(96.63%,DQ504305)。因此,将菌株88 鉴定为埃希菌属的一种,并命名为埃希菌sp.88。

图1 菌株88 的系统进化树
2.2 埃希菌sp.88 静息细胞对大豆苷的生物转化UPLC/MS 结果显示当埃希菌sp.88 静息细胞浓度为109个/mL 时,大豆苷(M0)完全转化为其代谢物(M1)(图2)。因此,选用该浓度进行大豆苷代谢的时程实验。与仅含埃希菌sp.88 静息细胞不含大豆苷的空白样品相比,大豆苷的量随孵育时间的增加逐渐减少,在48 h 时大豆苷被埃希菌sp.88 静息细胞完全生物转化(图3)。
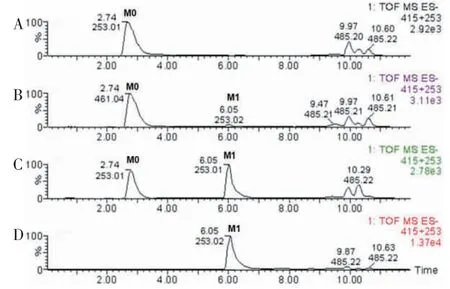
图2 4 种不同浓度大豆苷及其代谢物的UPLC/MS 色谱图
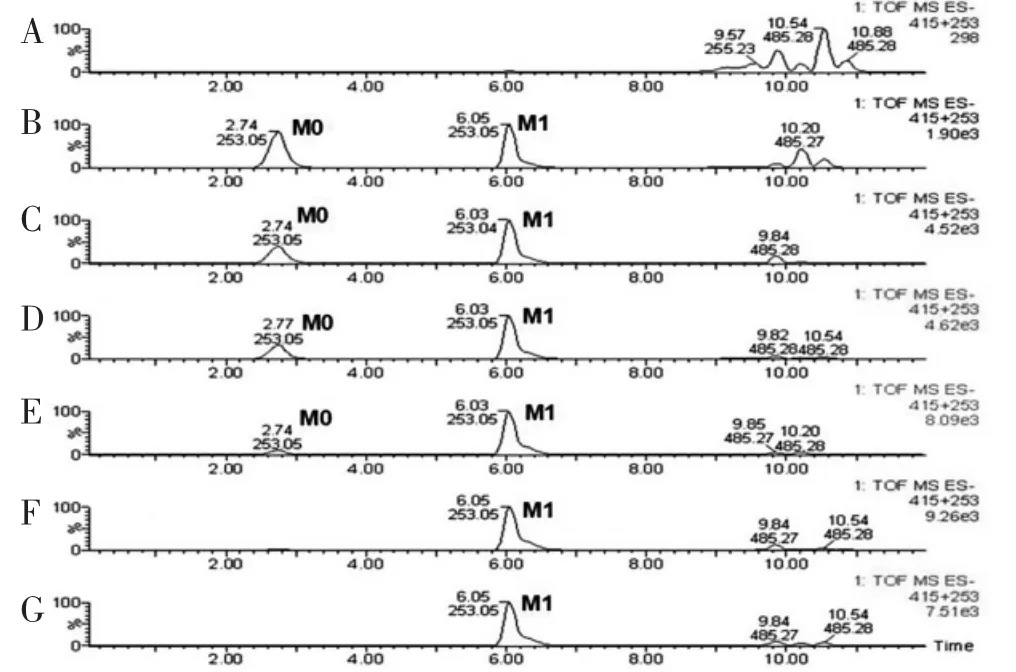
图3 新陈代谢时程实验结果图
2.3 代谢物的鉴定 采用MS 扫描模式,大豆苷的去质子化分子离子[M-H]-(保留时间2.74 min)分别在m/z 415、253、252、224、208 显示信号(图4)。如MS/MS 光谱所示,在m/z 415 处的前体离子[M-H]-由于葡糖苷部分的损失得到了在m/z 253 处的大豆苷元产品离子。m/z 252 处的产物离子是通过从m/z 253 中除去H 而产生的。然后,m/z 252 由于羰基的损失被进一步分割成m/z 224,m/z 224 失去羟基分割成m/z 208(图5)。代谢物M1 在m/z 253 处被检测为去质子化分子离子[M-H]-,保留时间为6.05 min,比M0 低162 Da。在M1 的MS/MS 光谱中显示出与M0 大豆苷相似的产物离子(图4)。m/z 224 和208 处的特征碎片离子分别对应于从m/z 253 中消除的CHO 和CH2O2(图5)。基于这些结果,M1 被鉴定为大豆苷元,是大豆苷失去一个葡糖苷而去糖基化的产物。此外,根据其保留时间,MS 和MS/MS 光谱与大豆苷元标准品比较,进一步证实了M1。M1 的UPLC-MS/MS 信号与标准品基本一致。
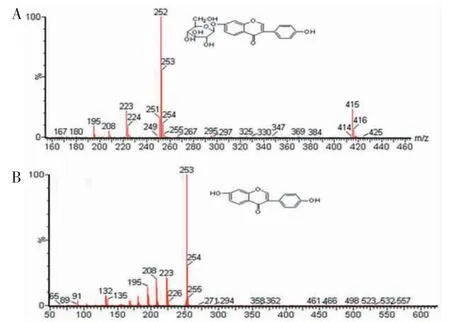
图4 大豆苷(M0)及代谢物(M1)的质谱信号显示图
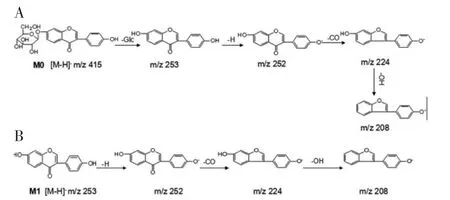
图5 大豆苷(M0)及代谢物(M1)结构变化时质谱信号变化流程图
2.4 β-D-glu 酶活性 用PNP-β-D-glu 作为相应酶的底物进行分析,结果显示PNP-β-D-glu 与大肠埃希菌sp.88 孵育后释放PNP,β-D-glu 酶活性在0~24 h 内升高,24 h 时PNP 含量最高(图6)。因此,先培养大肠埃希菌sp.88 24 h,然后制备其静息细胞以生物转化大豆苷。
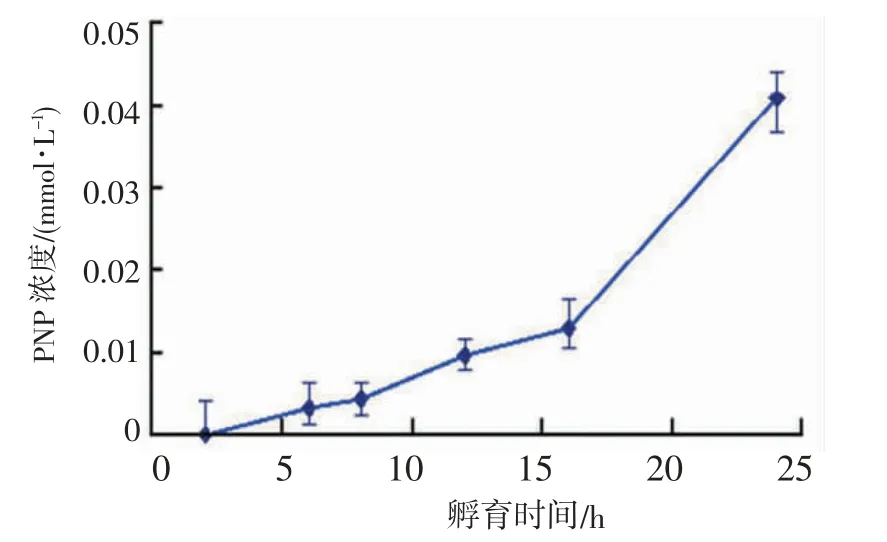
图6 PNP 浓度与孵育时长关系图(n=3)
3 讨 论
本研究使用了一个新分离的人肠道细菌埃希菌sp.88 静息细胞来代谢大豆苷。在UPLC/MS 色谱图中,除大豆苷元外,没有其他代谢产物,这与用不同细菌进行的研究相似。例如,双歧杆菌可以从大豆苷中释放苷元,但未发现大豆苷元减少的代谢物[14]。兼性厌氧菌菌株可以代谢大豆异黄酮葡萄糖苷为其苷元,但无其他代谢物。一些专性厌氧菌完全不代谢大豆异黄酮糖苷,而需氧菌几乎不能代谢大豆异黄酮糖苷[15]。
也有报道[16]显示,梭状芽孢杆菌和分枝真杆菌能在体外将大豆苷元代谢为O-去甲基安哥拉紫檀素。在双歧杆菌发酵的豆奶中发现了雌马酚[17]。其他细菌包括卵形拟杆菌、大肠埃希菌、产瘤胃球菌和中间链球菌可能参与大豆苷元的代谢。大肠埃希菌HGH21 能将大豆苷生物转化为大豆苷元,并进一步将异黄酮大豆苷元代谢为二氢大豆苷元[11]。然而,大肠埃希菌JCM5491 没有将大豆苷转化为大豆苷元[15]。本研究中分离出的埃希菌sp.88 未进一步生物转化大豆苷元,表明大豆苷生物转化为大豆苷元或二氢大豆苷元不是大肠埃希菌的一般特征。
据报道[18],大豆苷对离体线粒体中乙醛脱氧酶2有抑制作用并可用作抗乙醇剂。同时大豆苷元比大豆苷具更强的抗氧化性、抗肿瘤细胞毒性作用和雌激素效应[19],且由于其较高的亲脂性和小分子量特性,苷元的吸收率高于相应的糖苷。由于食物中几乎所有的异黄酮都以糖苷的形式存在,因此有必要水解糖苷键以促进肠道吸收,从而实现生理活性[20]。该代谢物似乎是结肠微生物区系对异黄酮的第一个还原产物。这对于大豆苷元的释放,通过结肠黏膜提高大豆苷吸收的生物利用度或通过其他人体肠道微生物进一步生物转化为O-去甲基安哥拉紫檀素和雌马酚。
基于16S rRNA 基因测序,本研究将从人体粪便中分离出的菌株88 被鉴定为大肠埃希菌属的一个新种,并首次对其转化大豆苷的能力进行了研究。为了排除GAM 中各成分的干扰,采用大肠埃希菌sp.88 静息细胞代谢大豆苷。此外,建立了UPLC-QTOF/MS 技术结合MetabolynxTM软件进行数据分析,并应用于鉴定其静息细胞产生的大豆苷及其代谢物。当静息细胞浓度为109个/mL 细胞时,48 h 的生物转化率最高。代谢物大豆苷元不仅能提高大豆苷的生物利用度还能提高其生物活性。如UPLC/MS光谱所示,未检测到静息细胞产生的杂质。
综上,大肠埃希菌sp.88 在大豆苷的代谢中起重要作用。然而,需要进一步研究人体肠道细菌中相关酶调节。
